氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。
(1)已知:2NH3(g) N2(g)+3H2(g),活化能Ea1=600 kJ/mol,合成氨有关化学键的键能如下表:
N2(g)+3H2(g),活化能Ea1=600 kJ/mol,合成氨有关化学键的键能如下表:
则合成氨反应:N2(g)+3H2(g) 2NH3(g)的活化能Ea2=
2NH3(g)的活化能Ea2=___________ 。
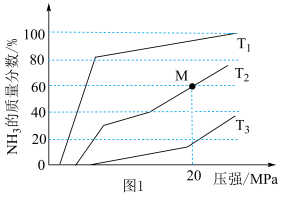
(2)在一定条件下,向某反应容器中投入1 mol N2、3mol H2在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图1所示。___________ , M点N2的转化率为___________ 。
(3)采用催化剂存在下臭氧氧化—碱吸收法同时脱除SO2和NO。
反应I:NO(g)+O3(g) NO2(g)+O2(g)
NO2(g)+O2(g)  = -200.9 kJ/mol
= -200.9 kJ/mol
反应II:SO2(g)+O3(g) SO3(g)+O2(g)
SO3(g)+O2(g)  =-241.6 kJ/mol
=-241.6 kJ/mol
一定条件下,向容积为2 L的反应器充如2.0 mol NO、2.0molSO2的模拟烟气和4.0molO3,升高温度,体系中NO和SO2的转化率随温度T变化如图2所示。___________ 。
A.温度越高,脱除SO2和NO的效果越好
B.相同温度下, NO的转化率远高于SO2
C.可根据不同温度下的转化率选择最佳温度脱除SO2和NO
(4)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)  H=-746.8 kJ/mol。
H=-746.8 kJ/mol。
实验测得:v正=k正p2(NO)·p2(CO),v逆=k逆p(N2)。p2(CO2)。其中k正、k逆分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。
①达到平衡后,仅升高温度,k正增大的倍数___________ (选填“大于”“小于”或“等于”) k逆增大的倍数。
②一定温度下在刚性密闭容器中充入CO、NO和N2物质的量之比为2:2:1,压强为p0 kPa.达平衡时压强为0.9p0 kPa,则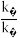 =
=___________ 。
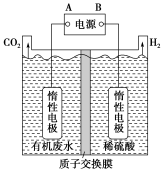
(5)氮的氧化物脱除可用电化学原理处理,如图3装置可同时吸收SO2和NO。直流电源的正极为__________ (选填“a”或“b”),阳极的电极反应式___________ 。该电解装置选择___________ (选填“阳”或“阴")离子交换膜。
(1)已知:2NH3(g)
 N2(g)+3H2(g),活化能Ea1=600 kJ/mol,合成氨有关化学键的键能如下表:
N2(g)+3H2(g),活化能Ea1=600 kJ/mol,合成氨有关化学键的键能如下表:| 化学键 | H-H | N≡N | N-H |
| 键能/kJ/mol | 436 | 946 | 391 |
 2NH3(g)的活化能Ea2=
2NH3(g)的活化能Ea2=(2)在一定条件下,向某反应容器中投入1 mol N2、3mol H2在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图1所示。
(3)采用催化剂存在下臭氧氧化—碱吸收法同时脱除SO2和NO。
反应I:NO(g)+O3(g)
 NO2(g)+O2(g)
NO2(g)+O2(g)  = -200.9 kJ/mol
= -200.9 kJ/mol反应II:SO2(g)+O3(g)
 SO3(g)+O2(g)
SO3(g)+O2(g)  =-241.6 kJ/mol
=-241.6 kJ/mol一定条件下,向容积为2 L的反应器充如2.0 mol NO、2.0molSO2的模拟烟气和4.0molO3,升高温度,体系中NO和SO2的转化率随温度T变化如图2所示。
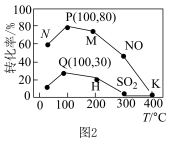
A.温度越高,脱除SO2和NO的效果越好
B.相同温度下, NO的转化率远高于SO2
C.可根据不同温度下的转化率选择最佳温度脱除SO2和NO
(4)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)
N2(g)+2CO2(g)  H=-746.8 kJ/mol。
H=-746.8 kJ/mol。实验测得:v正=k正p2(NO)·p2(CO),v逆=k逆p(N2)。p2(CO2)。其中k正、k逆分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。
①达到平衡后,仅升高温度,k正增大的倍数
②一定温度下在刚性密闭容器中充入CO、NO和N2物质的量之比为2:2:1,压强为p0 kPa.达平衡时压强为0.9p0 kPa,则
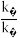 =
=(5)氮的氧化物脱除可用电化学原理处理,如图3装置可同时吸收SO2和NO。直流电源的正极为

更新时间:2024-04-18 21:49:35
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】聚丙烯简称PP,是一种应用非常广泛的有机合成高分子材料,其单体丙烯可以通过丙烷催化剂脱氢制备。
已知:

(1)
___________ 0(填“>”、“<”或“=”),该反应在___________ (填“高温”或“低温”)更容易自发进行。
(2)已知 、
、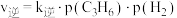 ,其中
,其中 、
、 为速率常数。
为速率常数。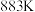 ,
, 时,
时,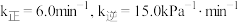 ,在容器中投入一定量的
,在容器中投入一定量的 ,反应达到平衡时,
,反应达到平衡时,
___________ 。( )
)
(3)已知速率常数k与温度T的关系可表示为: 。其中
。其中 为反应活化能,
为反应活化能,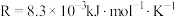 ,A为常数。
,A为常数。
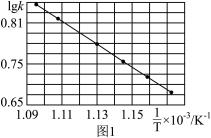
①丙烷脱氢速率常数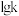 与
与 的图像如图1所示,则可通过斜率计算
的图像如图1所示,则可通过斜率计算___________ 。
②800K时,其他条件不变,使用某催化剂使丙烷脱氢反应的总活化能降低了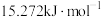 ,则反应速率变为原来的
,则反应速率变为原来的___________ 倍。
③若催化剂能降低相同的活化能,当温度越___________ (填“高”或“低”)时, 越大。
越大。
(4)“丙烷催化脱氢膜反应器”的原理如图2所示。在一定压强下,该装置采用___________ 措施提高了 的转化率。
的转化率。

(5)丙烷催化氧化也是制备丙烯的常见方法,下图为两种催化剂(甲采用碳基催化剂,乙采用钒系催化剂)催化氧化丙烷的机理。
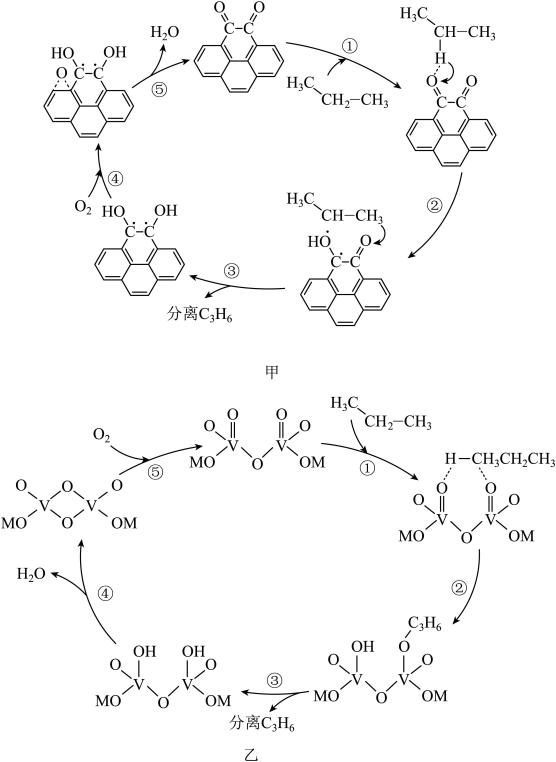
下列说法正确的是___________。
已知:


(1)

(2)已知
 、
、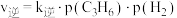 ,其中
,其中 、
、 为速率常数。
为速率常数。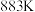 ,
, 时,
时,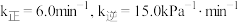 ,在容器中投入一定量的
,在容器中投入一定量的 ,反应达到平衡时,
,反应达到平衡时,
 )
)(3)已知速率常数k与温度T的关系可表示为:
 。其中
。其中 为反应活化能,
为反应活化能,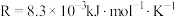 ,A为常数。
,A为常数。①丙烷脱氢速率常数
 与
与 的图像如图1所示,则可通过斜率计算
的图像如图1所示,则可通过斜率计算
②800K时,其他条件不变,使用某催化剂使丙烷脱氢反应的总活化能降低了
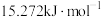 ,则反应速率变为原来的
,则反应速率变为原来的③若催化剂能降低相同的活化能,当温度越
 越大。
越大。(4)“丙烷催化脱氢膜反应器”的原理如图2所示。在一定压强下,该装置采用
 的转化率。
的转化率。
(5)丙烷催化氧化也是制备丙烯的常见方法,下图为两种催化剂(甲采用碳基催化剂,乙采用钒系催化剂)催化氧化丙烷的机理。

下列说法正确的是___________。
| A.每步反应都是氧化还原反应 |
| B.两种催化剂都可防止丙烯进一步被氧化 |
| C.碳基催化剂的活性温度低 |
D.若用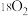 参与反应,最终两种催化剂中都含有 参与反应,最终两种催化剂中都含有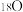 |
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】完成下列小题
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和 )。
)。 与
与 通入聚集太阳能反应器,发生反应
通入聚集太阳能反应器,发生反应
 。
。
已知:Ⅰ. 、
、 、CO的燃烧热(
、CO的燃烧热( )分别为
)分别为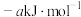 、
、 、
、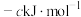 ;
;
Ⅱ.
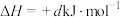 。
。
则
_____  (用含字母a、b、c、d的代数式表示)。
(用含字母a、b、c、d的代数式表示)。
(2)用合成气生成甲醇的反应为
 ,在10L恒容密闭容器中按物质的量之比1:2充入CO和
,在10L恒容密闭容器中按物质的量之比1:2充入CO和 ,200℃时
,200℃时 随时间的变化如表所示:
随时间的变化如表所示:
①0~3min内用 表示的反应速率
表示的反应速率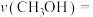
_____ 。
②200℃时,该反应的平衡常数
_____ 。向上述200℃达到平衡的恒容密闭容器中再加入5molCO、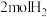 、
、 ,保持温度不变,则反应
,保持温度不变,则反应_____ (填“正向”“逆向”或“不”)进行。
③上述反应如果在绝热恒容的密闭环境下进行,下列各项可作为该反应达到平衡状态的标志的是_____ (填字母)。
A.混合气体密度不再变化
B.容器内的温度保持不变
C.CO和 的物质的量之比保持不变
的物质的量之比保持不变
D.CO的消耗速率与 的生成速率之比为1:1
的生成速率之比为1:1
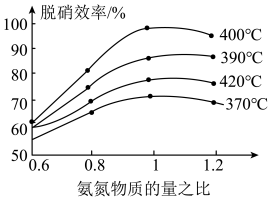
(3)汽车尾气是雾霾形成的原因之一、研究氮氧化物的处理方法可有效减少雾霾的形成,可采用在催化剂作用下氧化还原法脱硝: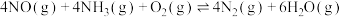
 。根据图示判断提高脱硝效率的最佳条件是
。根据图示判断提高脱硝效率的最佳条件是_____ ;氨氮物质的量之比一定时,在400℃时,脱硝效率最大,其可能的原因是_____ 。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和
 )。
)。 与
与 通入聚集太阳能反应器,发生反应
通入聚集太阳能反应器,发生反应
 。
。已知:Ⅰ.
 、
、 、CO的燃烧热(
、CO的燃烧热( )分别为
)分别为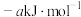 、
、 、
、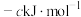 ;
;Ⅱ.

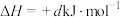 。
。则

 (用含字母a、b、c、d的代数式表示)。
(用含字母a、b、c、d的代数式表示)。(2)用合成气生成甲醇的反应为

 ,在10L恒容密闭容器中按物质的量之比1:2充入CO和
,在10L恒容密闭容器中按物质的量之比1:2充入CO和 ,200℃时
,200℃时 随时间的变化如表所示:
随时间的变化如表所示:| t/min | 0 | 1 | 3 | 5 |
 /mol /mol | 8.0 | 5.4 | 4.0 | 4.0 |
 表示的反应速率
表示的反应速率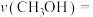
②200℃时,该反应的平衡常数

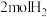 、
、 ,保持温度不变,则反应
,保持温度不变,则反应③上述反应如果在绝热恒容的密闭环境下进行,下列各项可作为该反应达到平衡状态的标志的是
A.混合气体密度不再变化
B.容器内的温度保持不变
C.CO和
 的物质的量之比保持不变
的物质的量之比保持不变D.CO的消耗速率与
 的生成速率之比为1:1
的生成速率之比为1:1(3)汽车尾气是雾霾形成的原因之一、研究氮氧化物的处理方法可有效减少雾霾的形成,可采用在催化剂作用下氧化还原法脱硝:
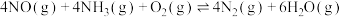
 。根据图示判断提高脱硝效率的最佳条件是
。根据图示判断提高脱硝效率的最佳条件是
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g)∆H1=-53.7kJ/mol
CH3OH(g)+H2O(g)∆H1=-53.7kJ/mol
II.CO2(g)+H2(g) CO(g)+H2O(g)∆H2
CO(g)+H2O(g)∆H2
某实验控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
已知:①CO和H2的标准燃烧热分别为-283.0kJ/mol和285.8kJ/mol
②H2O(1) H2O(g)∆H3=+440kJ/mol
H2O(g)∆H3=+440kJ/mol
请回答(不考虑温度对∆H的影响):
(1)a.反应II的∆H2=____ kJ/mol。
b.800℃时,反应I和II对应的平衡常数分别为1.0和2.5,则该温度下反应:CO(g)+2H2(g) CH3OH(g)的平衡常数K的数值为
CH3OH(g)的平衡常数K的数值为_____ 。
(2)在图中分别画出I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的催化剂)____ 。

(3)工业生产甲醇还有如下方法:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
副反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
若生产过理中在恒压条件下通入水蒸气,从化学平衡的角度分析该操作对生产甲醇带来的利和弊____ 。
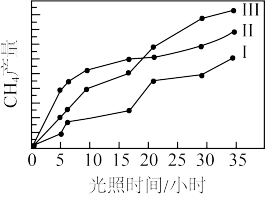
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(1、I、III)作用下,CH4产量随光照时间的变化如下图所示。下列说法正确的是____
A.催化剂能加快化学反应速率,在反应开始时对正反应的催化效果更好
B.从图中可知催化剂I的催化效果更好
C.若光照时间足够长,三条由线将相交于一点
D.光照15h前,无论用所给的哪种催化剂,该反应均未达到平衡
(5)人们正在研究某种锂一空气电池,它是一种环境友好的蓄电池。放电时的总反应为:4Li+O2=2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可是按两步反应进行,请补充完整。
电极反应式:______ 和Li2O2-2e-=2Li++O2
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)∆H1=-53.7kJ/mol
CH3OH(g)+H2O(g)∆H1=-53.7kJ/molII.CO2(g)+H2(g)
 CO(g)+H2O(g)∆H2
CO(g)+H2O(g)∆H2某实验控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
已知:①CO和H2的标准燃烧热分别为-283.0kJ/mol和285.8kJ/mol
②H2O(1)
 H2O(g)∆H3=+440kJ/mol
H2O(g)∆H3=+440kJ/mol请回答(不考虑温度对∆H的影响):
(1)a.反应II的∆H2=
b.800℃时,反应I和II对应的平衡常数分别为1.0和2.5,则该温度下反应:CO(g)+2H2(g)
 CH3OH(g)的平衡常数K的数值为
CH3OH(g)的平衡常数K的数值为(2)在图中分别画出I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的催化剂)

(3)工业生产甲醇还有如下方法:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)副反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)若生产过理中在恒压条件下通入水蒸气,从化学平衡的角度分析该操作对生产甲醇带来的利和弊
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(1、I、III)作用下,CH4产量随光照时间的变化如下图所示。下列说法正确的是
A.催化剂能加快化学反应速率,在反应开始时对正反应的催化效果更好
B.从图中可知催化剂I的催化效果更好
C.若光照时间足够长,三条由线将相交于一点
D.光照15h前,无论用所给的哪种催化剂,该反应均未达到平衡

(5)人们正在研究某种锂一空气电池,它是一种环境友好的蓄电池。放电时的总反应为:4Li+O2=2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可是按两步反应进行,请补充完整。
电极反应式:
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
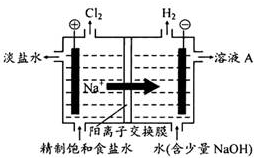
【推荐1】氯碱工业中惰性电极电解饱和的食盐水的原理示意图如图所示:
(1)溶液A的溶质是_________________ 。(填化学式)
(2)电解饱和食盐水的离子方程式是________________________ 。
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用:___________________________ 。
(4)电解所用的盐水需要精制,去除有影响的的Ca 2+ 、Mg 2+ 、NH 4+和SO 42- [c(SO 42-)>c(Ca 2+ )]。精致流程如下(淡盐水和溶液A来电解池):
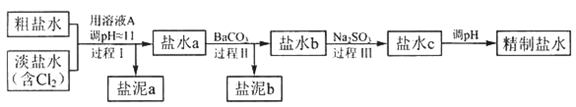
①盐泥a除泥沙外,还含有的物质是_________________ 。(填化学式)
②过程Ⅰ中将NH4+转化为N2的离子方程式是____________________ 。
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有_________________ 。(填离子符号)
(1)溶液A的溶质是
(2)电解饱和食盐水的离子方程式是
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用:
(4)电解所用的盐水需要精制,去除有影响的的Ca 2+ 、Mg 2+ 、NH 4+和SO 42- [c(SO 42-)>c(Ca 2+ )]。精致流程如下(淡盐水和溶液A来电解池):

①盐泥a除泥沙外,还含有的物质是
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和_________________ 。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
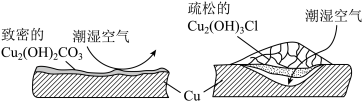
青铜器在潮湿环境中发生电化学腐蚀生成有害锈Cu2(OH)3Cl的原理示意图为:
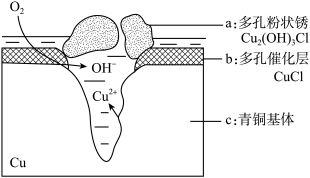
写出正极的电极反应式____________ ;若生成2.145 g Cu2(OH)3Cl,理论上消耗标准状况下氧气的体积为________ L。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:

①过程Ⅰ的正极反应物是___________ 。
②过程Ⅰ负极的电极反应式是__________________________________ 。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:
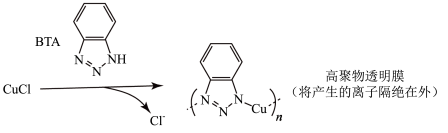
请回答下列问题:
①写出碳酸钠法的离子方程式________________________________________________ 。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________ 。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:

青铜器在潮湿环境中发生电化学腐蚀生成有害锈Cu2(OH)3Cl的原理示意图为:

写出正极的电极反应式
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:

①过程Ⅰ的正极反应物是
②过程Ⅰ负极的电极反应式是
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
您最近半年使用:0次

 ④金刚烷
④金刚烷