废旧磷酸铁锂电池回收工艺存在价值低、污染大等问题,某科研组创新性地提出还原酸浸-沉淀-固相再生法,具体工艺流程如下:___________ (填化学式,写一种)。
(2)“酸浸还原”过程中需控制反应温度为70℃,其加热方式为___________ (填“水浴”、“油浴”或“沙浴”)加热。抗坏血酸为有机弱酸,其转化如图a所示。加入抗坏血酸的目的是___________ ,每1mol抗坏血酸参与反应时转移___________ mole-。
(3)在通入氩气的气氛下,向滤液Ⅰ中加入氨水,当调节pH=6.5时,沉淀样品经___________ 实验来分析晶体结构,与Fe3(PO4)2·8H2O的标准卡片吻合。若pH过高,则晶体不纯,可能的原因是___________ 。
(4)“富锂滤液”经蒸发浓缩、冷却结晶、过滤、洗涤、干燥即得到LiH2PO4,在该实验操作过程中不会利用到的仪器有___________ (填字母)。
A.蒸发皿 B.容量瓶 C.玻璃棒 D.直形冷凝管 E.烧杯
(5)已知在该过程中,金属铁元素的浸出率为98.1%、沉淀率为98.2%,则铁元素的总回收率为___________ %(保留三位有效数字)。
(6)某科研团队以Li2SO4和LiOH溶液分别作为阳极室和阴极室的电解液(电极均为惰性电极),将废旧磷酸铁锂粉末悬浮在阳极室中进行悬浮电解,如图b所示:则阴极室的电极反应方程式为:___________ 。
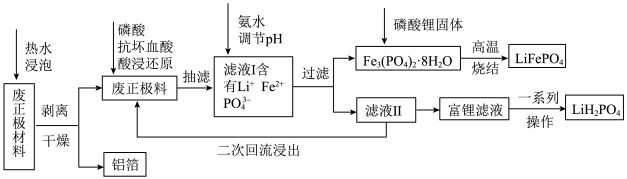
(2)“酸浸还原”过程中需控制反应温度为70℃,其加热方式为
(3)在通入氩气的气氛下,向滤液Ⅰ中加入氨水,当调节pH=6.5时,沉淀样品经
(4)“富锂滤液”经蒸发浓缩、冷却结晶、过滤、洗涤、干燥即得到LiH2PO4,在该实验操作过程中不会利用到的仪器有
A.蒸发皿 B.容量瓶 C.玻璃棒 D.直形冷凝管 E.烧杯
(5)已知在该过程中,金属铁元素的浸出率为98.1%、沉淀率为98.2%,则铁元素的总回收率为
(6)某科研团队以Li2SO4和LiOH溶液分别作为阳极室和阴极室的电解液(电极均为惰性电极),将废旧磷酸铁锂粉末悬浮在阳极室中进行悬浮电解,如图b所示:则阴极室的电极反应方程式为:

更新时间:2024-04-16 12:33:45
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,化学实验室产生的废液必须经处理后才能排放。某化学实验室产生的酸性废液中含有Fe3+、Cu2+、Ba2+三种金属阳离子和Cl-一种阴离子,实验室设计了下述方案对废液进行处理,以回收金属并测定含量,保护环境。
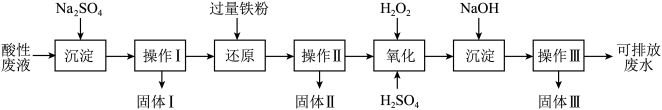
已知实验中处理的酸性废液的体积为1L,用pH计测定出其中H+物质的量浓度为0.10mol/L。
请回答下列问题:
(1)实验中操作I、Ⅱ、Ⅲ的方法相同,操作步骤依次为过滤、_________ 、干燥。
(2)“氧化”步骤所得溶液颜色为棕黄色,该反应的离子方程式为:__________ 。
(3)实验中称量固体I 的质量为4.66g,固体II 的质量为15.2g,用足量的稀硝酸溶解固体Ⅱ后产生了标准状况下的无色气体4.48L,则固体Ⅱ中金属铜的质量为________ g。
(4)实验中将固体Ⅲ进行充分灼烧,使用仪器除了酒精灯、三脚架、泥三角、玻璃棒外,还有_____ (填名称)。最后得到的红棕色固体质量为40.0g,则原溶液中氯离子的物质的量浓度为________ (写出计算过程)。

已知实验中处理的酸性废液的体积为1L,用pH计测定出其中H+物质的量浓度为0.10mol/L。
请回答下列问题:
(1)实验中操作I、Ⅱ、Ⅲ的方法相同,操作步骤依次为过滤、
(2)“氧化”步骤所得溶液颜色为棕黄色,该反应的离子方程式为:
(3)实验中称量固体I 的质量为4.66g,固体II 的质量为15.2g,用足量的稀硝酸溶解固体Ⅱ后产生了标准状况下的无色气体4.48L,则固体Ⅱ中金属铜的质量为
(4)实验中将固体Ⅲ进行充分灼烧,使用仪器除了酒精灯、三脚架、泥三角、玻璃棒外,还有
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】“天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙奥秘离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。元素铼( )的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含
)的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含 )中提取铼,其工艺流程如图所示:
)中提取铼,其工艺流程如图所示:
(1)矿样粒度与浸出率关系如下图所示,则“浸出”时应将富铼渣粉碎至___________目(填字母)。
(2)已知“浸出”时反应中 转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:
转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:__________________ 。
(3)实验室中,操作Ⅲ所用装置应选用___________(填字母)。
(4)“一系列操作”包括①________ (填操作名称,下同)、冷却结晶、过滤、洗涤和②____________ ;从下列仪器中选出①②中需使用的仪器,依次为______ (填字母)。___________ 法提纯;“热还原”反应中氧化剂与还原剂的物质的量之比为___________ 。
(6) 晶胞结构如下图所示,其中氧原子配位数为
晶胞结构如下图所示,其中氧原子配位数为___________ ,铼原子填在了氧原子围成的___________ (填“四面体”“立方体”或“八面体”)空隙中。
 )的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含
)的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含 )中提取铼,其工艺流程如图所示:
)中提取铼,其工艺流程如图所示: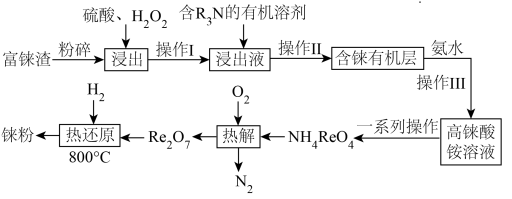
(1)矿样粒度与浸出率关系如下图所示,则“浸出”时应将富铼渣粉碎至___________目(填字母)。
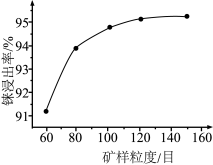
| A.60 | B.80 | C.100 | D.120 |
(2)已知“浸出”时反应中
 转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:
转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:(3)实验室中,操作Ⅲ所用装置应选用___________(填字母)。
A.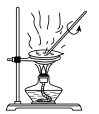 | B.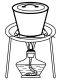 | C.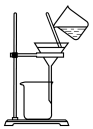 | D.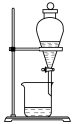 |
(4)“一系列操作”包括①
A.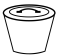 B.
B.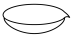 C.
C. D.
D.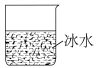
(6)
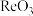 晶胞结构如下图所示,其中氧原子配位数为
晶胞结构如下图所示,其中氧原子配位数为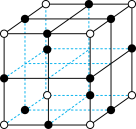
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】二氧化钒(VO2)是一种新型热敏材料,+4 价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体。过程如下:

回答下列问题:
(1)步骤i中生成VOC12的同时还产生一种无色无污染的气体,所发生反应的化学方程式为___________ 。只用浓盐酸与V2O5反应也能制备VOC12溶液,从安全与环保角度分析,该反应不被推广的主要原因是___________ 。
(2)步骤ii可在下图装置中进行。

①向锥形瓶中滴加VOCl2溶液前应通入一段时间的CO2,目的是___________ 。
②装置B中的试剂是___________ 。
③反应结束后,将锥形瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和NH4HCO3溶液洗涤除去的阴离子主要是___________ ,用无水乙醇洗涤的目的是___________ 。
(3)测定氧钒(IV )碱式碳酸铵晶体粗产品中钒的含量。
称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L KMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量。再用尿素除去过量的NaNO2,滴入几滴铁氰化钾{K3[ Fe(CN)6]}溶液,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为: +Fe2++2H+=VO2++Fe3++H2O
+Fe2++2H+=VO2++Fe3++H2O
①KMnO4溶液的作用是___________
②滴定终点时的现象为___________
③粗产品中钒的质量分数的表达式为___________

回答下列问题:
(1)步骤i中生成VOC12的同时还产生一种无色无污染的气体,所发生反应的化学方程式为
(2)步骤ii可在下图装置中进行。

①向锥形瓶中滴加VOCl2溶液前应通入一段时间的CO2,目的是
②装置B中的试剂是
③反应结束后,将锥形瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和NH4HCO3溶液洗涤除去的阴离子主要是
(3)测定氧钒(IV )碱式碳酸铵晶体粗产品中钒的含量。
称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L KMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量。再用尿素除去过量的NaNO2,滴入几滴铁氰化钾{K3[ Fe(CN)6]}溶液,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为:
 +Fe2++2H+=VO2++Fe3++H2O
+Fe2++2H+=VO2++Fe3++H2O①KMnO4溶液的作用是
②滴定终点时的现象为
③粗产品中钒的质量分数的表达式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________ 。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________ (填序号)。
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________ ,此时________ Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________ 。

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是
| A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】铝酸铋[Bi(AlO2)3]主要用作抗酸药及抗溃疡药,具有中和胃酸和收敛作用。以辉铋矿(主要成分为 Bi2S3,含有: 等杂质)为原料制备铝酸铋的一种工艺流程如图所示:
等杂质)为原料制备铝酸铋的一种工艺流程如图所示:

已知:“沉淀”步骤中,不能出现Fe3+,否则后续Bi(OH)3沉淀中会混有Fe(OH)3杂质。请回答下列问题:
(1)铋位于第六周期,且与氮同主族,则铋元素在元素周期表中属于___________ 区,铋的价层电子排布式为___________ 。
(2)“浸取”过程中,提高浸出率的措施有___________ 。(写一条即可)
(3) “还原”时, 加入铋的目的是___________ 。
(4)已知进入“碱溶”步骤的物质为经过充分洗涤的Cu(OH)2和 Bi(OH)3固体混合物,为检验是否洗涤干净,可选择的试剂为___________ 。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.BaCl2溶液
 等杂质)为原料制备铝酸铋的一种工艺流程如图所示:
等杂质)为原料制备铝酸铋的一种工艺流程如图所示:
已知:“沉淀”步骤中,不能出现Fe3+,否则后续Bi(OH)3沉淀中会混有Fe(OH)3杂质。请回答下列问题:
(1)铋位于第六周期,且与氮同主族,则铋元素在元素周期表中属于
(2)“浸取”过程中,提高浸出率的措施有
(3) “还原”时, 加入铋的目的是
(4)已知进入“碱溶”步骤的物质为经过充分洗涤的Cu(OH)2和 Bi(OH)3固体混合物,为检验是否洗涤干净,可选择的试剂为
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.BaCl2溶液
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】钪(Sc)元素在国防、航天、激光、核能、医疗等方面有广泛应用。赤泥含有 、
、 、
、 、
、 等,以赤泥为原料提取氧化钪
等,以赤泥为原料提取氧化钪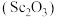 的流程如下:
的流程如下: ,
, 易水解;②常温下,“浸出液”中
易水解;②常温下,“浸出液”中 ,
,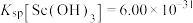 。
。
回答下列问题:
(1)操作A是___________ 。
(2)“溶解”中 作用有将
作用有将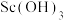 转化成
转化成 、作溶剂和
、作溶剂和___________ 。
(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为___________ 、___________ 。“萃取”过程中应控制pH小于___________ 。
[分离系数指分离后混合体系中某物质的物质的量分数,如 %]
%]
(4)已知 ,
,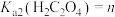 ,
,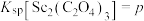 。“沉钪”时,发生反应:
。“沉钪”时,发生反应: ,此反应的平衡常数
,此反应的平衡常数
___________ (用含m、n、p的代数式表示)。
(5)草酸钪晶体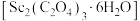 隔绝空气加热,
隔绝空气加热,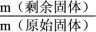 随温度的变化情况如图所示。
随温度的变化情况如图所示。___________ (填化学式),550~850℃,生成气体的物质的量之比为___________ (已知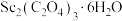 的摩尔质量为
的摩尔质量为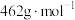 )。
)。
 、
、 、
、 、
、 等,以赤泥为原料提取氧化钪
等,以赤泥为原料提取氧化钪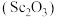 的流程如下:
的流程如下: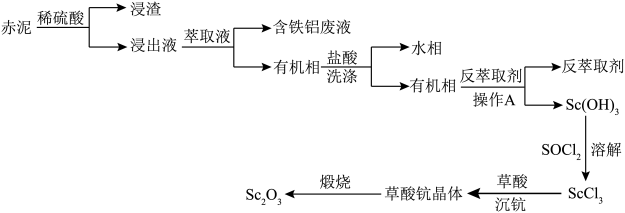
 ,
, 易水解;②常温下,“浸出液”中
易水解;②常温下,“浸出液”中 ,
,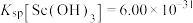 。
。回答下列问题:
(1)操作A是
(2)“溶解”中
 作用有将
作用有将 转化成
转化成 、作溶剂和
、作溶剂和(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为
[分离系数指分离后混合体系中某物质的物质的量分数,如
 %]
%]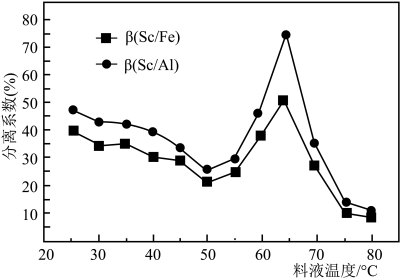
| w(P507) | 分相情况 | 钪萃取率(%) | 铁萃取率(%) |
| 1% | 分相容易 | 90.74 | 14.89 |
| 2% | 分相容易 | 91.74 | 19.88 |
| 3% | 分相容易 | 92.14 | 13.30 |
| 5% | 有第三相 | 90.59 | 28.47 |
| 8% | 轻微乳化 | 90.59 | 34.85 |
 ,
,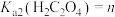 ,
,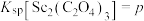 。“沉钪”时,发生反应:
。“沉钪”时,发生反应: ,此反应的平衡常数
,此反应的平衡常数
(5)草酸钪晶体
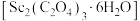 隔绝空气加热,
隔绝空气加热,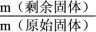 随温度的变化情况如图所示。
随温度的变化情况如图所示。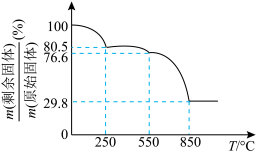
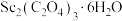 的摩尔质量为
的摩尔质量为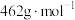 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】甲烷是一种重要的化工原料,工业上可用甲烷大规模生产氢气。
方法一:甲烷高温重整反应制氢,主要反应如下:
反应I.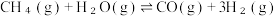 △H1
△H1
反应II.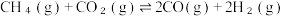 △H2
△H2
各反应平衡常数与温度的关系如图所示。_______ 0(填“>”或“<”),已知1000K时,达平衡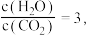 则此时
则此时 =
=_______ 。
(2)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。当在某电极上生成的两种有机物物质的量之比为1∶1时,该电极上的电极反应式为_______ 。此时两个电极上理论消耗CH4和CO2的物质的量之比为_______ 。 在某温度下,体系压强恒定为p₀时,2molCH4和2molCO2发生上述反应,平衡时甲烷的转化率为50%,H₂O的分压为0.1p₀,则反应II的压强平衡常数Kp=
在某温度下,体系压强恒定为p₀时,2molCH4和2molCO2发生上述反应,平衡时甲烷的转化率为50%,H₂O的分压为0.1p₀,则反应II的压强平衡常数Kp=_______ (用含p₀的计算式表示,已知分压=总压×物质的量分数)。
方法二:甲烷裂解制氢的反应为(CH4(g)=C(s)+2H2(g) ΔH=+75kJ/mol,金属镍是该反应的一种高效催化剂,纳米SiO2具有较大比表面积和独特孔道结构,可以提高镍的分散性。
(4)与方法一相比,方法二制氢的优点是_______ (写出一条即可)。
(5)现以纳米SiO2负载镍为催化剂,以10mL/min的流速将甲烷通入常压固定床反应器中反应,600℃时,4种不同镍负载量催化剂对甲烷转化率和氢气产率的影响如图所示。由图判断,活性最强的催化剂是_______ (填标号),可能的原因是_______ (填标号)。
B.镍负载量较高时,载体孔内的镍迅速被积炭所覆盖,催化剂活性下降
C.镍负载量较高时,金属镍不易发生颗粒团聚,催化剂活性增强
方法一:甲烷高温重整反应制氢,主要反应如下:
反应I.
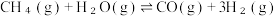 △H1
△H1反应II.
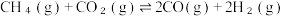 △H2
△H2各反应平衡常数与温度的关系如图所示。
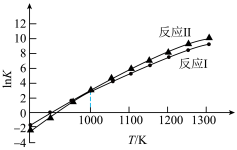
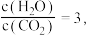 则此时
则此时 =
=(2)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。当在某电极上生成的两种有机物物质的量之比为1∶1时,该电极上的电极反应式为
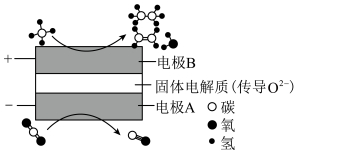
 在某温度下,体系压强恒定为p₀时,2molCH4和2molCO2发生上述反应,平衡时甲烷的转化率为50%,H₂O的分压为0.1p₀,则反应II的压强平衡常数Kp=
在某温度下,体系压强恒定为p₀时,2molCH4和2molCO2发生上述反应,平衡时甲烷的转化率为50%,H₂O的分压为0.1p₀,则反应II的压强平衡常数Kp=方法二:甲烷裂解制氢的反应为(CH4(g)=C(s)+2H2(g) ΔH=+75kJ/mol,金属镍是该反应的一种高效催化剂,纳米SiO2具有较大比表面积和独特孔道结构,可以提高镍的分散性。
(4)与方法一相比,方法二制氢的优点是
(5)现以纳米SiO2负载镍为催化剂,以10mL/min的流速将甲烷通入常压固定床反应器中反应,600℃时,4种不同镍负载量催化剂对甲烷转化率和氢气产率的影响如图所示。由图判断,活性最强的催化剂是
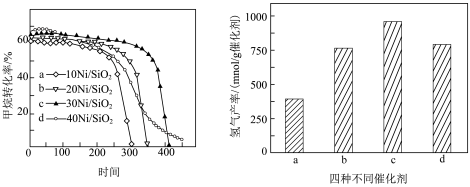
B.镍负载量较高时,载体孔内的镍迅速被积炭所覆盖,催化剂活性下降
C.镍负载量较高时,金属镍不易发生颗粒团聚,催化剂活性增强
您最近一年使用:0次
【推荐2】金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g) 2Fe(s)+3CO(g) +6H2(g)的△H
2Fe(s)+3CO(g) +6H2(g)的△H______ 0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________ 。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______ (选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
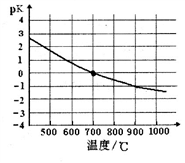
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________ 。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________ 。
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________ 。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________ 。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________ 。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g)
 2Fe(s)+3CO(g) +6H2(g)的△H
2Fe(s)+3CO(g) +6H2(g)的△H②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:
您最近一年使用:0次
【推荐3】尿素 是人体和动物的代谢产物之一,是人类历史上首个由无机物人工合成的有机物。氨基甲酸铵
是人体和动物的代谢产物之一,是人类历史上首个由无机物人工合成的有机物。氨基甲酸铵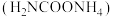 是以氨气和二氧化碳为原料合成尿素的中间产物。
是以氨气和二氧化碳为原料合成尿素的中间产物。
(1)合成尿素的总反应可表示为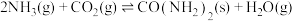 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:
Ⅰ.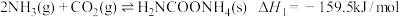
Ⅱ.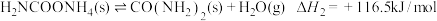
①若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是________ (填序号)。
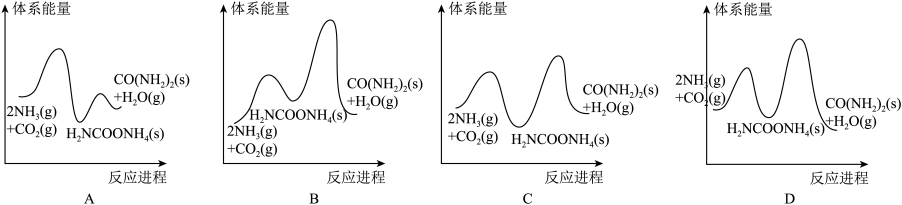
②能定性表示反应Ⅰ的 随温度变化的曲线是
随温度变化的曲线是________ (填“A”或“B”)。
(2)通过如下装置,可测定25℃时氨基甲酸铵分解反应的化学平衡常数 。测定的实验步骤如下:
。测定的实验步骤如下:
(Ⅰ)将恒温水槽温度调至25℃;
(Ⅱ)将一定量纯净的氨基甲酸铵置于容器中[只发生反应: ];
];
(Ⅲ)关闭 ,打开
,打开 和
和 ,开启真空泵抽气至测压仪数值接近0后关闭
,开启真空泵抽气至测压仪数值接近0后关闭 ;
;
(Ⅳ)关闭 ,缓慢开启
,缓慢开启 以维持Ⅱ型管两边液面始终相平。读取并记录该过程的压强数值(如图)。
以维持Ⅱ型管两边液面始终相平。读取并记录该过程的压强数值(如图)。
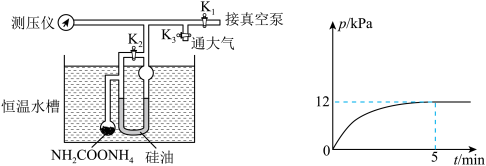
①计算0~5min之间, 分压的平均变化率为
分压的平均变化率为________  。该反应的平衡常数
。该反应的平衡常数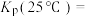
________ 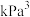 。
。
②步骤Ⅳ中,若测压仪最终读数稳定时,U型管左侧液面偏高,则 测量值
测量值________ (填“偏大”“偏小”或“无影响”)。
③上述体系平衡后,若只改变下列条件,重新建立平衡, 的分压一定增大的是
的分压一定增大的是________ (填序号)。
A.加入适量氨基甲酸铵 B.按物质的量之比1∶1加入适量 和
和
C.适当升高温度 D.适当缩小容器体积
④常温常压(25℃、100kPa)下,向空气中掺入 和
和 (二者物质的量之比为2∶1)可以防止氨基甲酸铵分解,混合气体中氨气与空气的体积比为
(二者物质的量之比为2∶1)可以防止氨基甲酸铵分解,混合气体中氨气与空气的体积比为________ (忽略空气中已有的 )。
)。
(3)尿素废水使水体富营养化,通过电解法处理后可排放,其装置示意图如下图所示。

①该装置阳极的电极反应式为________________ 。
②假设废水中尿素的含量为6.1g/L,处理过的废水中尿素的含量低于100mg/L,若两极共产生气体22.4L(标准状况下),理论上最多处理废水________ L。
 是人体和动物的代谢产物之一,是人类历史上首个由无机物人工合成的有机物。氨基甲酸铵
是人体和动物的代谢产物之一,是人类历史上首个由无机物人工合成的有机物。氨基甲酸铵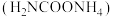 是以氨气和二氧化碳为原料合成尿素的中间产物。
是以氨气和二氧化碳为原料合成尿素的中间产物。(1)合成尿素的总反应可表示为
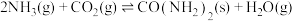 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:Ⅰ.
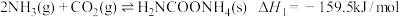
Ⅱ.
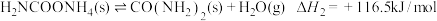
①若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是

②能定性表示反应Ⅰ的
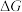 随温度变化的曲线是
随温度变化的曲线是
(2)通过如下装置,可测定25℃时氨基甲酸铵分解反应的化学平衡常数
 。测定的实验步骤如下:
。测定的实验步骤如下:(Ⅰ)将恒温水槽温度调至25℃;
(Ⅱ)将一定量纯净的氨基甲酸铵置于容器中[只发生反应:
 ];
];(Ⅲ)关闭
 ,打开
,打开 和
和 ,开启真空泵抽气至测压仪数值接近0后关闭
,开启真空泵抽气至测压仪数值接近0后关闭 ;
;(Ⅳ)关闭
 ,缓慢开启
,缓慢开启 以维持Ⅱ型管两边液面始终相平。读取并记录该过程的压强数值(如图)。
以维持Ⅱ型管两边液面始终相平。读取并记录该过程的压强数值(如图)。
①计算0~5min之间,
 分压的平均变化率为
分压的平均变化率为 。该反应的平衡常数
。该反应的平衡常数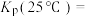
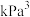 。
。②步骤Ⅳ中,若测压仪最终读数稳定时,U型管左侧液面偏高,则
 测量值
测量值③上述体系平衡后,若只改变下列条件,重新建立平衡,
 的分压一定增大的是
的分压一定增大的是A.加入适量氨基甲酸铵 B.按物质的量之比1∶1加入适量
 和
和
C.适当升高温度 D.适当缩小容器体积
④常温常压(25℃、100kPa)下,向空气中掺入
 和
和 (二者物质的量之比为2∶1)可以防止氨基甲酸铵分解,混合气体中氨气与空气的体积比为
(二者物质的量之比为2∶1)可以防止氨基甲酸铵分解,混合气体中氨气与空气的体积比为 )。
)。(3)尿素废水使水体富营养化,通过电解法处理后可排放,其装置示意图如下图所示。

①该装置阳极的电极反应式为
②假设废水中尿素的含量为6.1g/L,处理过的废水中尿素的含量低于100mg/L,若两极共产生气体22.4L(标准状况下),理论上最多处理废水
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】硫酸铅广泛应用于制造铅蓄电池、白色颜料以及精细化工产品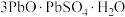 (三盐)等。工业生产中利用方铅矿(主要成分为PbS,含有
(三盐)等。工业生产中利用方铅矿(主要成分为PbS,含有 等杂质)制备
等杂质)制备 的工艺流程如图
的工艺流程如图
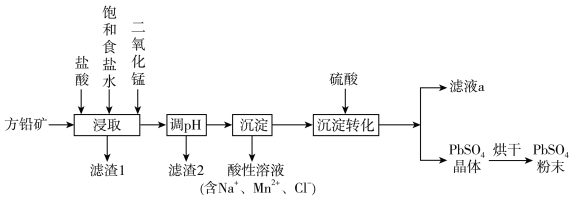
已知:1. 难溶于冷水,易溶于热水;
难溶于冷水,易溶于热水;
2.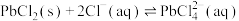
(1)“浸取”时需要加热,该过程中盐酸与 、PbS发生反应生成
、PbS发生反应生成 和S的化学方程式为
和S的化学方程式为______ ,结合原理分析饱和食盐水的作用______ 。
(2)“沉淀”中获得 采取的措施是
采取的措施是______ 。(答出一条即可)
(3)“滤液a”经过处理后可以返回到______ 工序循环使用。
(4)用硫酸铅与氢氧化钠溶液在50℃~60℃反应可以制备三盐,该反应的离子方程式为______ 。
(5)海绵铅具有优良的储氢功能,其储氢原理为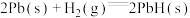 假设海绵铅的密度为
假设海绵铅的密度为 ,摩尔质量为
,摩尔质量为 ,其吸附的氢气是其体积的n倍(标准状况),则此条件下,1g海绵铅的储氢容量R为
,其吸附的氢气是其体积的n倍(标准状况),则此条件下,1g海绵铅的储氢容量R为______ mL,氢气的浓度r为______ mol(储氢容量R即1g铅吸附氢气的体积;氢气的浓度r为1mol Pb吸附氢气的物质的量)
 (三盐)等。工业生产中利用方铅矿(主要成分为PbS,含有
(三盐)等。工业生产中利用方铅矿(主要成分为PbS,含有 等杂质)制备
等杂质)制备 的工艺流程如图
的工艺流程如图
已知:1.
 难溶于冷水,易溶于热水;
难溶于冷水,易溶于热水;2.
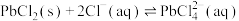
(1)“浸取”时需要加热,该过程中盐酸与
 、PbS发生反应生成
、PbS发生反应生成 和S的化学方程式为
和S的化学方程式为(2)“沉淀”中获得
 采取的措施是
采取的措施是(3)“滤液a”经过处理后可以返回到
(4)用硫酸铅与氢氧化钠溶液在50℃~60℃反应可以制备三盐,该反应的离子方程式为
(5)海绵铅具有优良的储氢功能,其储氢原理为
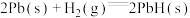 假设海绵铅的密度为
假设海绵铅的密度为 ,摩尔质量为
,摩尔质量为 ,其吸附的氢气是其体积的n倍(标准状况),则此条件下,1g海绵铅的储氢容量R为
,其吸附的氢气是其体积的n倍(标准状况),则此条件下,1g海绵铅的储氢容量R为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】在实验室以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料制备硼酸(H3BO3),其流程如图1所示,硫酸镁和硼酸的溶解度随温度的变化曲线如图2所示。

请回答下列问题:
(1)流程中“反应”的实验装置如下图所示:
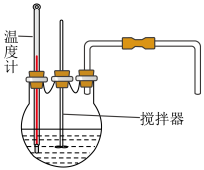
①反应时需控制在95℃进行,控制反应温度的适宜方法是____________________ 。
②反应产生的气体需要净化处理,请从下图中选择合适的装置__________ (填字母代号)。

(2)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是______________________ 。
(3)实验时若被强碱溅到,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:____________ 。
(4)滴定硼酸时不能直接滴定,因为硼酸是很弱的酸,Ka=5.7×10-10。滴定前,须先将硼酸与甘油作用生成甘油硼酸,Ka=8.4×10-6,然后用酚酞作指示剂,再用NaOH标准溶液滴定。已知硼酸的摩尔质量为61.8 g·mol-1,滴定前称取3.00 g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.200 0 mol·L-1 NaOH标准液的平均体积为20.00 mL。
①计算所得硼酸的纯度=__________ 。
②若用NaOH标准溶液直接滴定硼酸,则硼酸的纯度将__________ (填字母代号)。
A.偏大 B.偏小 C.无影响 D.无法确定

请回答下列问题:
(1)流程中“反应”的实验装置如下图所示:

①反应时需控制在95℃进行,控制反应温度的适宜方法是
②反应产生的气体需要净化处理,请从下图中选择合适的装置

(2)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是
(3)实验时若被强碱溅到,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:
(4)滴定硼酸时不能直接滴定,因为硼酸是很弱的酸,Ka=5.7×10-10。滴定前,须先将硼酸与甘油作用生成甘油硼酸,Ka=8.4×10-6,然后用酚酞作指示剂,再用NaOH标准溶液滴定。已知硼酸的摩尔质量为61.8 g·mol-1,滴定前称取3.00 g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.200 0 mol·L-1 NaOH标准液的平均体积为20.00 mL。
①计算所得硼酸的纯度=
②若用NaOH标准溶液直接滴定硼酸,则硼酸的纯度将
A.偏大 B.偏小 C.无影响 D.无法确定
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】五氧化二钒( )和三氧化钼(
)和三氧化钼( )是两种重要的金属氧化物,通常用作工业催化剂。通过废旧催化剂(主要成分为
)是两种重要的金属氧化物,通常用作工业催化剂。通过废旧催化剂(主要成分为 、
、 、
、 ,还有少量的
,还有少量的 、
、 、有机物)来制备这两种氧化物的工艺流程图如下:
、有机物)来制备这两种氧化物的工艺流程图如下:

回答下列问题:
(1)基态钒原子的价层电子排布式为___________ 。
(2)“焙烧”的目的是___________ 。
(3)滤渣的主要成分是___________ (填化学式)。
(4)向滤液①中加 的作用是
的作用是___________ 。
(5)常温下,当滤液①调pH=8时,铝元素是否沉淀完全___________ (填“是”或“否”);写出计算过程___________ 。[已知: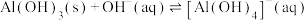
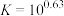 ;离子浓度小于
;离子浓度小于 认为沉淀完全]
认为沉淀完全]
(6) 在沉淀过程中,沉钒率受温度影响的关系如图所示。温度高于80℃沉钒率降低的主要原因是
在沉淀过程中,沉钒率受温度影响的关系如图所示。温度高于80℃沉钒率降低的主要原因是___________ ; 沉淀分解生成
沉淀分解生成 的化学方程式为
的化学方程式为___________ 。

 )和三氧化钼(
)和三氧化钼( )是两种重要的金属氧化物,通常用作工业催化剂。通过废旧催化剂(主要成分为
)是两种重要的金属氧化物,通常用作工业催化剂。通过废旧催化剂(主要成分为 、
、 、
、 ,还有少量的
,还有少量的 、
、 、有机物)来制备这两种氧化物的工艺流程图如下:
、有机物)来制备这两种氧化物的工艺流程图如下:
回答下列问题:
(1)基态钒原子的价层电子排布式为
(2)“焙烧”的目的是
(3)滤渣的主要成分是
(4)向滤液①中加
 的作用是
的作用是(5)常温下,当滤液①调pH=8时,铝元素是否沉淀完全
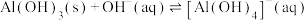
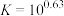 ;离子浓度小于
;离子浓度小于 认为沉淀完全]
认为沉淀完全](6)
 在沉淀过程中,沉钒率受温度影响的关系如图所示。温度高于80℃沉钒率降低的主要原因是
在沉淀过程中,沉钒率受温度影响的关系如图所示。温度高于80℃沉钒率降低的主要原因是 沉淀分解生成
沉淀分解生成 的化学方程式为
的化学方程式为
您最近一年使用:0次



