金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g) 2Fe(s)+3CO(g) +6H2(g)的△H
2Fe(s)+3CO(g) +6H2(g)的△H______ 0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________ 。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______ (选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
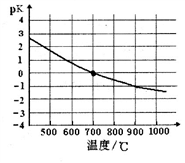
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________ 。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________ 。
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________ 。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________ 。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________ 。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g)
 2Fe(s)+3CO(g) +6H2(g)的△H
2Fe(s)+3CO(g) +6H2(g)的△H②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:
更新时间:2017-05-08 17:26:11
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】某些有机物在氧载体 的作用下部分氧化,反应混合气可制备合成气(CO、
的作用下部分氧化,反应混合气可制备合成气(CO、 )。反应体系中主要反应有:
)。反应体系中主要反应有:
反应ⅰ

反应ⅱ

反应ⅲ

反应ⅳ

请回答:
(1)H表示25℃,101kPa下的焓。则
_______  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(2)①反应ⅲ的平衡常数 [x(B)表示组分B平衡时的摩尔分数]。其他条件不变,会导致反应ⅲ
[x(B)表示组分B平衡时的摩尔分数]。其他条件不变,会导致反应ⅲ 减小的条件是
减小的条件是_______ 。
A.升温 B.降温 C.加压 D.减压 E.恒容容器中再通入一定量 (g)
(g)
②T℃下,测定上述所有反应达平衡时的体系中,反应iv的平衡常数 ,
, 、
、 、
、 ,忽略其他反应。则反应ⅲ的平衡常数
,忽略其他反应。则反应ⅲ的平衡常数
_______ (用含a、b的最简式子表示)。
(3)恒压,多组分混合气体的平衡体系中,气体组分的摩尔分数与温度的关系如图所示,用虚线划分为Ⅰ、Ⅱ、Ⅲ三个平衡区域,可推断出合成气的最佳形成条件。

①下列说法正确的是_______ 。
A.平衡区域Ⅰ显示, 被还原的反应为放热反应
被还原的反应为放热反应
B.平衡区域Ⅰ, 的摩尔分数基本不变,可能的原因是反应ⅲ的活化能大,反应不发生
的摩尔分数基本不变,可能的原因是反应ⅲ的活化能大,反应不发生
C.平衡区域Ⅱ, 的摩尔分数先增大的可能原因是反应ⅳ受温度的影响程度大于反应ⅰ、ⅱ
的摩尔分数先增大的可能原因是反应ⅳ受温度的影响程度大于反应ⅰ、ⅱ
D.平衡区域Ⅰ与平衡区域Ⅱ, 参与了不同的反应
参与了不同的反应
②平衡区域Ⅲ,基于上述的主要反应, 趋近于1的可能原因是:
趋近于1的可能原因是:_______ 。
(4)通过测定固体中 ,可判断氧载体
,可判断氧载体 参与有机物氧化的主要反应及原理。证据显示,氧载体
参与有机物氧化的主要反应及原理。证据显示,氧载体 参与反应后的铁氧固体混合物中只存在FeO一种氧化物,相关数据如下表。
参与反应后的铁氧固体混合物中只存在FeO一种氧化物,相关数据如下表。
依据表格中的数据,在图中画出200~1000℃之间的FeO的摩尔分数(%)变化趋势,并标注起点值_______ :

 的作用下部分氧化,反应混合气可制备合成气(CO、
的作用下部分氧化,反应混合气可制备合成气(CO、 )。反应体系中主要反应有:
)。反应体系中主要反应有:反应ⅰ


反应ⅱ


反应ⅲ


反应ⅳ


请回答:
(1)H表示25℃,101kPa下的焓。则

 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。(2)①反应ⅲ的平衡常数
 [x(B)表示组分B平衡时的摩尔分数]。其他条件不变,会导致反应ⅲ
[x(B)表示组分B平衡时的摩尔分数]。其他条件不变,会导致反应ⅲ 减小的条件是
减小的条件是A.升温 B.降温 C.加压 D.减压 E.恒容容器中再通入一定量
 (g)
(g)②T℃下,测定上述所有反应达平衡时的体系中,反应iv的平衡常数
 ,
, 、
、 、
、 ,忽略其他反应。则反应ⅲ的平衡常数
,忽略其他反应。则反应ⅲ的平衡常数
(3)恒压,多组分混合气体的平衡体系中,气体组分的摩尔分数与温度的关系如图所示,用虚线划分为Ⅰ、Ⅱ、Ⅲ三个平衡区域,可推断出合成气的最佳形成条件。

①下列说法正确的是
A.平衡区域Ⅰ显示,
 被还原的反应为放热反应
被还原的反应为放热反应B.平衡区域Ⅰ,
 的摩尔分数基本不变,可能的原因是反应ⅲ的活化能大,反应不发生
的摩尔分数基本不变,可能的原因是反应ⅲ的活化能大,反应不发生C.平衡区域Ⅱ,
 的摩尔分数先增大的可能原因是反应ⅳ受温度的影响程度大于反应ⅰ、ⅱ
的摩尔分数先增大的可能原因是反应ⅳ受温度的影响程度大于反应ⅰ、ⅱD.平衡区域Ⅰ与平衡区域Ⅱ,
 参与了不同的反应
参与了不同的反应②平衡区域Ⅲ,基于上述的主要反应,
 趋近于1的可能原因是:
趋近于1的可能原因是:(4)通过测定固体中
 ,可判断氧载体
,可判断氧载体 参与有机物氧化的主要反应及原理。证据显示,氧载体
参与有机物氧化的主要反应及原理。证据显示,氧载体 参与反应后的铁氧固体混合物中只存在FeO一种氧化物,相关数据如下表。
参与反应后的铁氧固体混合物中只存在FeO一种氧化物,相关数据如下表。| 温度/℃ | 200 | 400 | 600 | 1000 |
 | 6.25 | 3.26 | 2.58 | ∞ |

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】二甲醚是含氢量高,廉价易得,无毒的优良制氢原料,二甲醚水蒸气重整制氢体系中会发生如下反应:
主反应:
反应: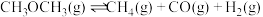
(1)①主反应在_______ (填“高温”或“低温”)下能自发进行。
②已知主反应的机理分为两步
步骤ⅰ:
步骤ⅱ:……
则步骤ⅱ的热化学方程式为_______ 。
对比 负载
负载 的催化剂性能,测得
的催化剂性能,测得 收率
收率 的变化曲线如图所示。
的变化曲线如图所示。

已知:
二甲醚转化率
氢选择性
氢收率=二甲醚转化率×氢选择性
(2)三种催化剂中,催化活性最好的催化剂是_______ 。加入 后,催化剂的稳定性
后,催化剂的稳定性_______ (填“上升”或下降”)
(3)向恒压为p(非恒容)的体系中充入物质的量之比为 的
的 发生二甲醚水蒸气重整制氢反应,测得在催化剂
发生二甲醚水蒸气重整制氢反应,测得在催化剂 催化下反应达到平衡时,二甲醚转化率为
催化下反应达到平衡时,二甲醚转化率为 ,且产物中
,且产物中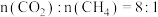 。
。
①能判断该反应达到平衡状态的标志为_______ (填字母)。
A.混合气体中各物质分压保持不变
B.混合气体的密度保持不变
C.混合气体平均摩尔质量保持不变
D.消耗 时,有
时,有 生成
生成
②反应达到平衡时, 的转化率为
的转化率为_______ ,二甲醚水蒸气重整制氢主反应的
_______ (列出含p的计算式即可)。
主反应:

反应:
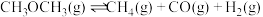
(1)①主反应在
②已知主反应的机理分为两步
步骤ⅰ:

步骤ⅱ:……
则步骤ⅱ的热化学方程式为
对比
 负载
负载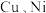 的催化剂性能,测得
的催化剂性能,测得 收率
收率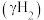 的变化曲线如图所示。
的变化曲线如图所示。
已知:
二甲醚转化率

氢选择性

氢收率=二甲醚转化率×氢选择性
(2)三种催化剂中,催化活性最好的催化剂是
 后,催化剂的稳定性
后,催化剂的稳定性(3)向恒压为p(非恒容)的体系中充入物质的量之比为
 的
的 发生二甲醚水蒸气重整制氢反应,测得在催化剂
发生二甲醚水蒸气重整制氢反应,测得在催化剂 催化下反应达到平衡时,二甲醚转化率为
催化下反应达到平衡时,二甲醚转化率为 ,且产物中
,且产物中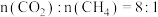 。
。①能判断该反应达到平衡状态的标志为
A.混合气体中各物质分压保持不变
B.混合气体的密度保持不变
C.混合气体平均摩尔质量保持不变
D.消耗
 时,有
时,有 生成
生成②反应达到平衡时,
 的转化率为
的转化率为
您最近一年使用:0次
【推荐3】研究 的资源综合利用,对实现“碳达峰”和“碳中和”有重要意义。
的资源综合利用,对实现“碳达峰”和“碳中和”有重要意义。
(1)在 加氢合成
加氢合成 体系中,同时发生以下反应:
体系中,同时发生以下反应:
反应I.
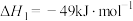
反应Ⅱ.

反应Ⅲ.

①反应Ⅲ的
_______ 。
② 与
与 在
在 催化剂表面生成
催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。 为0.61eV。写出该历程的化学方程式:
为0.61eV。写出该历程的化学方程式:_____ 。
(2)向体积为1L的密闭容器中,投入 和
和 ,平衡时CO或
,平衡时CO或 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图: ,
,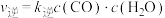 ,
, 、
、 为速率常数,c为物质的量浓度。
为速率常数,c为物质的量浓度。
①在p点时,若反应Ⅱ的 ,此时该反应的
,此时该反应的
_______ 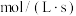 。
。
②p点时体系总压强为 ,反应Ⅱ的
,反应Ⅱ的
_______ (保留2位有效数字)。
③由实验测得,随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态,原因是_______ 。
(3)可通过电解法用 制备
制备 ,电解装置如图所示。当玻碳电极收集到标况下44.8L气体时,阴极区的质量变化为
,电解装置如图所示。当玻碳电极收集到标况下44.8L气体时,阴极区的质量变化为_______ g(保留小数点后1位)。 的笼形包合物四方晶胞部分结构如图所示(H原子未画出)。晶胞参数为
的笼形包合物四方晶胞部分结构如图所示(H原子未画出)。晶胞参数为 ,
, 。
。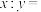
_______ ;当 时,1mol晶胞可以俘获
时,1mol晶胞可以俘获_______ mol苯分子。
 的资源综合利用,对实现“碳达峰”和“碳中和”有重要意义。
的资源综合利用,对实现“碳达峰”和“碳中和”有重要意义。(1)在
 加氢合成
加氢合成 体系中,同时发生以下反应:
体系中,同时发生以下反应:反应I.

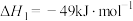
反应Ⅱ.


反应Ⅲ.


①反应Ⅲ的

②
 与
与 在
在 催化剂表面生成
催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
 为0.61eV。写出该历程的化学方程式:
为0.61eV。写出该历程的化学方程式:(2)向体积为1L的密闭容器中,投入
 和
和 ,平衡时CO或
,平衡时CO或 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图:
 ,
,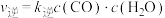 ,
, 、
、 为速率常数,c为物质的量浓度。
为速率常数,c为物质的量浓度。①在p点时,若反应Ⅱ的
 ,此时该反应的
,此时该反应的
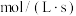 。
。②p点时体系总压强为
 ,反应Ⅱ的
,反应Ⅱ的
③由实验测得,随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态,原因是
(3)可通过电解法用
 制备
制备 ,电解装置如图所示。当玻碳电极收集到标况下44.8L气体时,阴极区的质量变化为
,电解装置如图所示。当玻碳电极收集到标况下44.8L气体时,阴极区的质量变化为
 的笼形包合物四方晶胞部分结构如图所示(H原子未画出)。晶胞参数为
的笼形包合物四方晶胞部分结构如图所示(H原子未画出)。晶胞参数为 ,
, 。
。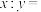
 时,1mol晶胞可以俘获
时,1mol晶胞可以俘获
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】利用磷石膏废渣(主要成分为CaSO4)生产硫酸可实现硫资源的循环利用。回答下列问题:
(1)硫黄分解磷石膏工艺涉及的主要反应为:
(I)S2(g)+CaSO4(s) CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1
CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1
(II)CaS(s)+3CaSO4(s) 4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1
4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1
①反应S2(g)+4CaSO4(s) 4CaO(s)+6SO2(g)的∆H=
4CaO(s)+6SO2(g)的∆H=_______ kJ·mol-1;
②在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是_______ (填字母)。
A. v正(SO2)=2 v正(S2) B.气体中含硫原子总数不随时间变化
C.容器内固体总质量不再随时间变化D.容器内气体总压强不再随时间变化
③在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中(CaS、CaSO4、CaO均足量)再充入少量SO2,达到新平衡后,与原平衡相比c(SO2)_______ (填“增大”“减小”或“不变”),原因为_______ 。
(2)有效除去废气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5气体在一体积固定的容器中发生如下反应:2N2O5(g)=4NO2(g)+O2(g)(慢反应) ∆H<0,2NO2(g) N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
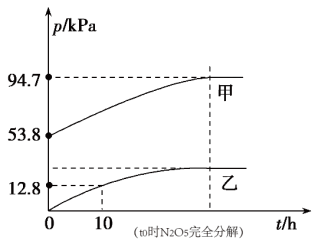
①图中表示O2压强变化的曲线是_______ (填“甲”或“乙")
②已知N2O5分解的反应速率v=0.12p(N2O5)(kPa·h-1),t=10h时,p(N2O5)=_______ kPa,v=_______ kPa•h-1。
③该温度下反应2NO2(g) N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=_______ kPa-1(结果保留两位小数)。
(1)硫黄分解磷石膏工艺涉及的主要反应为:
(I)S2(g)+CaSO4(s)
 CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1
CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1(II)CaS(s)+3CaSO4(s)
 4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1
4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1①反应S2(g)+4CaSO4(s)
 4CaO(s)+6SO2(g)的∆H=
4CaO(s)+6SO2(g)的∆H=②在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是
A. v正(SO2)=2 v正(S2) B.气体中含硫原子总数不随时间变化
C.容器内固体总质量不再随时间变化D.容器内气体总压强不再随时间变化
③在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中(CaS、CaSO4、CaO均足量)再充入少量SO2,达到新平衡后,与原平衡相比c(SO2)
(2)有效除去废气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5气体在一体积固定的容器中发生如下反应:2N2O5(g)=4NO2(g)+O2(g)(慢反应) ∆H<0,2NO2(g)
 N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
①图中表示O2压强变化的曲线是
②已知N2O5分解的反应速率v=0.12p(N2O5)(kPa·h-1),t=10h时,p(N2O5)=
③该温度下反应2NO2(g)
 N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=
您最近一年使用:0次
【推荐2】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为________________ 。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
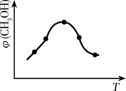
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后 ,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应热△H3_____ 0(填“>”、“<”或“=”),该反应的平衡常数表达式为_______________ 。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:
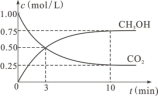
0~10 min内,氢气的平均反应速率为___________________ mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数____________ (填“增大”、“减小”或“不变”,下同),反应的平衡常数_____________________ 。
(3)脱硫。
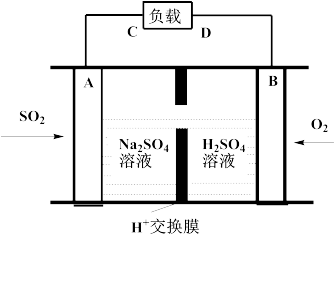
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:_________ 。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为_________ 。
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:

0~10 min内,氢气的平均反应速率为
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:

②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】 是硝酸的酸酐,溶于水生成
是硝酸的酸酐,溶于水生成 ,
, 或
或 合金可用于还原脱除水体中的硝态氮
合金可用于还原脱除水体中的硝态氮 。在45℃、
。在45℃、 溶液起始浓度
溶液起始浓度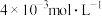 、维持溶液呈中性并通入
、维持溶液呈中性并通入 作保护气等条件下进行脱氮实验,结果如下图所示。
作保护气等条件下进行脱氮实验,结果如下图所示。

完成下列填空:
(1) 在
在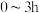 时,
时, 几乎没有被脱除的原因是
几乎没有被脱除的原因是_______ ,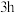 后
后 被还原成
被还原成 ,配平反应的离子方程式:
,配平反应的离子方程式:______ 。
_______ +_______
+_______ +_______
+_______ +_______
+_______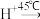 _______
_______ +_______
+_______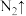
(2) 合金1~2h比
合金1~2h比 3~4的脱除速率快得多的原因可能是
3~4的脱除速率快得多的原因可能是_______ 。
(3) 不稳定,25℃时的分解方式如下:①
不稳定,25℃时的分解方式如下:①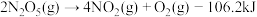 ;②
;②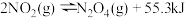 。
。
①25℃时,在一个容积不变的容器中加入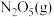 ,气体总浓度c与时间t的变化关系如下表所示:
,气体总浓度c与时间t的变化关系如下表所示:
在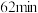 时,测得
时,测得 浓度为
浓度为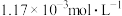 ,此时
,此时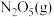 的浓度是
的浓度是_______  。反应达到平衡时,
。反应达到平衡时, 的浓度是
的浓度是_______  。
。
②若升温至35℃,平衡时气体总浓度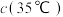
_______ 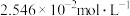 (选填“>”“<”或“=”)。
(选填“>”“<”或“=”)。
③已知: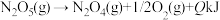 ,
,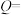
_______ 。
 是硝酸的酸酐,溶于水生成
是硝酸的酸酐,溶于水生成 ,
, 或
或 合金可用于还原脱除水体中的硝态氮
合金可用于还原脱除水体中的硝态氮 。在45℃、
。在45℃、 溶液起始浓度
溶液起始浓度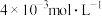 、维持溶液呈中性并通入
、维持溶液呈中性并通入 作保护气等条件下进行脱氮实验,结果如下图所示。
作保护气等条件下进行脱氮实验,结果如下图所示。
完成下列填空:
(1)
 在
在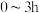 时,
时, 几乎没有被脱除的原因是
几乎没有被脱除的原因是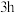 后
后 被还原成
被还原成 ,配平反应的离子方程式:
,配平反应的离子方程式:_______
 +_______
+_______ +_______
+_______ +_______
+_______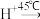 _______
_______ +_______
+_______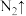
(2)
 合金1~2h比
合金1~2h比 3~4的脱除速率快得多的原因可能是
3~4的脱除速率快得多的原因可能是(3)
 不稳定,25℃时的分解方式如下:①
不稳定,25℃时的分解方式如下:①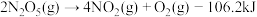 ;②
;②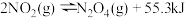 。
。①25℃时,在一个容积不变的容器中加入
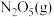 ,气体总浓度c与时间t的变化关系如下表所示:
,气体总浓度c与时间t的变化关系如下表所示: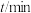 | 0 | 260 |  |
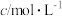 |  |  |  |
在
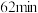 时,测得
时,测得 浓度为
浓度为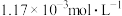 ,此时
,此时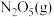 的浓度是
的浓度是 。反应达到平衡时,
。反应达到平衡时, 的浓度是
的浓度是 。
。②若升温至35℃,平衡时气体总浓度
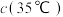
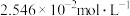 (选填“>”“<”或“=”)。
(选填“>”“<”或“=”)。③已知:
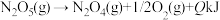 ,
,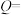
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】五氧化二钒用作冶金添加剂,占五氧化二钒总消耗量的 80%以上,其次是用作有机化工的催化剂。为了增加V2O5的利用率,我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3 等) 中回收 V2O5的一种生产工艺流程示意图:

部分含钒物质在水中的溶解性如表所示,回答下列问题:
(1)①中废渣的主要成分是 __________________________ ;①中V2O5发生反应的离子方程式为 ___________________________ 。
(2)②、③中的变化过程可简化为(下式中的R 表示 VO2+或 Fe3+,HA 表示有机萃取剂的主要成分)R2(SO4)n(水层)+2nHA(有机层)⇌ 2RA(有机层)+ nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是______________________ ;实验室进行萃取操作使用的玻璃仪器为 ______________________ 。
(3)实验室用的原料中V2O5占 6%(原料中的所有钒已换算成 V2O5)。取 100 g 该废钒催化剂按工业生产的步骤进行实验,当加入 100 mL 0.1 mol•L -1 的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是__________________ [M(V2O5)=182 g•mol -1]。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液 pH 之间的关系如表所示:
试判断在实际生产时,⑤中加入 NH4Cl 调节溶液的最佳 pH为____________ ;若钒沉淀率为 93.1%时不产生 Fe(OH)3沉淀,则此时溶液中 c(Fe3+)≤____________ (已知:25℃时Ksp[Fe(OH)3]=2.6×10 -39)。

部分含钒物质在水中的溶解性如表所示,回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)②、③中的变化过程可简化为(下式中的R 表示 VO2+或 Fe3+,HA 表示有机萃取剂的主要成分)R2(SO4)n(水层)+2nHA(有机层)⇌ 2RA(有机层)+ nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是
(3)实验室用的原料中V2O5占 6%(原料中的所有钒已换算成 V2O5)。取 100 g 该废钒催化剂按工业生产的步骤进行实验,当加入 100 mL 0.1 mol•L -1 的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液 pH 之间的关系如表所示:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】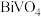 (乳酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1%
(乳酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1% 、19.5%
、19.5% 和3.4%
和3.4% )为原料制备钒酸铋,并回收
)为原料制备钒酸铋,并回收 制备食品抗氧化剂
制备食品抗氧化剂 的流程如下,回答下列问题:
的流程如下,回答下列问题: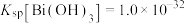 ,
,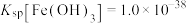 ;当金属离子浓度
;当金属离子浓度 时,认为该离子已沉淀完全。
时,认为该离子已沉淀完全。
(1)“焙烧”中采用高压空气的目的是_______ , 转化成
转化成 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)浸渣的主要成分是_______ (填化学式)。
(3)已知:“酸浸”得到的浸液中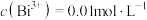 ,则“除铁”调节pH的范围为
,则“除铁”调节pH的范围为_______ 。
(4)“酸溶”需调节pH,避免生成BiOCl(难溶)。产生BiOCl反应的离子方程式为_______ 。
(5)向含少量水的 中通入
中通入 ,得到
,得到 产品。
产品。 易变质生成
易变质生成 ,设计简单实验证明产品是否变质:
,设计简单实验证明产品是否变质:_______ 。
已知: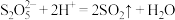 。
。
(6)某工厂用10吨该辉铋矿,最终得到9.234吨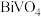 ,则该过程中Bi的损耗率为
,则该过程中Bi的损耗率为_______ %。
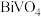 (乳酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1%
(乳酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1% 、19.5%
、19.5% 和3.4%
和3.4% )为原料制备钒酸铋,并回收
)为原料制备钒酸铋,并回收 制备食品抗氧化剂
制备食品抗氧化剂 的流程如下,回答下列问题:
的流程如下,回答下列问题: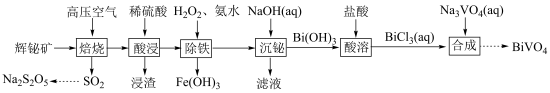
 ,
,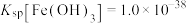 ;当金属离子浓度
;当金属离子浓度 时,认为该离子已沉淀完全。
时,认为该离子已沉淀完全。(1)“焙烧”中采用高压空气的目的是
 转化成
转化成 发生反应的化学方程式为
发生反应的化学方程式为(2)浸渣的主要成分是
(3)已知:“酸浸”得到的浸液中
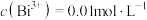 ,则“除铁”调节pH的范围为
,则“除铁”调节pH的范围为(4)“酸溶”需调节pH,避免生成BiOCl(难溶)。产生BiOCl反应的离子方程式为
(5)向含少量水的
 中通入
中通入 ,得到
,得到 产品。
产品。 易变质生成
易变质生成 ,设计简单实验证明产品是否变质:
,设计简单实验证明产品是否变质:已知:
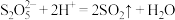 。
。(6)某工厂用10吨该辉铋矿,最终得到9.234吨
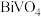 ,则该过程中Bi的损耗率为
,则该过程中Bi的损耗率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】废旧铅蓄电池的铅膏中含有60%的PbSO4,30%的PbO2、PbO和Pb,还有少量Fe、Al的盐或氧化物等。某废铅膏回收工业流程如图:

一些难溶电解质的溶度积常数如表:
回答下列问题:
(1)废铅膏中PbSO4比重占绝对主导,其原因是______ (用一个化学方程式表示)。
(2)在“脱硫”中试剂X有以下选择,最适合的是______ 。
a.(NH4)2CO3 b.(NH4)2C2O4 c.NaF d.Na2C2O4
用平衡移动原理解释原因:______ 。
(3)在“酸浸”中,加入醋酸(HAc)和H2O2,H2O2可以促进金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为______ 。H2O2能否用Cl2代替,判断并解释原因:______ 。
(4)“酸浸”中用pH试纸测溶液的pH,方法为______ 。已知“酸浸”中c(Pb2+)为0.1mol/L,则需调节溶液pH范围为______ (取小数点后1位)。
(5)制得的PbO在碱性电解液中可重新熔铸成电解铅,其电极反应为______ 。此法制得的铅纯度高,但会有一定损失,阳极会产生副产物PbOx,为测其组成,取此副产物114.7g,溶于足量浓盐酸中,产生标准状况下4.48LCl2,则x值为______ 。

一些难溶电解质的溶度积常数如表:
| 难溶电解质 | PbSO4 | PbCO3 | PbF2 | PbC2O4 | Pb(OH)2 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| Ksp | 2.5×10-8 | 7.4×10-14 | 3.3×10-8 | 8.5×10-10 | 1×10-15 | 1×10-39 | 1×10-15 | 1×10-33 |
(1)废铅膏中PbSO4比重占绝对主导,其原因是
(2)在“脱硫”中试剂X有以下选择,最适合的是
a.(NH4)2CO3 b.(NH4)2C2O4 c.NaF d.Na2C2O4
用平衡移动原理解释原因:
(3)在“酸浸”中,加入醋酸(HAc)和H2O2,H2O2可以促进金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为
(4)“酸浸”中用pH试纸测溶液的pH,方法为
(5)制得的PbO在碱性电解液中可重新熔铸成电解铅,其电极反应为
您最近一年使用:0次
【推荐1】现有X、Y、Z、W、R五种原子序数依次增大的短周期元素。已知X为最轻的元素;Y的一种同位素常用于文物年代的测定;Z原子的最外层电子数是内层电子总数的3倍;W的族序数与其周期序数相同;R的一种氧化物具有漂白性,其漂白原理和NaClO不同。请回答下列问题:
(1)Y在周期表中的位置为_______ 。
(2)W和R形成的最简单化合物与水反应的化学方程式为_______ 。
(3)X、Z的单质和氢氧化钠溶液能形成电池,该电池工作时的正极反应式是_______ 。
(4)工业上常用电解熔融的Z和W形成的化合物的方法冶炼W单质,W单质在_______ (填“阴极”或“阳极”)得到,阳极石墨随工作时间的延长会被逐渐消耗,其原因是_______ 。
(5)X、Z、W可形成化合物M,常温下,M的酸性电离常数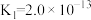 ,则M溶于NaOH溶液的反应的平衡常数
,则M溶于NaOH溶液的反应的平衡常数
_______ 。
(1)Y在周期表中的位置为
(2)W和R形成的最简单化合物与水反应的化学方程式为
(3)X、Z的单质和氢氧化钠溶液能形成电池,该电池工作时的正极反应式是
(4)工业上常用电解熔融的Z和W形成的化合物的方法冶炼W单质,W单质在
(5)X、Z、W可形成化合物M,常温下,M的酸性电离常数
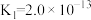 ,则M溶于NaOH溶液的反应的平衡常数
,则M溶于NaOH溶液的反应的平衡常数
您最近一年使用:0次
【推荐2】利用 光催化可以处理含有
光催化可以处理含有 的废水。
的废水。
(1) 的价层电子排布式:
的价层电子排布式:_______ ,下图为 的晶胞,其中●代表的元素是
的晶胞,其中●代表的元素是_______ 。

I.电解法制取
(2)利用铜和钛做电极,电解含有 和
和 的溶液时,
的溶液时, 浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是
浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是_______ 。
II.利用 光催化处理含
光催化处理含 的废水的研究。
的废水的研究。
(3)光照射到 光催化剂上产生光催化反应,
光催化剂上产生光催化反应, 和光照
和光照 分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出
分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出 转化
转化 的电极反应:
的电极反应:_______ 。

(4)研究中对 的作用提出两种假设:
的作用提出两种假设:
a. 作光催化剂;
作光催化剂;
b. 与
与 发生氧化还原反应。
发生氧化还原反应。
已知: 的添加量是
的添加量是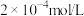 ,
, 的初始浓度是
的初始浓度是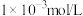 ,对比实验(
,对比实验( 且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是
且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是_______ ,依据是_______ 。

(5)溶液的 对
对 降解率的影响如图所示。
降解率的影响如图所示。

已知: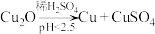 ;酸性越大,
;酸性越大, 被还原率越大。
被还原率越大。
① 分别为2、3、4时,
分别为2、3、4时, 的降解率最好的是
的降解率最好的是_______ ,其原因是_______ 。
②已知 时,会产生
时,会产生 沉淀,则
沉淀,则 时,
时, 的降解率低的原因是
的降解率低的原因是_______ 。
 光催化可以处理含有
光催化可以处理含有 的废水。
的废水。(1)
 的价层电子排布式:
的价层电子排布式: 的晶胞,其中●代表的元素是
的晶胞,其中●代表的元素是
I.电解法制取

(2)利用铜和钛做电极,电解含有
 和
和 的溶液时,
的溶液时, 浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是
浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是II.利用
 光催化处理含
光催化处理含 的废水的研究。
的废水的研究。(3)光照射到
 光催化剂上产生光催化反应,
光催化剂上产生光催化反应, 和光照
和光照 分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出
分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出 转化
转化 的电极反应:
的电极反应:
(4)研究中对
 的作用提出两种假设:
的作用提出两种假设:a.
 作光催化剂;
作光催化剂;b.
 与
与 发生氧化还原反应。
发生氧化还原反应。已知:
 的添加量是
的添加量是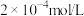 ,
, 的初始浓度是
的初始浓度是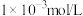 ,对比实验(
,对比实验( 且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是
且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是
(5)溶液的
 对
对 降解率的影响如图所示。
降解率的影响如图所示。
已知:
 ;酸性越大,
;酸性越大, 被还原率越大。
被还原率越大。①
 分别为2、3、4时,
分别为2、3、4时, 的降解率最好的是
的降解率最好的是②已知
 时,会产生
时,会产生 沉淀,则
沉淀,则 时,
时, 的降解率低的原因是
的降解率低的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】利用炼锌钴渣[主要含Co(OH)2、FeSO4、NiSO4和Zn、Cu单质]协同制备Co(OH)3和高纯Zn的流程如下。___________ 。
(2)“沉铁”过程CaCO3的作用有___________ 。
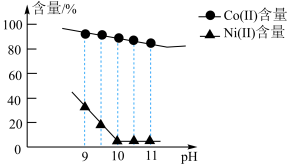
(3)“沉镍”过程pH对溶液中Co(Ⅱ)、Ni(Ⅱ)含量的影响如图。___________ 。
②该过程Co可能发生的反应如下:
Co2++6NH3·H2O=[Co(NH3)6]2++6H2O K1=105
Co2++2NH3·H2O=Co(OH)2↓+2 K2
K2
则K2=___________ ,[Co(NH3)6]2+为___________ (填“热力学”或“动力学”)产物。
(已知:25℃时,Kb(NH3·H2O)=10-4.8,Ksp[Co(OH)2]=10-15)
(4)“沉钴”过程生成Co(OH)3的离子方程式为___________ 。
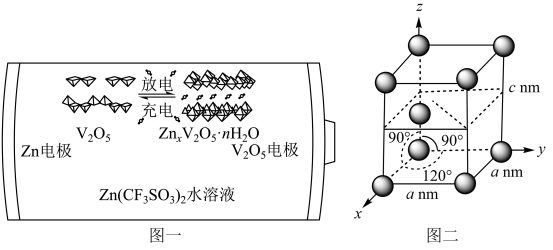
(5)一种以Zn和V2O5为电极、Zn(CF3SO3)2水溶液为电解质的电池,其示意图如下图一所示。放电时,Zn2+可插入V2O5层间形成ZnxV2O5·nH2O。___________ 。
②上述电池充电时阳极的电极反应式为___________ 。
③金属Zn的晶胞如图二,密度为ρg/cm3,则阿伏加德罗常数NA=___________ (列代数式即可,下同),晶胞空间占有率为___________ 。

(2)“沉铁”过程CaCO3的作用有
(3)“沉镍”过程pH对溶液中Co(Ⅱ)、Ni(Ⅱ)含量的影响如图。
②该过程Co可能发生的反应如下:
Co2++6NH3·H2O=[Co(NH3)6]2++6H2O K1=105
Co2++2NH3·H2O=Co(OH)2↓+2
 K2
K2则K2=
(已知:25℃时,Kb(NH3·H2O)=10-4.8,Ksp[Co(OH)2]=10-15)
(4)“沉钴”过程生成Co(OH)3的离子方程式为
(5)一种以Zn和V2O5为电极、Zn(CF3SO3)2水溶液为电解质的电池,其示意图如下图一所示。放电时,Zn2+可插入V2O5层间形成ZnxV2O5·nH2O。
②上述电池充电时阳极的电极反应式为
③金属Zn的晶胞如图二,密度为ρg/cm3,则阿伏加德罗常数NA=
您最近一年使用:0次



