ZnO是重要的化工原料。实验室以粗氧化锌(主要成分为ZnO,还含有少量Fe2O3、CuO等杂质)为原料制备碱式碳酸锌,进而热分解制备活性氧化锌。实验流程如下:
①浸出后溶液中主要含有的离子为[Zn(NH3)4]2+、[Cu(NH3)4]2+和CO ,写出生成[Zn(NH3)4]CO3的化学方程式:
,写出生成[Zn(NH3)4]CO3的化学方程式:___________ 。
②其他条件一定,当水浴温度高于42℃时,测得锌的浸出率随温度升高而降低,其可能原因是___________ 。
(2)“置换铜”:向“浸出”所得滤液中加入稍过量的锌粉,过滤,___________ ,过滤、洗涤并烘干滤渣,得到较纯净的铜。
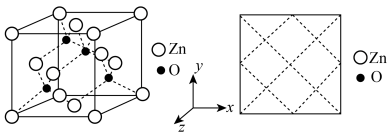
(3)氧化锌晶体的一种晶胞是如题、下左图所示的立方晶胞,其中Zn的配位数为___________ ,请在右图中画出该晶胞沿z轴方向的平面投影图___________ 。

①浸出后溶液中主要含有的离子为[Zn(NH3)4]2+、[Cu(NH3)4]2+和CO
 ,写出生成[Zn(NH3)4]CO3的化学方程式:
,写出生成[Zn(NH3)4]CO3的化学方程式:②其他条件一定,当水浴温度高于42℃时,测得锌的浸出率随温度升高而降低,其可能原因是
(2)“置换铜”:向“浸出”所得滤液中加入稍过量的锌粉,过滤,
(3)氧化锌晶体的一种晶胞是如题、下左图所示的立方晶胞,其中Zn的配位数为
更新时间:2024-04-30 16:36:38
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】氯元素是非常重要的非金属元素,某化学活动社团为了探究氯气的制法、性质和用途,设计了如下实验装置。
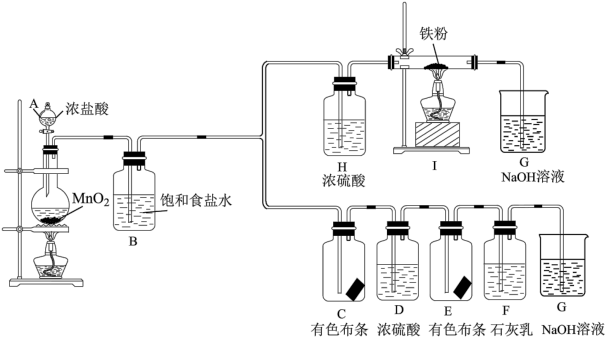
(1)仪器A的名称为___________ ;B中饱和食盐水的作用是___________ 。
(2)请写出二氧化锰与浓盐酸反应的化学方程式___________ 。
(3)广口瓶C、E中,有色布条褪色的是___________ (填“C”或“E”)。
(4)装置F可用于制漂白粉,漂白粉的有效成分是___________。
(5)烧杯G的作用是处理尾气,请写出G中反应的离子方程式___________ 。
(6)写出装置I中反应的化学方程式___________ 。

(1)仪器A的名称为
(2)请写出二氧化锰与浓盐酸反应的化学方程式
(3)广口瓶C、E中,有色布条褪色的是
(4)装置F可用于制漂白粉,漂白粉的有效成分是___________。
| A.Ca(OH)2 | B.Ca(ClO)2 | C.CaCl2 | D.Ca(ClO)2和CaCl2 |
(6)写出装置I中反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】经检测,某化工厂排出的废水呈酸性,且其中含有大量 、
、 、
、 、
、 、
、 ,回答下列问题:
,回答下列问题:
(1)下列离子中,能大量存在于该废水中的是______(填字母)
(2)取 该废水于烧杯中,向烧杯中逐滴加入
该废水于烧杯中,向烧杯中逐滴加入 溶液至溶液呈碱性,此过程中,原废水中存在的离子的数目会发生变化的是
溶液至溶液呈碱性,此过程中,原废水中存在的离子的数目会发生变化的是 、
、 、
、______ (用离子符号表示)。
(3)某化学社团小组成员欲除去废水样品中的 和
和 ,最终得到中性溶液,设计的方案流程如图所示。
,最终得到中性溶液,设计的方案流程如图所示。
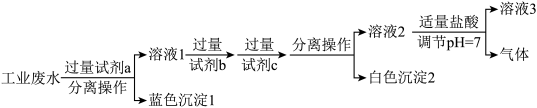
①试剂a、b分别为______ (写化学式):“溶液3”所含的溶质阴离子主要有 、
、______ (写离子符号)。
②“分离操作”的名称是______ 。
③向“溶液1”中加入过量试剂c后,发生反应的离子方程式为______ 。
 、
、 、
、 、
、 、
、 ,回答下列问题:
,回答下列问题:(1)下列离子中,能大量存在于该废水中的是______(填字母)
A. | B. | C. | D. |
(2)取
 该废水于烧杯中,向烧杯中逐滴加入
该废水于烧杯中,向烧杯中逐滴加入 溶液至溶液呈碱性,此过程中,原废水中存在的离子的数目会发生变化的是
溶液至溶液呈碱性,此过程中,原废水中存在的离子的数目会发生变化的是 、
、 、
、(3)某化学社团小组成员欲除去废水样品中的
 和
和 ,最终得到中性溶液,设计的方案流程如图所示。
,最终得到中性溶液,设计的方案流程如图所示。
①试剂a、b分别为
 、
、②“分离操作”的名称是
③向“溶液1”中加入过量试剂c后,发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】21世纪是海洋的世纪。向海则兴、背海则衰。要提高海洋资源开发能力,着力推动海洋经济向质量效益型转变。下图涉及多个以海水为原料的生产流程。
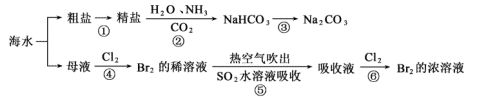
完成下列填空:
(1)写出步骤③的化学方程式:___________ 。
(2)工业上用Cl2与KOH(热溶液)制备KClO3,反应如下:Cl2+KOH→KCl+KClO3+H2O(未配平)上述反应中氧化剂与还原剂的物质的量之比为:___________ 。
(3)下列说法错误的是___________
a.步骤④中实验室制取氯气的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+H2O。
MnCl2+Cl2↑+H2O。
b.步骤②既是离子反应又是氧化还原反应
c.步骤⑤中每有1mol SO2参加反应生成1mol SO 转移2NA个电子。
转移2NA个电子。
d.第⑤⑥步骤的目的是进行溴的富集,提高Br2的浓度
(4)已知氨气极易溶于水,水溶液呈碱性,CO2在水中的溶解度不大,步骤②是在饱和食盐水中先通入NH3再通入CO2,原因是___________ 。
(5)某同学将CO2通入500mlNaOH与Ca(OH)2的混合溶液中,通入CO2的体积(已换算成标况)与沉淀的量如图所示,写出c-d段发生的离子反应方程式:___________ 。由图可知混合溶液中NaOH的物质的量浓度为___________ 。
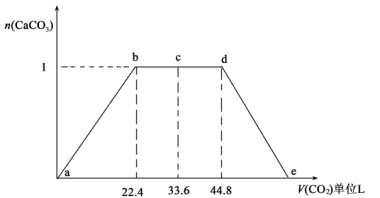

完成下列填空:
(1)写出步骤③的化学方程式:
(2)工业上用Cl2与KOH(热溶液)制备KClO3,反应如下:Cl2+KOH→KCl+KClO3+H2O(未配平)上述反应中氧化剂与还原剂的物质的量之比为:
(3)下列说法错误的是
a.步骤④中实验室制取氯气的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+H2O。
MnCl2+Cl2↑+H2O。b.步骤②既是离子反应又是氧化还原反应
c.步骤⑤中每有1mol SO2参加反应生成1mol SO
 转移2NA个电子。
转移2NA个电子。d.第⑤⑥步骤的目的是进行溴的富集,提高Br2的浓度
(4)已知氨气极易溶于水,水溶液呈碱性,CO2在水中的溶解度不大,步骤②是在饱和食盐水中先通入NH3再通入CO2,原因是
(5)某同学将CO2通入500mlNaOH与Ca(OH)2的混合溶液中,通入CO2的体积(已换算成标况)与沉淀的量如图所示,写出c-d段发生的离子反应方程式:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】铬铁合金作为钢的添加料生产多种具有高强度、耐高温、耐腐蚀等优良性能的特种钢,这类特种钢中含有碳、硅、氧、氮、磷、铜等元素。
(1)基态Cr原子有____ 种不同运动状态的电子,Cr在元素周期表的____ 区。
(2)基态Fe原子的价电子排布图____ 。
(3)KCN中σ键与π键数目之比为____ 。
(4)三硝酸六尿素合铁(III)是用硝酸铁和尿素在一定条件下合成的,反应如下:
Fe(NO3)3+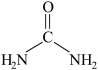 →[Fe(H2NCONH2)6](NO3)3
→[Fe(H2NCONH2)6](NO3)3
尿素分子中C原子采取____ 杂化,N原子采取____ 杂化。与NO 互为等电子体的离子
互为等电子体的离子____ (任填一种),[Fe(H2NCONH2)6](NO3)3中的化学键有____ (填字母)。
A.离子键 B.配位键 C.金属键 D.σ键 E.氢键
(5)化合物H2O由液态的水变为固态的冰时,密度减小的,原因是____ (填编号)。
①水分子间的的氢键数目增加
②氢键具有方向性
③分子间的空间利用率降低,体积增大
④分子间的空间利用率增大,体积减小
(6)铁和氮形成一种晶体,晶胞结构如图所示,则该晶体的化学式为____ 。如果上述晶胞将N原子放在顶点,则Fe原子会在晶胞中出现的位置是____ 。

(7)向盛有天蓝色CuSO4的溶液中逐滴加入过量的氨水,产生的现象是____ ,该实验说明H2O和NH3与Cu2+的配位能力H2O____ NH3(填“>”“<”“=”或“无法判断”),原因是:___ 。在深蓝色溶液中通入SO2至溶液呈微酸性,有白色沉淀产生,已知沉淀中含有一个三角锥形微粒和一个正四面体形微粒。根据信息写出其反应的化学反应方程式____ 。
(1)基态Cr原子有
(2)基态Fe原子的价电子排布图
(3)KCN中σ键与π键数目之比为
(4)三硝酸六尿素合铁(III)是用硝酸铁和尿素在一定条件下合成的,反应如下:
Fe(NO3)3+
 →[Fe(H2NCONH2)6](NO3)3
→[Fe(H2NCONH2)6](NO3)3尿素分子中C原子采取
 互为等电子体的离子
互为等电子体的离子A.离子键 B.配位键 C.金属键 D.σ键 E.氢键
(5)化合物H2O由液态的水变为固态的冰时,密度减小的,原因是
①水分子间的的氢键数目增加
②氢键具有方向性
③分子间的空间利用率降低,体积增大
④分子间的空间利用率增大,体积减小
(6)铁和氮形成一种晶体,晶胞结构如图所示,则该晶体的化学式为

(7)向盛有天蓝色CuSO4的溶液中逐滴加入过量的氨水,产生的现象是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】氮的化合物应用广泛:
(1)Reineckesalt的结构如图所示:

其中配位原子为_______ (填元素符号),阳离子的空间结构为_______ ,NCS-中碳原子杂化方式为_______ 。
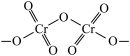
(2)重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O 的结构如图。1mol重铬酸铵[(NH4)2Cr2O7]中含σ键的数目为
的结构如图。1mol重铬酸铵[(NH4)2Cr2O7]中含σ键的数目为_______ NA。
(3)[Zn(IMI)4](ClO4)2是Zn2+的一种配合物,IMI的结构为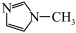 ,IMI的某种衍生物与甘氨酸形成的离子化合物
,IMI的某种衍生物与甘氨酸形成的离子化合物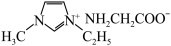 常温下为液态而非固态。原因是
常温下为液态而非固态。原因是_______ 。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。
。
①下列微粒中存在“离域Π键”的是_______ 。
A.CH2=CH-CH=CH2 B.CCl4 C.H2O D.SO2
②NaN3中阴离子N 与CO2互为等电子体,均为直线型结构,N
与CO2互为等电子体,均为直线型结构,N 中的2个大π键可表示为
中的2个大π键可表示为_______ 。
(5)氮化铝(AlN)陶瓷是一种新型无机非金属材料,晶体结构如图所示,1个Al原子周围距离最近的Al原子数为_______ 个;若晶胞结构的高为anm,底边长为bnm,NA表示阿伏加德罗常数的值,则其密度为_______ g·cm-3(列出计算式)。

(1)Reineckesalt的结构如图所示:

其中配位原子为
(2)重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O
 的结构如图。1mol重铬酸铵[(NH4)2Cr2O7]中含σ键的数目为
的结构如图。1mol重铬酸铵[(NH4)2Cr2O7]中含σ键的数目为
(3)[Zn(IMI)4](ClO4)2是Zn2+的一种配合物,IMI的结构为
 ,IMI的某种衍生物与甘氨酸形成的离子化合物
,IMI的某种衍生物与甘氨酸形成的离子化合物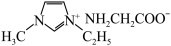 常温下为液态而非固态。原因是
常温下为液态而非固态。原因是(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用
 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。
。①下列微粒中存在“离域Π键”的是
A.CH2=CH-CH=CH2 B.CCl4 C.H2O D.SO2
②NaN3中阴离子N
 与CO2互为等电子体,均为直线型结构,N
与CO2互为等电子体,均为直线型结构,N 中的2个大π键可表示为
中的2个大π键可表示为(5)氮化铝(AlN)陶瓷是一种新型无机非金属材料,晶体结构如图所示,1个Al原子周围距离最近的Al原子数为

您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐3】溴乙烷是一种重要的化工原料,可发生以下转化(部分试剂和条件已略去):___________ 。
(2)A→E的反应试剂和条件为___________ 。
(3)A→B的反应方程式是___________ 。
(4)B→E的反应方程式是___________ 。
(5)C→D的反应类型是___________ 。C直接与AgNO3溶液反应不能产生银镜,但与[Ag(NH3)2]OH溶液能产生银镜,解释原因:___________ 。
(6)B与F生成G的反应方程式是___________ 。
(7)物质H的结构简式为___________ 。
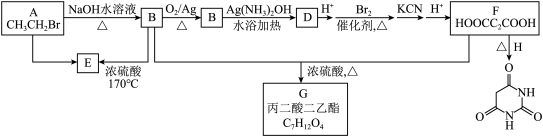
(2)A→E的反应试剂和条件为
(3)A→B的反应方程式是
(4)B→E的反应方程式是
(5)C→D的反应类型是
(6)B与F生成G的反应方程式是
(7)物质H的结构简式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】磷元素存在于人体所有细胞中,是维持骨骼和牙齿的必要物质。近年来,很多磷化物 开始广泛应用在电化学、生物学、光学、催化等方面。
(1)PCl5在晶体状态时,由PCl 、PCl
、PCl 两种离子构成, PC1
两种离子构成, PC1 的空间结构名称为
的空间结构名称为 ____ ,基态磷原子电子排布式为 _____ 。
(2)由磷原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p3、②[Ne]3s23p24s1、③ [Ne]3s23p2, 有关这些微粒的叙述,不正确的是 。
(3)氮化硼、磷化铝、磷化镓(镓为IⅠIA 族元素)晶胞结构都与金刚石的晶胞相似,氮化硼的 硬度仅次于金刚石,磷化铝和磷化镓都是很好的半导体材料,熔点如表所示,分析其变化的原因:_____ 。
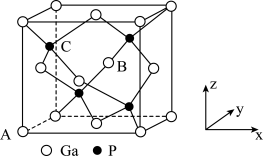
(4)磷化镓的晶胞结构如图所示,与镓原子距离最近且相等的镓原子有_____ 个;A点坐标 为(0,0,0), B 点坐标为(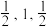 ), 则C 点坐标为
), 则C 点坐标为 ______ ;已知晶胞棱长为a pm, 阿伏加德罗常数为NA, 则磷化镓晶胞密度为 ______ gcm3 (列出计算式)。
(1)PCl5在晶体状态时,由PCl
 、PCl
、PCl 两种离子构成, PC1
两种离子构成, PC1 的空间结构名称为
的空间结构名称为 (2)由磷原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p3、②[Ne]3s23p24s1、③ [Ne]3s23p2, 有关这些微粒的叙述,不正确的是 。
| A.微粒半径:②>①>③ |
| B.电子排布属于基态原子(或离子)的是:①③ |
| C.电离一个电子所需最低能量:①>③>② |
| D.得电子能力:①>③ |
| 物质 | 氮化硼 | 磷化铝 | 磷化镓 |
| 熔点 | 3000℃ | 2000℃ | 1477℃ |
(4)磷化镓的晶胞结构如图所示,与镓原子距离最近且相等的镓原子有
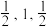 ), 则C 点坐标为
), 则C 点坐标为 
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】镍及其合金是常用的催化剂,在化学反应中广泛应用。
(1)基态镍原子的价电子排布式为___________ 。
(2)镍形成的团簇分子能提高 还原为CO的活性。
还原为CO的活性。 中碳原子的杂化方式为
中碳原子的杂化方式为___________ 。
(3)在Ni和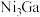 合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。
合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。 溶液的洁净试管中滴加
溶液的洁净试管中滴加 稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是
稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是 。相对于
。相对于 的稀氨水,所得到的银氨溶液的pH
的稀氨水,所得到的银氨溶液的pH___________ (填“升高”“降低”或“不变”),其原因是___________ 。
②呋喃二醇的沸点高于5-羟甲基糠醛,其主要原因是___________ 。
(4)羰基镍[ ]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是
]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是___________ ,其中心原子镍的配位数为___________ 。
(5)Ni和Nb组成的合金的晶胞结构如图所示。 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态镍原子的价电子排布式为
(2)镍形成的团簇分子能提高
 还原为CO的活性。
还原为CO的活性。 中碳原子的杂化方式为
中碳原子的杂化方式为(3)在Ni和
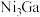 合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。
合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。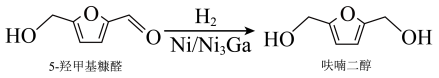
 溶液的洁净试管中滴加
溶液的洁净试管中滴加 稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是
稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是 。相对于
。相对于 的稀氨水,所得到的银氨溶液的pH
的稀氨水,所得到的银氨溶液的pH②呋喃二醇的沸点高于5-羟甲基糠醛,其主要原因是
(4)羰基镍[
 ]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是
]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是(5)Ni和Nb组成的合金的晶胞结构如图所示。
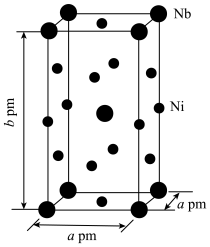
 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
【推荐3】2023年6月27日,我国工业与信息化部办公下达了2023年度国家工业节能监察任务的通知,其监察的重点为企业节能减排的落实情况。
(1)利用反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H,可减少CO2排放,并介成清洁能源。该反应一般认为可通过以下两步来实现:
CH3OH(g)+H2O(g) △H,可减少CO2排放,并介成清洁能源。该反应一般认为可通过以下两步来实现:
①CO2(g)+H2(g) H2O(g)+CO(g) △H1=+41kJ•mol-1
H2O(g)+CO(g) △H1=+41kJ•mol-1
②CO2(g)+2H2(g) CH3OH(g) △H2=-90kJ•mol-1
CH3OH(g) △H2=-90kJ•mol-1
则合成反应的△H=______ kJ•mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是______ (填标号)。
A. B.
B.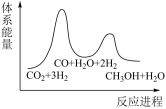
C. D.
D.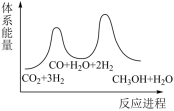
(2)500℃时,在2L的密闭容器中充入3molCO2和8molH2,发生CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下列现象可以说明反应达到平衡的是
CH3OH(g)+H2O(g)。下列现象可以说明反应达到平衡的是______ 。
A.3 正(H2)=
正(H2)= 逆(H2O) B.气体平均相对分子质量不再改变
逆(H2O) B.气体平均相对分子质量不再改变
C.气体密度不再改变 D.CO2与H2的物质的量之比不再改变
测得t=5min时,反应达到平衡,此时c(CO2)=0.5mol/L,则从反应开始到平衡,CO2的平均反应速率 (CO2)=
(CO2)= ______ 。
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。已知ZrO2的熔点高达2700℃,四方ZrO2的晶胞如图所示:

ZrO2属于______ 晶体(选填“分子”或“离子”),若四方ZrO2的晶胞参数为apm,该晶体的密度为______ g•cm-3(写表达式,用NA表示阿伏加德罗常数)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=______ (用含x的代数式表示)。
(1)利用反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H,可减少CO2排放,并介成清洁能源。该反应一般认为可通过以下两步来实现:
CH3OH(g)+H2O(g) △H,可减少CO2排放,并介成清洁能源。该反应一般认为可通过以下两步来实现:①CO2(g)+H2(g)
 H2O(g)+CO(g) △H1=+41kJ•mol-1
H2O(g)+CO(g) △H1=+41kJ•mol-1②CO2(g)+2H2(g)
 CH3OH(g) △H2=-90kJ•mol-1
CH3OH(g) △H2=-90kJ•mol-1则合成反应的△H=
A.
 B.
B.
C.
 D.
D.
(2)500℃时,在2L的密闭容器中充入3molCO2和8molH2,发生CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。下列现象可以说明反应达到平衡的是
CH3OH(g)+H2O(g)。下列现象可以说明反应达到平衡的是A.3
 正(H2)=
正(H2)= 逆(H2O) B.气体平均相对分子质量不再改变
逆(H2O) B.气体平均相对分子质量不再改变C.气体密度不再改变 D.CO2与H2的物质的量之比不再改变
测得t=5min时,反应达到平衡,此时c(CO2)=0.5mol/L,则从反应开始到平衡,CO2的平均反应速率
 (CO2)=
(CO2)= (3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。已知ZrO2的熔点高达2700℃,四方ZrO2的晶胞如图所示:

ZrO2属于
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室探究制备高锰酸钾的绿色化方案,其实验流程如图1。
已知:①K2MnO4水溶液呈墨绿色,在酸性、中性和弱碱性环境下, 会发生自身氧化还原(歧化)反应,生成
会发生自身氧化还原(歧化)反应,生成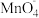 和MnO2;②碱性条件下,三价锰易形成MnOOH沉淀,该物质250℃分解为Mn2O3;③相关物质的溶解度数据如表:
和MnO2;②碱性条件下,三价锰易形成MnOOH沉淀,该物质250℃分解为Mn2O3;③相关物质的溶解度数据如表:
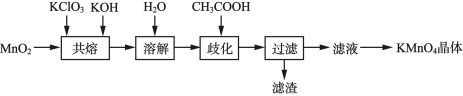
图1
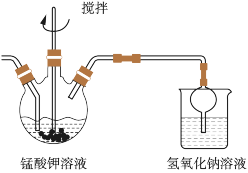
图2
(1)“共熔”投料的顺序为先加入KOH和KClO3混合均匀,待小火完全熔融,再加入MnO2,迅速搅拌。不能先将KClO3与MnO2混合的原因是__________
(2)溶解后所得溶液转入三颈瓶中,趁热滴入6mol·L-1的乙酸,调节pH≈10,在如图2所示的装置中进行歧化。
①判断三颈瓶中K2MnO4完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到___________ ,表示 已完全反应。
已完全反应。
②也可以将滴入乙酸改为通入CO2引发“歧化”,反应化学方程式是___________ ,当溶液pH值达10~11时,停止通CO2;若CO2过多,可能造成的不良后果是___________
(3)从提高原料利用率的角度分析,本实验流程的优点是_________
(4)请设计实验方案,由MnSO4溶液制备较纯净Mn2O3.向MnSO4溶液中,72h后得到产品Mn2O3(必须使用的试剂:0.2mol•L-1氨水、3%H2O2溶液、热水)。_________
已知:①K2MnO4水溶液呈墨绿色,在酸性、中性和弱碱性环境下,
 会发生自身氧化还原(歧化)反应,生成
会发生自身氧化还原(歧化)反应,生成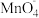 和MnO2;②碱性条件下,三价锰易形成MnOOH沉淀,该物质250℃分解为Mn2O3;③相关物质的溶解度数据如表:
和MnO2;②碱性条件下,三价锰易形成MnOOH沉淀,该物质250℃分解为Mn2O3;③相关物质的溶解度数据如表:| 20℃ | K2CO3 | KHCO3 | K2MnO4 | KMnO4 |
| S(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |

图1

图2
(1)“共熔”投料的顺序为先加入KOH和KClO3混合均匀,待小火完全熔融,再加入MnO2,迅速搅拌。不能先将KClO3与MnO2混合的原因是
(2)溶解后所得溶液转入三颈瓶中,趁热滴入6mol·L-1的乙酸,调节pH≈10,在如图2所示的装置中进行歧化。
①判断三颈瓶中K2MnO4完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到
 已完全反应。
已完全反应。②也可以将滴入乙酸改为通入CO2引发“歧化”,反应化学方程式是
(3)从提高原料利用率的角度分析,本实验流程的优点是
(4)请设计实验方案,由MnSO4溶液制备较纯净Mn2O3.向MnSO4溶液中,72h后得到产品Mn2O3(必须使用的试剂:0.2mol•L-1氨水、3%H2O2溶液、热水)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是_____________ .
(2)“平炉”中发生的化学方程式为_____________ .
(3)“平炉”中需要加压,其目的是_____________ .
(4)将K2MnO4转化为KMnO4的生产有两种工艺.
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和_____________ (写化学式).
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为_____________ ,阴极逸出的气体是_____________ .与传统工艺比较,现代工艺的有点除了产品纯度高外还有_____________
(5)高锰酸钾纯度的测定:称取1.0800g样品,溶解后定容于100mL容量瓶中,摇匀.取浓度为0.2000mol•L-1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48mL,该样品的纯度为_____________ (列出计算式即可,已知2 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O).
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O).

回答下列问题:
(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是
(2)“平炉”中发生的化学方程式为
(3)“平炉”中需要加压,其目的是
(4)将K2MnO4转化为KMnO4的生产有两种工艺.
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
(5)高锰酸钾纯度的测定:称取1.0800g样品,溶解后定容于100mL容量瓶中,摇匀.取浓度为0.2000mol•L-1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48mL,该样品的纯度为
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O).
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O).
您最近一年使用:0次

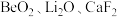 及少量
及少量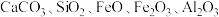 )中提取铍的工艺如图所示:
)中提取铍的工艺如图所示: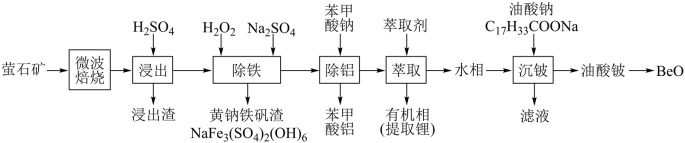
 的方法是
的方法是

