(Ⅰ)Q、W、X、Y、Z五种短周期元素原子序数依次增大,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)W、X、Y三种元素的第一电离能由大到小的顺序是__________ 。
(2) 与
与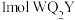 所含
所含 键的比值为
键的比值为__________ 。
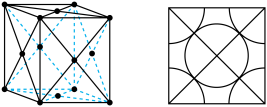
(3)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为__________ 。
①该化合物的化学式为:__________ 。
②预测该化合物熔点应__________ 金刚石(填“高于”或“低于”)。
(Ⅱ)铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
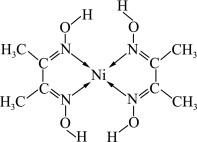
(5) 可以与
可以与 、
、 、有机分子等形成配合物。基态
、有机分子等形成配合物。基态 的电子排布式为
的电子排布式为__________ 。
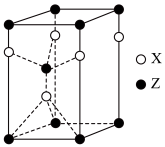
(6)普鲁士蓝俗称铁蓝,结构如图甲所示( 未画出),平均每两个立方体中含有一个
未画出),平均每两个立方体中含有一个 ,该晶体的化学式为
,该晶体的化学式为__________ 。又知该晶体中铁元素有 价和
价和 价两种,则
价两种,则 与
与 的个数比为
的个数比为__________ 。
(7)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为__________ 。
(1)W、X、Y三种元素的第一电离能由大到小的顺序是
(2)
 与
与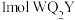 所含
所含 键的比值为
键的比值为(3)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为
①该化合物的化学式为:
②预测该化合物熔点应
(Ⅱ)铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
(5)
 可以与
可以与 、
、 、有机分子等形成配合物。基态
、有机分子等形成配合物。基态 的电子排布式为
的电子排布式为(6)普鲁士蓝俗称铁蓝,结构如图甲所示(
 未画出),平均每两个立方体中含有一个
未画出),平均每两个立方体中含有一个 ,该晶体的化学式为
,该晶体的化学式为 价和
价和 价两种,则
价两种,则 与
与 的个数比为
的个数比为(7)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为
更新时间:2024-05-03 13:20:13
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】金属及其化合物是物质世界的重要组成部分。请回答:
(1)锶(Sr)、钛(Ti)、氧(O)组成的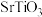 晶体的立方体晶胞如图所示,其中Sr、Ti与O的间距均相等,且Sr与O的最小间距要大于Ti与O的最小间距。
晶体的立方体晶胞如图所示,其中Sr、Ti与O的间距均相等,且Sr与O的最小间距要大于Ti与O的最小间距。________ (写晶体类型名称)。
②请用小黑点在晶胞示意图中标出O所在的位置________ 。
(2)具有高能量密度的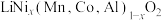 是值得深入研究的电池正极材料。
是值得深入研究的电池正极材料。
①与Co、Ni位于同一周期且同一族的元素是________ (填写元素符号)。
②基态Co原子的核外电子排布式是________ 。
(3)下列说法正确的是________(填序号)。
(4)金属 与
与 的配合物
的配合物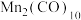 在一定条件下可发生如下转化:
在一定条件下可发生如下转化: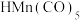 分子中有
分子中有 个配位键时,
个配位键时,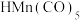 的物质的量是
的物质的量是________ mol。
②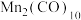 与Na反应后,结构模型中所示的∠1将会
与Na反应后,结构模型中所示的∠1将会________ (选填“增大”“减小”或“不变”),原因是________ 。
(1)锶(Sr)、钛(Ti)、氧(O)组成的
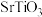 晶体的立方体晶胞如图所示,其中Sr、Ti与O的间距均相等,且Sr与O的最小间距要大于Ti与O的最小间距。
晶体的立方体晶胞如图所示,其中Sr、Ti与O的间距均相等,且Sr与O的最小间距要大于Ti与O的最小间距。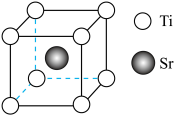
②请用小黑点在晶胞示意图中标出O所在的位置
(2)具有高能量密度的
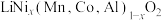 是值得深入研究的电池正极材料。
是值得深入研究的电池正极材料。①与Co、Ni位于同一周期且同一族的元素是
②基态Co原子的核外电子排布式是
(3)下列说法正确的是________(填序号)。
A.离子势 : :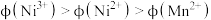 |
| B.与Al同周期且第一电离能小于Al的元素有2种 |
| C.基态O原子中s能级电子数与p能级电子数相等 |
D.离子键百分比: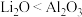 |
(4)金属
 与
与 的配合物
的配合物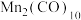 在一定条件下可发生如下转化:
在一定条件下可发生如下转化:
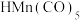 分子中有
分子中有 个配位键时,
个配位键时,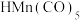 的物质的量是
的物质的量是②
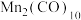 与Na反应后,结构模型中所示的∠1将会
与Na反应后,结构模型中所示的∠1将会
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】金属Mn、Co、Ni、Sb等在电池、储氢材料、催化剂等方面有广泛应用。请回答下列问题:
(1)基态Co原子中,核外电子占据的最高能层的符号是_______ ,基态Ni简化的核外电子排布式为_______ 。
(2)铜锰氧化物( CuMn2O4)能在常温下催化氧化甲醛生成甲酸(结构如图)。
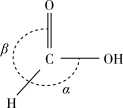
①甲酸的沸点比甲醛的_______ (填“低”或“高”),主要原因是_______ 。
②甲酸分子中O-H键的类型是s-sp3σ键,C-H键的类型是_______ σ键,键角:α_______ β(填“>”“=”或“<”)。
(3)超强酸氟锑酸(结构如图)在化学和化学工业上有很大的应用价值,是活性极高的催化剂。

①该物质中∠FSbF为90°或180° ,则阴离子的空间构型为_______ 。
②阴离子的中心原子的杂化轨道类型是_______ (填序号)。
A. sp3d2 B. sp2 C. sp3 D. sp
(4)Mg2 NiH4是科学家研究的一种高效固态储氢材料。在Mg2NiH4晶胞中,Ni原子占据如图所示的顶点和面心,Mg2+处于图中八个小立方体的体心。Mg2+和Ni原子的最短距离为d nm,NA为阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3(用含NA、d、M的代数式表示,Mg2NiH4的相对分子质量为M)。
(1)基态Co原子中,核外电子占据的最高能层的符号是
(2)铜锰氧化物( CuMn2O4)能在常温下催化氧化甲醛生成甲酸(结构如图)。

①甲酸的沸点比甲醛的
②甲酸分子中O-H键的类型是s-sp3σ键,C-H键的类型是
(3)超强酸氟锑酸(结构如图)在化学和化学工业上有很大的应用价值,是活性极高的催化剂。

①该物质中∠FSbF为90°或180° ,则阴离子的空间构型为
②阴离子的中心原子的杂化轨道类型是
A. sp3d2 B. sp2 C. sp3 D. sp
(4)Mg2 NiH4是科学家研究的一种高效固态储氢材料。在Mg2NiH4晶胞中,Ni原子占据如图所示的顶点和面心,Mg2+处于图中八个小立方体的体心。Mg2+和Ni原子的最短距离为d nm,NA为阿伏加德罗常数的值,该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】Cu元素及其化合物在工农业生产和生活中有重要用途。请回答下列问题:
(1)基态Cu原子价电子排布图为_______ ,其原子核外电子占据的最高能层符号为_______ ,其最外层电子的电子云形状为_______ 。
(2)4-甲基咪唑(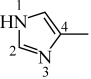 )可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
)可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
①4-甲基咪唑中_______ (填“1”或“3”)号N原子更容易与Cu+形成配位键。4-甲基咪唑中的大π键可表示为_______ 。(表示方法为Π ,n为成环原子个数,m为形成大π键电子个数)
,n为成环原子个数,m为形成大π键电子个数)
②配位原子提供孤电子对的能力是影响配体与Cu+之间配位键强度的一个重要因素。若用某结构相似的含O配体与Cu+配位,所得配合物的稳定性比含N配体低,可能的原因是_______ 。
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如图。
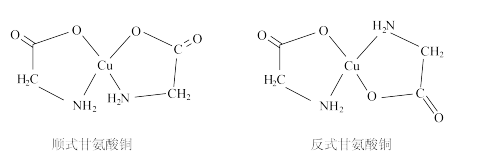
甘氨酸铜中铜原子的杂化方式为_______ 。(填“sp3”或“dsp2”)
(4)O、Cu、Ba、Hg形成的某种超导材料的晶胞如图所示。设阿伏加德罗常数的值为NA,该晶体的密度为_______ g•cm-3。

(1)基态Cu原子价电子排布图为
(2)4-甲基咪唑(
 )可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
)可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。①4-甲基咪唑中
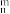 ,n为成环原子个数,m为形成大π键电子个数)
,n为成环原子个数,m为形成大π键电子个数)②配位原子提供孤电子对的能力是影响配体与Cu+之间配位键强度的一个重要因素。若用某结构相似的含O配体与Cu+配位,所得配合物的稳定性比含N配体低,可能的原因是
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如图。

甘氨酸铜中铜原子的杂化方式为
(4)O、Cu、Ba、Hg形成的某种超导材料的晶胞如图所示。设阿伏加德罗常数的值为NA,该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】铜、锌为ds区元素,它们的单质及化合物在工业生产中具有重要的用途。回答下列问题:
(1)基态铜原子的价层电子排布图为___________ ,基态锌原子的简化电子排布式为___________ ,与铜同周期且与铜具有相同未成对电子数目的元素有___________ (填元素符号)。
(2)铜的第二电离能___________ (填“>”“<”或=”)锌的第二电离能,其主要原因是 ___________ 。
(3)一种Cu2+配合物的结构如图所示:
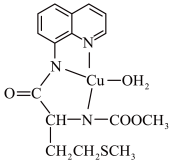
1 mol该配合物中含有___________ mol配位键,N原子的杂化方式为 ___________ ,C-N键的共价键类型为σ键,则C=O键的共价键类型为___________ 。
(4)锌单质的晶胞采用六方最密堆积,其晶胞结构如下图所示,六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为___________ g·cm-3(列出计算式)。

(1)基态铜原子的价层电子排布图为
(2)铜的第二电离能
(3)一种Cu2+配合物的结构如图所示:

1 mol该配合物中含有
(4)锌单质的晶胞采用六方最密堆积,其晶胞结构如下图所示,六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】铬是一种重要的战略金属元素,在工业生产中有着重要的应用。
(1)基态铬原子的价层电子排布式为_______ 。
(2)金属铬的第二电离能 和锰的第二电离能
和锰的第二电离能 分别为
分别为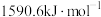 、
、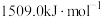 ,
,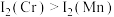 的原因是
的原因是_______ 。
(3)铬、钙、氧可形成一种具有特殊导电性的复合氧化物,其晶胞结构如图甲所示。
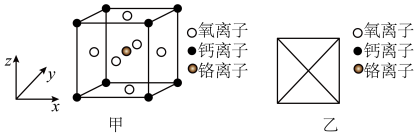
①该化合物的化学式为_______ 。
②请在图乙中画出该晶胞沿 轴方向的投影图
轴方向的投影图_______ 。
③已知氧离子与钙离子的最近距离为 ,请计算该晶体的密度:
,请计算该晶体的密度:_______  (列计算式)。
(列计算式)。
(4)三氯化铬晶体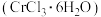 是一种难溶于乙醚,易溶于水、乙醇的绿色晶体,可作为猪饲料的添加剂。某研究小组以铬酸钠
是一种难溶于乙醚,易溶于水、乙醇的绿色晶体,可作为猪饲料的添加剂。某研究小组以铬酸钠 为主要原料制备
为主要原料制备 ,实验步骤如下:
,实验步骤如下:
i、将铬酸钠、甲醇、水依次加入三颈烧瓶中;
ii、升温至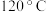 ,加入过量盐酸,保持温度在
,加入过量盐酸,保持温度在 继续反应三小时;
继续反应三小时;
iii、待反应液冷却后,用 溶液调节
溶液调节 ,得到
,得到 沉淀;
沉淀;
iv、_______,得到 晶体。
晶体。
①下列说法正确的是_______ (填序号)。
A由于步骤i中的甲醇具有毒性,故可用乙醇代替
B.步骤ii应快速加入过量盐酸,防止 水解而导致反应液出现浑浊
水解而导致反应液出现浑浊
C.三颈烧瓶中发生反应的离子方程式为
D.制备过程中应采用水浴加热,以便于控制温度
②步骤iv的实验操作如下:将过滤得到的固体溶于足量的盐酸中,_______ ,用_______ 洗涤,干燥后得到 晶体。
晶体。
(1)基态铬原子的价层电子排布式为
(2)金属铬的第二电离能
 和锰的第二电离能
和锰的第二电离能 分别为
分别为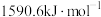 、
、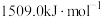 ,
,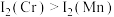 的原因是
的原因是(3)铬、钙、氧可形成一种具有特殊导电性的复合氧化物,其晶胞结构如图甲所示。

①该化合物的化学式为
②请在图乙中画出该晶胞沿
 轴方向的投影图
轴方向的投影图③已知氧离子与钙离子的最近距离为
 ,请计算该晶体的密度:
,请计算该晶体的密度: (列计算式)。
(列计算式)。(4)三氯化铬晶体
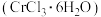 是一种难溶于乙醚,易溶于水、乙醇的绿色晶体,可作为猪饲料的添加剂。某研究小组以铬酸钠
是一种难溶于乙醚,易溶于水、乙醇的绿色晶体,可作为猪饲料的添加剂。某研究小组以铬酸钠 为主要原料制备
为主要原料制备 ,实验步骤如下:
,实验步骤如下:i、将铬酸钠、甲醇、水依次加入三颈烧瓶中;
ii、升温至
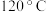 ,加入过量盐酸,保持温度在
,加入过量盐酸,保持温度在 继续反应三小时;
继续反应三小时;iii、待反应液冷却后,用
 溶液调节
溶液调节 ,得到
,得到 沉淀;
沉淀;iv、_______,得到
 晶体。
晶体。①下列说法正确的是
A由于步骤i中的甲醇具有毒性,故可用乙醇代替
B.步骤ii应快速加入过量盐酸,防止
 水解而导致反应液出现浑浊
水解而导致反应液出现浑浊C.三颈烧瓶中发生反应的离子方程式为

D.制备过程中应采用水浴加热,以便于控制温度
②步骤iv的实验操作如下:将过滤得到的固体溶于足量的盐酸中,
 晶体。
晶体。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】Ⅰ.原子序数依次递增的短周期Q、W、X、Y、Z五种元素,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。(涉及元素时用对应的元素符号表示)
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是___________ 。
(2) 与
与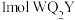 所含
所含 键的比值为
键的比值为___________ 。
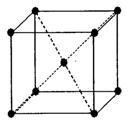
(3)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为___________ 。
①该化合物的化学式为:___________ 。
②预测该化合物熔点应___________ 金刚石(填“高于”或“低于”)。
Ⅱ.铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
(5) 可以与
可以与 、
、 、有机分子等形成配合物。基态
、有机分子等形成配合物。基态 的外围电子排布式为
的外围电子排布式为___________ 。
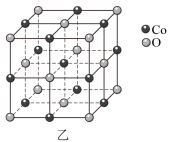
(6)普鲁士蓝俗称铁蓝,结构如图甲所示( 未画出),平均每两个立方体中含有一个
未画出),平均每两个立方体中含有一个 ,该晶体的化学式为
,该晶体的化学式为___________ 。又知该晶体中铁元素有 价和
价和 价两种,则
价两种,则 与
与 的个数比为
的个数比为___________ 。
(7)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为___________ ,两种晶体中空间利用率较高的是___________ 。(填“图乙”或“图丙”)
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是
(2)
 与
与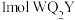 所含
所含 键的比值为
键的比值为(3)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

①该化合物的化学式为:
②预测该化合物熔点应
Ⅱ.铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
(5)
 可以与
可以与 、
、 、有机分子等形成配合物。基态
、有机分子等形成配合物。基态 的外围电子排布式为
的外围电子排布式为(6)普鲁士蓝俗称铁蓝,结构如图甲所示(
 未画出),平均每两个立方体中含有一个
未画出),平均每两个立方体中含有一个 ,该晶体的化学式为
,该晶体的化学式为 价和
价和 价两种,则
价两种,则 与
与 的个数比为
的个数比为(7)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态。(答题时用ABCDE对应的元素符号表示)
(1)A的氢化物A2H2分子的空间构型为__________ ,其中心原子采取的杂化形式为___________ ,分子中含有___________ 个 键,
键,__________ π键。
(2)写出化合物DC的电子式_______ ,E原子的核外电子排布式________ 。
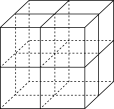
(3)由E元素形成的金属的晶胞结构如右图,则该晶胞中含有金属原子的数目为_______________ 。
(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于__________ (填晶体类型)。

(1)A的氢化物A2H2分子的空间构型为
 键,
键,(2)写出化合物DC的电子式
(3)由E元素形成的金属的晶胞结构如右图,则该晶胞中含有金属原子的数目为
(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】氮及其化合物与人类生产、生活息息相关。
(1)在现代化学中,常利用________ 上的特征谱线来鉴定元素,称为光谱分析。
(2)基态N原子的价电子占据的能量最高的能级是________ ,价电子在该能级上的排布遵循的原则是_____________ 。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。l mol NH4BF4含有______ mol配位键。
(4)化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。N4比P4的沸点________ ,原因为_______________________ 。

(5)尿素(H2NCONH2)也是一种常用的化肥,其分子中原子的杂化轨道类型有________ ,σ键和π键数目之比为__________ 。
(6)Cu3N具有良好的电学和光学性能,其晶胞结构如图。Cu+半径为a pm,N3-半径为b pm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为________ ,Cu3N 的密度为________ g·cm-3。(阿伏伽德罗常数用NA表示)
(1)在现代化学中,常利用
(2)基态N原子的价电子占据的能量最高的能级是
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。l mol NH4BF4含有
(4)化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。N4比P4的沸点

(5)尿素(H2NCONH2)也是一种常用的化肥,其分子中原子的杂化轨道类型有
(6)Cu3N具有良好的电学和光学性能,其晶胞结构如图。Cu+半径为a pm,N3-半径为b pm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为
您最近一年使用:0次
【推荐3】“China”的含义又指瓷器,反映了在世人眼中,中国作为瓷器故乡的形象。X、Y、Z、B、A皆是元素周期表中前四周期的元素,原子序数依次增大。X、Z、Y、A是地壳中含量最多的四种元素,B的基态原子为第四周期基态原子中未配对电子数最多的。

(1)请写出B原子的价电子轨道表示式_______ 。
(2)比较Y原子与它同周期相邻元素的第一电离能,由大到小的顺序为_______ (用元素符号表示)。
(3)Z的氧化物晶体与干冰相比,_______ (填化学式)沸点更高,解释原因:_______ 。
(4)实验发现,Y的氯化物的蒸气溶于非极性溶剂中或处于熔融状态时,都以二聚态(Y2Cl6)形式存在。其球棍模型如图所示。

①该分子中Y原子采取_______ 杂化。分子中存在配位键,配位原子为_______ 。
②Y2Cl6与过量NaOH溶液反应生成Na[Y(OH)4],[Y(OH)4]-中存在的化学作用力类型有_______ (填标号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键 E.配位键 F.σ键 G.π键 H.氢键
(5)黑釉由具有尖晶石结构的氧化物(AB2O4)构成(如下图),该尖晶石结构的立方晶胞(a)可分为8个立方亚单位,虚线表示亚单位的内部边缘。其中4个亚基属于I型,其他4个亚单位是II型(b)。I型和II型相邻亚基的详细信息如图(c)所示。

一个晶胞(a)中有_______ 个A离子。晶胞(a)的晶胞边长为acm,该晶体的密度为_______ g/cm3(填计算式)。

(1)请写出B原子的价电子轨道表示式
(2)比较Y原子与它同周期相邻元素的第一电离能,由大到小的顺序为
(3)Z的氧化物晶体与干冰相比,
(4)实验发现,Y的氯化物的蒸气溶于非极性溶剂中或处于熔融状态时,都以二聚态(Y2Cl6)形式存在。其球棍模型如图所示。

①该分子中Y原子采取
②Y2Cl6与过量NaOH溶液反应生成Na[Y(OH)4],[Y(OH)4]-中存在的化学作用力类型有
A.离子键 B.金属键 C.极性共价键 D.非极性共价键 E.配位键 F.σ键 G.π键 H.氢键
(5)黑釉由具有尖晶石结构的氧化物(AB2O4)构成(如下图),该尖晶石结构的立方晶胞(a)可分为8个立方亚单位,虚线表示亚单位的内部边缘。其中4个亚基属于I型,其他4个亚单位是II型(b)。I型和II型相邻亚基的详细信息如图(c)所示。

一个晶胞(a)中有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】嫦娥五号带回的月球土壤中可能存在金、银、铜、铁、锌、铼等元素。
(1)铼位于第六周期,与锰属于同一副族。类比锰,写出基态铼(Re)原子的价层电子排布式:_____ 。
(2)Cu、 位于元素周期表的
位于元素周期表的_____ 区,第二电离能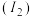 :
: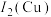
_____ 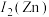 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是_____ 。
(3)甘氨酸亚铁络合物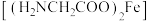 是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
① 中含有第二周期元素的第一电离能由大到小的顺序为
中含有第二周期元素的第一电离能由大到小的顺序为_____ (用元素符号表示),碳原子的杂化类型为_____ 。
②甘氨酸 的沸点比相同相对分子质量的烷烃大很多,原因是
的沸点比相同相对分子质量的烷烃大很多,原因是_____ 。
(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如图所示,则分子内的作用力不可能含有_____ (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)铜为面心立方最密堆积的金属,其晶胞结构如图所示,已知铜原子的半径为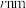 ,则铜晶体的密度
,则铜晶体的密度
_____  (只需列出计算式)。
(只需列出计算式)。
(1)铼位于第六周期,与锰属于同一副族。类比锰,写出基态铼(Re)原子的价层电子排布式:
(2)Cu、
 位于元素周期表的
位于元素周期表的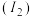 :
: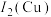
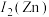 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是(3)甘氨酸亚铁络合物
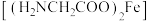 是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。①
 中含有第二周期元素的第一电离能由大到小的顺序为
中含有第二周期元素的第一电离能由大到小的顺序为②甘氨酸
 的沸点比相同相对分子质量的烷烃大很多,原因是
的沸点比相同相对分子质量的烷烃大很多,原因是(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如图所示,则分子内的作用力不可能含有

A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)铜为面心立方最密堆积的金属,其晶胞结构如图所示,已知铜原子的半径为
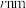 ,则铜晶体的密度
,则铜晶体的密度
 (只需列出计算式)。
(只需列出计算式)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】2022年诺贝尔化学奖授子在发展点击化学方面做出贡献的科学家。点击化学的代表反应为CuCl催化的叠氮—炔基Husigen环加成反应,常用的无机试剂有 、
、 等。
等。
(1)铜在元素周期表中位置为___________ ,基态 的价电子排布式为
的价电子排布式为___________ 。
(2)N、S、O、F的第一电离能由大到小顺序为___________ 。
(3) 的分子结构如图所示,键角
的分子结构如图所示,键角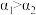 的原因主要是
的原因主要是___________ 。 是叠氮酸(
是叠氮酸( )的钠盐,
)的钠盐, 在常温下是液体,沸点相对较高,为308.8K,主要原因是
在常温下是液体,沸点相对较高,为308.8K,主要原因是___________ 。 分子的空间结构如图所示(图中键长单位为
分子的空间结构如图所示(图中键长单位为 )。
)。 、
、 和
和 的共价键键长分别为
的共价键键长分别为 、
、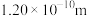 和
和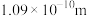 ;试画出
;试画出 分子的结构式
分子的结构式___________ 。___________ ,设 为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为
为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为___________  。
。
 、
、 等。
等。(1)铜在元素周期表中位置为
 的价电子排布式为
的价电子排布式为(2)N、S、O、F的第一电离能由大到小顺序为
(3)
 的分子结构如图所示,键角
的分子结构如图所示,键角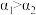 的原因主要是
的原因主要是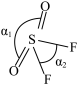
 是叠氮酸(
是叠氮酸( )的钠盐,
)的钠盐, 在常温下是液体,沸点相对较高,为308.8K,主要原因是
在常温下是液体,沸点相对较高,为308.8K,主要原因是 分子的空间结构如图所示(图中键长单位为
分子的空间结构如图所示(图中键长单位为 )。
)。 、
、 和
和 的共价键键长分别为
的共价键键长分别为 、
、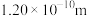 和
和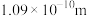 ;试画出
;试画出 分子的结构式
分子的结构式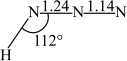
 为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为
为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】翡翠是一类名贵的装饰品,其主要成分为硅酸铝钠(NaAlSi2O6),常含微量Cr、Ni、Mn等元素。回答下列问题:
(1)基态硅原子的电子排布式为__ ;基态铬原子的价电子排布图不能写成 形式,其原因是违背了
形式,其原因是违背了___ 。
(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为___ (填元素符号),灼烧硅酸铝钠时,当钠元素的价电子由__ (填“激发态”或“基态”)跃迁到另一状态时产生黄色火焰。
(3)工业上冶炼金属铝的方程式为__ 。硅与碳类似,能与氢元素形成SiH4、Si2H4、Si3H8,此三种分子中硅原子为sp3杂化的有___ ;分子空间构型属于正四面体的是__ 。
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:___ 。
(5)某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为__ 。知该晶体密度为ρg·cm-3。晶体中Cr原子和N的最近核间距为___ pm(NA表示阿伏加德罗常数值)。
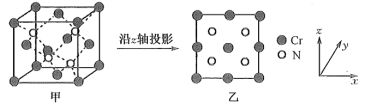
(1)基态硅原子的电子排布式为
 形式,其原因是违背了
形式,其原因是违背了(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为
(3)工业上冶炼金属铝的方程式为
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:
(5)某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为

您最近一年使用:0次



