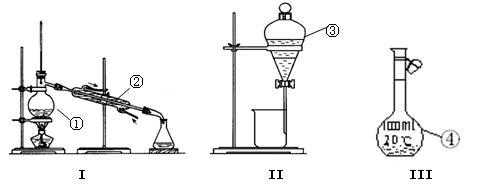
某小组设计实验制备苯甲酸:
【原理】
 苯甲醛(新蒸),
苯甲醛(新蒸), 氢氧化钾,乙醚,
氢氧化钾,乙醚, 碳酸钠溶液,浓盐酸。
碳酸钠溶液,浓盐酸。
【资料】
乙醚的密度为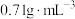 ,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
【步骤】
①在锥形瓶中将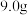 氢氧化钾溶于
氢氧化钾溶于 水配成溶液,冷却至室温后,加入
水配成溶液,冷却至室温后,加入 新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置
新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置 以上。
以上。
②向反应混合物中逐滴加入足量的水(约 ),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用
),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用 乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
③过滤后蒸馏,收集204~206℃的馏分。
④乙醚萃取后的水溶液,用浓盐酸酸化。充分冷却使苯甲酸析出完全,抽滤,如图乙所示。粗产品用水重结晶,得苯甲酸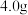 。
。
(1)苯甲醇中最多有___________ 个原子共平面。
(2)乙醚萃取时分离有机相部分操作如下,正确的先后顺序为___________ (填标号);分离乙醚相的具体操作是___________ 。
a.振荡,放气 b.加入萃取剂 c.静置、分层 d.分液
(3)乙醚溶液依次用饱和 溶液、
溶液、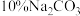 溶液洗涤,其目的依次是
溶液洗涤,其目的依次是___________ 、___________ 。
(4)乙醚萃取后的水溶液,用浓盐酸酸化到中性是否最恰当?___________ (填“最恰当”或“不恰当”),理由是___________ 。
(5)相对普通过滤,利用图乙装置进行抽滤操作的优点主要有___________ 、___________ (答两点)。
(6)本实验的苯甲酸产率约为___________(填标号)。
【原理】

 苯甲醛(新蒸),
苯甲醛(新蒸),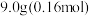 氢氧化钾,乙醚,
氢氧化钾,乙醚, 碳酸钠溶液,浓盐酸。
碳酸钠溶液,浓盐酸。【资料】
乙醚的密度为
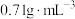 ,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
,乙醚沸点为34.5℃。苯甲醛沸点为179℃。【步骤】
①在锥形瓶中将
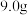 氢氧化钾溶于
氢氧化钾溶于 水配成溶液,冷却至室温后,加入
水配成溶液,冷却至室温后,加入 新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置
新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置 以上。
以上。②向反应混合物中逐滴加入足量的水(约
 ),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用
),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用 乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。③过滤后蒸馏,收集204~206℃的馏分。
④乙醚萃取后的水溶液,用浓盐酸酸化。充分冷却使苯甲酸析出完全,抽滤,如图乙所示。粗产品用水重结晶,得苯甲酸
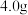 。
。
(1)苯甲醇中最多有
(2)乙醚萃取时分离有机相部分操作如下,正确的先后顺序为
a.振荡,放气 b.加入萃取剂 c.静置、分层 d.分液
(3)乙醚溶液依次用饱和
 溶液、
溶液、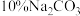 溶液洗涤,其目的依次是
溶液洗涤,其目的依次是(4)乙醚萃取后的水溶液,用浓盐酸酸化到中性是否最恰当?
(5)相对普通过滤,利用图乙装置进行抽滤操作的优点主要有
(6)本实验的苯甲酸产率约为___________(填标号)。
A. | B. | C.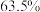 | D. |
更新时间:2024-05-12 15:54:18
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】某NaHCO3样品中含有NaCl杂质,为测定试样中的质量分数,某同学设计了三种方案:
方案一:取5.0g样品溶于水,加入适当指示剂,逐滴滴入1.0mol/L盐酸,待完全反应时,测定所消耗的盐酸的体积。
回答下列问题:
(1)上述测定需配制100ml 1.0mol/L的盐酸;
①若用10mol/L浓盐酸配制溶液,需量取浓盐酸_______ mL。
②配制过程中出现以下情况,所配制溶液浓度偏高的是_______ 。
A.没有洗涤烧杯和玻璃棒
B.如果加水超过了刻度线,取出水使液面恰好到刻度线
C.量取浓盐酸时仰视刻度线
D.定容时俯视刻度线
(2)若测得消耗盐酸的体积为25.0mL,样品中的NaHCO3质量分数为_______ 。
方案二:按下述操作流程进行测定:
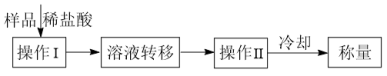
回答下列问题:
(3)操作II的名称是_______ 。
(4)流程中称量的是_______ 质量(填化学式)。
方案一:取5.0g样品溶于水,加入适当指示剂,逐滴滴入1.0mol/L盐酸,待完全反应时,测定所消耗的盐酸的体积。
回答下列问题:
(1)上述测定需配制100ml 1.0mol/L的盐酸;
①若用10mol/L浓盐酸配制溶液,需量取浓盐酸
②配制过程中出现以下情况,所配制溶液浓度偏高的是
A.没有洗涤烧杯和玻璃棒
B.如果加水超过了刻度线,取出水使液面恰好到刻度线
C.量取浓盐酸时仰视刻度线
D.定容时俯视刻度线
(2)若测得消耗盐酸的体积为25.0mL,样品中的NaHCO3质量分数为
方案二:按下述操作流程进行测定:

回答下列问题:
(3)操作II的名称是
(4)流程中称量的是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如右图所示,反应原理为:CH2=CHCOOH+CH3OH → CH2=CHCOOCH3+H2O
可能用到的信息:
制备实验步骤如下:
①取10.0 g丙烯酸和6.0 g甲醇放置于仪器a中,并加入一定量的浓硫酸,连接好冷凝管(b),用搅拌棒搅拌,水浴加热;
②充分反应后,冷却,用分液漏斗(c)向混合液中加入5% Na2CO3溶液至中性;
③取上层油状液体,再用无水Na2SO4处理后蒸馏,收集馏分。

请回答下列问题:
(1)仪器c的名称是_______ 。
(2)水浴加热的优点_______ 。
(3)混合液用5% Na2CO3溶液洗涤的目的是_______ 。
(4)从三颈烧瓶中取出丙烯酸甲酯的实验操作名称是_______ 。
(5)步骤③中加入无水Na2SO4的作用是_______ ,收集_______ ℃左右馏分既得产品。
(6)关于产品的蒸馏操作(夹持装置未画出),上图中有2处错误,请任意写出一处(仅指出错误,无需改正)_______ 。
(7)写出油状物质加入KOH溶液水解的化学方程式_______ 。
可能用到的信息:
| 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 溶解性 | ||
| 丙烯酸 | 71 | 1.05 | 141 | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 32 | 0.79 | 64.7 | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 86 | 0.95 | 80.5 | 难溶于水,易溶于有机溶剂 | 易挥发 |
①取10.0 g丙烯酸和6.0 g甲醇放置于仪器a中,并加入一定量的浓硫酸,连接好冷凝管(b),用搅拌棒搅拌,水浴加热;
②充分反应后,冷却,用分液漏斗(c)向混合液中加入5% Na2CO3溶液至中性;
③取上层油状液体,再用无水Na2SO4处理后蒸馏,收集馏分。

请回答下列问题:
(1)仪器c的名称是
(2)水浴加热的优点
(3)混合液用5% Na2CO3溶液洗涤的目的是
(4)从三颈烧瓶中取出丙烯酸甲酯的实验操作名称是
(5)步骤③中加入无水Na2SO4的作用是
(6)关于产品的蒸馏操作(夹持装置未画出),上图中有2处错误,请任意写出一处(仅指出错误,无需改正)
(7)写出油状物质加入KOH溶液水解的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐3】某合金主要成分为Zn、Fe、Cu,某兴趣小组利用该合金制成的机械零件废弃物,按下列流程制备七水合硫酸锌( )。
)。
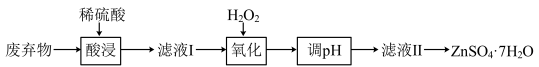
已知: 是常用的氧化剂,通常可以将变价金属离子由低化合价氧化成高化合价;Fe3+会催化
是常用的氧化剂,通常可以将变价金属离子由低化合价氧化成高化合价;Fe3+会催化 分解。
分解。
回答下列问题:
(1)写出“酸浸”过程中Zn发生反应的离子方程式_______ 。
(2)“酸浸”和“调pH”后要把固液分离,所进行的操作是_______ ,在实验室进行这步操作所用到的玻璃仪器有烧杯、玻璃棒和_______ 。
(3) 中氧元素的化合价是
中氧元素的化合价是_______ ,“氧化”时加入的 要足量,原因是
要足量,原因是_______ 。
(4) 在一定温度下完全脱去结晶水,继续升温可分解为ZnO和一种氧化物,该氧化物的化学式是
在一定温度下完全脱去结晶水,继续升温可分解为ZnO和一种氧化物,该氧化物的化学式是_______ 。
 )。
)。
已知:
 是常用的氧化剂,通常可以将变价金属离子由低化合价氧化成高化合价;Fe3+会催化
是常用的氧化剂,通常可以将变价金属离子由低化合价氧化成高化合价;Fe3+会催化 分解。
分解。 回答下列问题:
(1)写出“酸浸”过程中Zn发生反应的离子方程式
(2)“酸浸”和“调pH”后要把固液分离,所进行的操作是
(3)
 中氧元素的化合价是
中氧元素的化合价是 要足量,原因是
要足量,原因是(4)
 在一定温度下完全脱去结晶水,继续升温可分解为ZnO和一种氧化物,该氧化物的化学式是
在一定温度下完全脱去结晶水,继续升温可分解为ZnO和一种氧化物,该氧化物的化学式是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】实验室制备乙酸正丁酯,主要实验步骤如下:
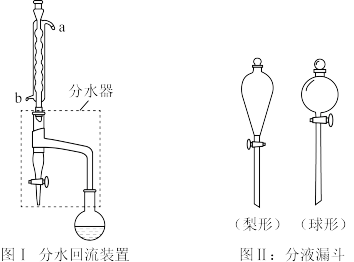
①在干燥的圆底烧瓶中加12mL正丁醇(1-丁醇)、10mL冰醋酸和少许浓H2SO4,摇匀后,加几粒沸石,再如图1装置安装好分水器、冷凝管。然后小火加热。
②将烧瓶中反应后的混和物冷却与分水器中的酯层合并,转入分液漏斗,③依次用10mL水,10mL10%碳酸钠溶液洗至无酸性(pH=7),再水洗一次,用少许无水硫酸镁干燥。④将干燥后的乙酸正丁酯转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品。主要试剂及产物的物理常数:
根据以上信息回答下列问题。
(1)制备乙酸正丁酯的化学方程式为_______ 。
(2)图I装置中冷水应从_______ (填a或b)管口通入,反应混合物冷凝回流。反应过程中会观察到分水器中收集到液体物质,且分为上下两层。随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回烧瓶中。此时,打开分水器下端的旋塞,将下层液体放出少许,分水器中下层液体的主要成分为____ (填物质名称)。
(3)在步骤③分液时,应选择图II装置中____ 形分液漏斗。若将碳酸钠溶液改用氢氧化钠溶液是否可以_______ (填“可以”或“不可以”),其原因____ 。
①在干燥的圆底烧瓶中加12mL正丁醇(1-丁醇)、10mL冰醋酸和少许浓H2SO4,摇匀后,加几粒沸石,再如图1装置安装好分水器、冷凝管。然后小火加热。

②将烧瓶中反应后的混和物冷却与分水器中的酯层合并,转入分液漏斗,③依次用10mL水,10mL10%碳酸钠溶液洗至无酸性(pH=7),再水洗一次,用少许无水硫酸镁干燥。④将干燥后的乙酸正丁酯转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品。主要试剂及产物的物理常数:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g∙cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点(℃) | 118.0 | 118.1 | 126.1 | 142 |
(1)制备乙酸正丁酯的化学方程式为
(2)图I装置中冷水应从
(3)在步骤③分液时,应选择图II装置中
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】《肘后备急方•治寒热诸疟方》中记载“青蒿一握,以水二升渍,绞取汁,尽服之”。我国科学家屠呦呦受此启发,成功提取了青蒿素,获得了2015年诺贝尔生理学或医学奖。
已知:①青蒿素可溶于乙醇(分子式为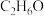 )、乙醚,难溶于水,受热不稳定;
)、乙醚,难溶于水,受热不稳定;
②不同物质的沸点:
(1)上述水、乙醇、乙醚三种物质中,属于电解质是_______ ,属于非电解质的是_______ 。
(2)实验室酒精灯燃烧时发生反应的化学方程式:_______ 。
(3)选择萃取青蒿素的试剂是_______ ﹐你选择的理由是_______ 。
(4)为了加快青蒿素的浸出速率,可采取的措施_______ 。
(5)根据青蒿素的性质,请以黄花蒿(黄花蒿是一种含有青蒿素的植物)为原料,设计一个合理提取青蒿素的实验方案___________ 。
已知:①青蒿素可溶于乙醇(分子式为
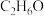 )、乙醚,难溶于水,受热不稳定;
)、乙醚,难溶于水,受热不稳定;②不同物质的沸点:
| 物质 | 水 | 乙醇 | 乙醚 |
| 沸点/℃ | 100 | 78.3 | 34.6 |
(2)实验室酒精灯燃烧时发生反应的化学方程式:
(3)选择萃取青蒿素的试剂是
(4)为了加快青蒿素的浸出速率,可采取的措施
(5)根据青蒿素的性质,请以黄花蒿(黄花蒿是一种含有青蒿素的植物)为原料,设计一个合理提取青蒿素的实验方案
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】1,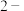 二氯乙烷是一种常用的溶剂,其沸点为
二氯乙烷是一种常用的溶剂,其沸点为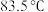 ,熔点为
,熔点为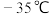 。实验室用乙烯和氯气制备该物质粗产品的装置(加热及夹持装置略)如图所示。
。实验室用乙烯和氯气制备该物质粗产品的装置(加热及夹持装置略)如图所示。
(1)装置A中发生主要反应的化学方程式为_______ 。A中还缺少的一种必需实验仪器是_______ 。
(2)装置B中的试剂是_______ ,其长导管的作用是_______ 。
(3)判断反应结束的现象是_______ 。
(4)酱油中 测定时需用到1,
测定时需用到1,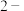 二氯乙烷。测定步骤如下:
二氯乙烷。测定步骤如下:
取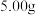 酱油,配成
酱油,配成 溶液,取出
溶液,取出 ,加入适量稀硝酸,再加入过量
,加入适量稀硝酸,再加入过量 的硝酸银溶液,摇匀充分反应后加入
的硝酸银溶液,摇匀充分反应后加入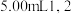 -二氯乙烷,再充分振荡摇匀,使1,
-二氯乙烷,再充分振荡摇匀,使1,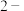 二氯乙烷完全包
二氯乙烷完全包 氯化银。最后加入几滴铁铵矾
氯化银。最后加入几滴铁铵矾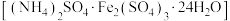 指示剂,用
指示剂,用 的
的 溶液滴定至溶液为浅红色。做三次平行试验,平均消耗
溶液滴定至溶液为浅红色。做三次平行试验,平均消耗 溶液
溶液 。[已知
。[已知 ,
, ]。
]。
① 该酱油样品含
该酱油样品含 的质量是
的质量是_______ g。
②若1, 二氯乙烷未完全包裹
二氯乙烷未完全包裹 ,则
,则 的测定值
的测定值_______ (填“偏高”“偏低”或“无影响”)。
 二氯乙烷是一种常用的溶剂,其沸点为
二氯乙烷是一种常用的溶剂,其沸点为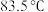 ,熔点为
,熔点为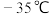 。实验室用乙烯和氯气制备该物质粗产品的装置(加热及夹持装置略)如图所示。
。实验室用乙烯和氯气制备该物质粗产品的装置(加热及夹持装置略)如图所示。
(1)装置A中发生主要反应的化学方程式为
(2)装置B中的试剂是
(3)判断反应结束的现象是
(4)酱油中
 测定时需用到1,
测定时需用到1,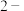 二氯乙烷。测定步骤如下:
二氯乙烷。测定步骤如下:取
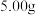 酱油,配成
酱油,配成 溶液,取出
溶液,取出 ,加入适量稀硝酸,再加入过量
,加入适量稀硝酸,再加入过量 的硝酸银溶液,摇匀充分反应后加入
的硝酸银溶液,摇匀充分反应后加入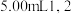 -二氯乙烷,再充分振荡摇匀,使1,
-二氯乙烷,再充分振荡摇匀,使1,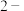 二氯乙烷完全包
二氯乙烷完全包 氯化银。最后加入几滴铁铵矾
氯化银。最后加入几滴铁铵矾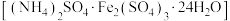 指示剂,用
指示剂,用 的
的 溶液滴定至溶液为浅红色。做三次平行试验,平均消耗
溶液滴定至溶液为浅红色。做三次平行试验,平均消耗 溶液
溶液 。[已知
。[已知 ,
, ]。
]。①
 该酱油样品含
该酱油样品含 的质量是
的质量是②若1,
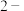 二氯乙烷未完全包裹
二氯乙烷未完全包裹 ,则
,则 的测定值
的测定值
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】已知苯与液溴在溴化铁的催化作用下可以发生反应生成溴苯。某化学课外小组用如图所示装置制取溴苯并证明苯与溴发生的是取代反应。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。已知溴可溶于溴苯中。
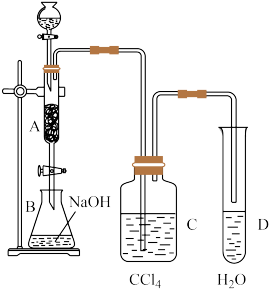
(1)写出A中反应的化学方程式:_______________ 。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________ ,写出有关的化学方程式__________________ 。
(3)实验时可观察到A中发生剧烈反应,反应液沸腾且有红棕色气体产生并充满A容器,说明苯与溴的反应是_______________ 反应(填“放热”或“吸热”)。
(4)向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明苯和溴发生的是取代反应而不是加成反应。另一种证明方法是向试管D中加入______________________ ,现象是________________ 。

(1)写出A中反应的化学方程式:
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是
(3)实验时可观察到A中发生剧烈反应,反应液沸腾且有红棕色气体产生并充满A容器,说明苯与溴的反应是
(4)向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明苯和溴发生的是取代反应而不是加成反应。另一种证明方法是向试管D中加入
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】溴苯是医药、染料和材料领域常用的有机合成原料。某实验小组设计如下实验来制取、提纯溴苯, 并探究该制备反应的反应类型。 (实验装置图如下)
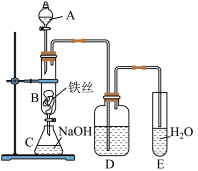
先向A中加入苯和液溴,再将混合液慢慢滴入反应器 B(B下端活塞关闭)中。实验开始后,观察到B中液体处于微沸状态。
(1)仪器A的名称是___________________ 。
(2)实验结束时,打开B下端的活塞,让反应液流入C中,充分振荡,目的是____ 。然后从C中分离出溴苯的方法是_______________________ 。
(3)D中盛装的试剂是___________________ 。
(4)向试管E中加入AgNO3溶液,产生淡黄色沉淀,则证明苯和液溴发生的反应类型是__________ ,写出B中反应的化学方程式___________________________ 。

先向A中加入苯和液溴,再将混合液慢慢滴入反应器 B(B下端活塞关闭)中。实验开始后,观察到B中液体处于微沸状态。
(1)仪器A的名称是
(2)实验结束时,打开B下端的活塞,让反应液流入C中,充分振荡,目的是
(3)D中盛装的试剂是
(4)向试管E中加入AgNO3溶液,产生淡黄色沉淀,则证明苯和液溴发生的反应类型是
您最近一年使用:0次