一种回收锌电解阳极泥(生要成分为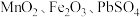 和
和 ,还有少量猛铅氧化物
,还有少量猛铅氧化物 和
和 )中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
② 时,
时,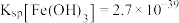
③在较高温度及酸性催化条件下,葡萄糖能发生如下反应: 的最外层电子的电子排布式为
的最外层电子的电子排布式为_______ 。
(2)“还原酸浸”过程中主要反应的化学方程式为_______ ;实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是_______ 。
(3)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是_______ ,用_______ (填物质的名称)洗涤、干澡。 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为_______ 。
(5)整个流程中可循环利用的物质是_______ 。
(6)取“沉铁”操作所得的沉淀物置于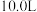 水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有
水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有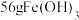 ,最终所得溶液中
,最终所得溶液中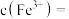
_______  。
。
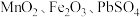 和
和 ,还有少量猛铅氧化物
,还有少量猛铅氧化物 和
和 )中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: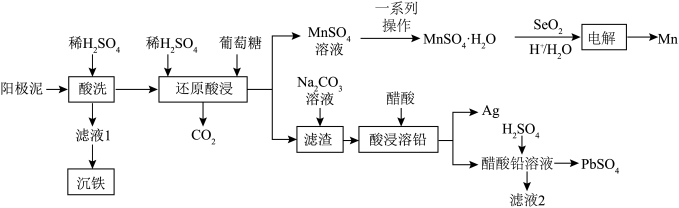
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。②
 时,
时,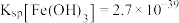
③在较高温度及酸性催化条件下,葡萄糖能发生如下反应:
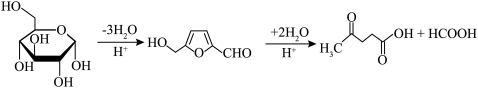
 的最外层电子的电子排布式为
的最外层电子的电子排布式为(2)“还原酸浸”过程中主要反应的化学方程式为
(3)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是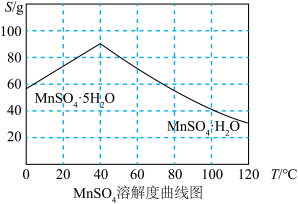
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为(5)整个流程中可循环利用的物质是
(6)取“沉铁”操作所得的沉淀物置于
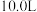 水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有
水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有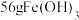 ,最终所得溶液中
,最终所得溶液中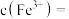
 。
。
更新时间:2024-05-19 21:57:21
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】水钴矿的主要成分为Co2O3,还含SiO2及少量Al2O3、Fe2O3、 CuO、MnO2等。一种利用水钴矿制取CoCl2·6H2O 的工艺流程如下:
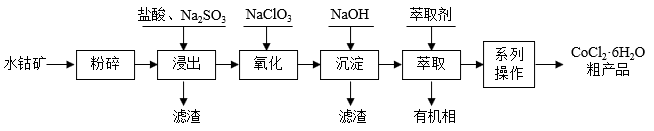
已知: ①CoCl2·6H2O受热易失去结晶水。
②25 ℃时,设定溶液中某金属离子初始浓度为0.1 mol•L-1,部分沉淀的参考数据如下表(“沉淀完全”指溶液中该离子浓度≤1.0×10-5mol•L-1):
回答下列问题
(1)计算25℃时Co(OH)2的Ksp =_______________ 。
(2)浸出工序中加入一定量的Na2SO3还原Co2O3、MnO2等,Co2O3发生反应的离子方程式为_______________________________ 。
(3)氧化工序要控制NaClO3用量,若不慎加入过量NaClO3,可能生成的有毒气体是______________ ;氧化工序主要反应的离子方程式为_______________________________ 。
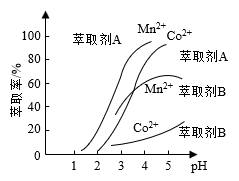
(4)已知温度对铜、钴、铁的浸出率的影响如左下图,萃取剂A、B中pH对钴、锰离子萃取率的影响如右下图:
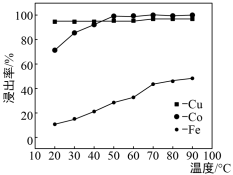
①浸出温度控制在50-60℃的原因是_________________________ 。
②应选择萃取剂_________________________ (填“A”或“B”)。
(5)“系列操作”依次是____________ 、______________ 和过滤等;制得的CoCl2·6H2O需减压烘干的原因是_________________________ 。

已知: ①CoCl2·6H2O受热易失去结晶水。
②25 ℃时,设定溶液中某金属离子初始浓度为0.1 mol•L-1,部分沉淀的参考数据如下表(“沉淀完全”指溶液中该离子浓度≤1.0×10-5mol•L-1):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.4 | 1.5 | 6.3 | 7.0 | 4.7 | 8.1 |
| 沉淀完全时pH | 4.7 | 2.8 | 8.3 | 9.0 | 6.7 | 10.1 |
回答下列问题
(1)计算25℃时Co(OH)2的Ksp =
(2)浸出工序中加入一定量的Na2SO3还原Co2O3、MnO2等,Co2O3发生反应的离子方程式为
(3)氧化工序要控制NaClO3用量,若不慎加入过量NaClO3,可能生成的有毒气体是
(4)已知温度对铜、钴、铁的浸出率的影响如左下图,萃取剂A、B中pH对钴、锰离子萃取率的影响如右下图:


①浸出温度控制在50-60℃的原因是
②应选择萃取剂
(5)“系列操作”依次是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
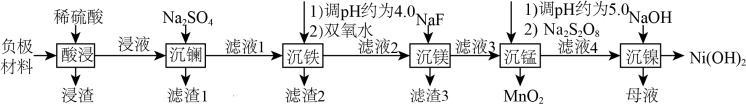
【推荐2】氢镍电池是目前使用最广的含镍电池,废旧电池的处理对环境保护和资源的再利用意义重大。一种对废旧氢镍电池负极材料(含有NiO、Ni和少量La、Fe、Mg、MnO2、石墨粉等)进行湿法处理的流程如图所示:
②Ksp(MgF2)=6.4 ;
;
③H2SO4第一步完全电离,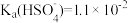 。
。
回答下列问题:
(1)Ni2+的价层电子排布式为_____________ 。
(2)能提高“酸浸”效率的措施有_____________ (任写一种)。
(3)若滤渣1的成分为 ,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因
,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因_________________ 。
(5)“沉镁”后滤液3中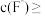
__________  (溶液中离子浓度
(溶液中离子浓度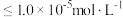 时认为该离子沉淀完全)。
时认为该离子沉淀完全)。
(6) 中存在过氧键(-O-O-),“沉锰”反应的离子方程式为
中存在过氧键(-O-O-),“沉锰”反应的离子方程式为_________________ 。
(7)“沉镍”所用试剂不宜选用氨水的原因为_________________ ,母液中可提取出的循环利用的物质为_____________ (填化学式)。
②Ksp(MgF2)=6.4
 ;
;③H2SO4第一步完全电离,
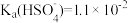 。
。回答下列问题:
(1)Ni2+的价层电子排布式为
(2)能提高“酸浸”效率的措施有
(3)若滤渣1的成分为
 ,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因
,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因 
| A.KSCN溶液 |
| B.K3[Fe(CN)6]溶液 |
| C.NaOH溶液 |
| D.KSCN溶液和氯水 |
(5)“沉镁”后滤液3中
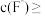
 (溶液中离子浓度
(溶液中离子浓度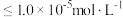 时认为该离子沉淀完全)。
时认为该离子沉淀完全)。(6)
 中存在过氧键(-O-O-),“沉锰”反应的离子方程式为
中存在过氧键(-O-O-),“沉锰”反应的离子方程式为(7)“沉镍”所用试剂不宜选用氨水的原因为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】钴是航空、军事和机械工业中不可或缺的金属,一种从含钴废料(主要含钴、钡、钛的化合物)中提取金属钴的工艺流程如下: 的溶度积常数分别为
的溶度积常数分别为 。
。
回答下列问题:
(1)晶体钴中钴原子的堆积方式如图所示,钴原子的配位数为____________ 。 的难溶物外,还有
的难溶物外,还有____________ (填化学式),此工序中浸出温度与 浸出率的关系如图所示,综合考虑成本和浸出率,选择的最佳浸出温度为
浸出率的关系如图所示,综合考虑成本和浸出率,选择的最佳浸出温度为____________  ;此温度下,还能提高酸浸效果的措施为
;此温度下,还能提高酸浸效果的措施为____________ 。 生成
生成 的离子方程式为
的离子方程式为____________ 。
(4)获得纯净碱式碳酸钴 的“系列操作”具体是指
的“系列操作”具体是指____________ 。室温下,沉钴所得母液中 时,溶液中的
时,溶液中的 为
为____________ 。
(5)资料表明:离子在电极上的放电顺序和电压有关,电压增大,放电顺序靠后的离子也可以参与电极反应。用惰性电极电解 溶液可得到钴单质,实际生产中发现电解相同时间,钴的产率随电压的变化如图所示。当电压超过
溶液可得到钴单质,实际生产中发现电解相同时间,钴的产率随电压的变化如图所示。当电压超过 时,钴的产率降低的原因可能是
时,钴的产率降低的原因可能是____________ 。
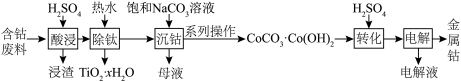
 的溶度积常数分别为
的溶度积常数分别为 。
。回答下列问题:
(1)晶体钴中钴原子的堆积方式如图所示,钴原子的配位数为
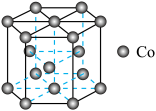
 的难溶物外,还有
的难溶物外,还有 浸出率的关系如图所示,综合考虑成本和浸出率,选择的最佳浸出温度为
浸出率的关系如图所示,综合考虑成本和浸出率,选择的最佳浸出温度为 ;此温度下,还能提高酸浸效果的措施为
;此温度下,还能提高酸浸效果的措施为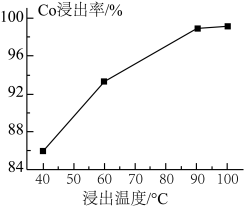
 生成
生成 的离子方程式为
的离子方程式为(4)获得纯净碱式碳酸钴
 的“系列操作”具体是指
的“系列操作”具体是指 时,溶液中的
时,溶液中的 为
为(5)资料表明:离子在电极上的放电顺序和电压有关,电压增大,放电顺序靠后的离子也可以参与电极反应。用惰性电极电解
 溶液可得到钴单质,实际生产中发现电解相同时间,钴的产率随电压的变化如图所示。当电压超过
溶液可得到钴单质,实际生产中发现电解相同时间,钴的产率随电压的变化如图所示。当电压超过 时,钴的产率降低的原因可能是
时,钴的产率降低的原因可能是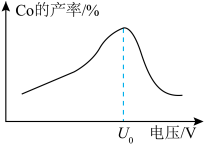
您最近一年使用:0次
【推荐1】丙烯是重要的有机合成原料。由丙烷制备丙烯是近年研究的热点,主要涉及如下反应:
反应Ⅰ:2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1
2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1
反应Ⅱ:2C3H8(g)+7O2(g) 6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1
6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1
回答下列问题:
(1)反应2C3H6(g)+6O2(g) 6CO(g)+6H2O(g)的ΔH=
6CO(g)+6H2O(g)的ΔH=___________ 。
(2)在刚性绝热容器中发生反应Ⅰ,下列叙述能说明反应已达到平衡状态的是___________(填标号)。
(3)在压强恒定为100 kPa条件下,将n(C3H8) n(O2)=2
n(O2)=2 1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
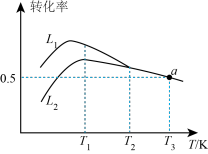
①曲线___________ (填“L1”或“L2”)表示丙烷的转化率。
②温度高于T1 K后曲线L2随温度升高而降低的原因为___________ 。
③当温度高于___________ (填“T1”或“T2”)时,反应Ⅱ不再发生,a点对应的温度下,丙烯的分压 p(C3H6) =___________ kPa(保留3位有效数字),反应I的标准平衡常数 Kθ=___________ (已知:分压=总压×该组分物质的量分数,对于反应:dD(g)+eE(g) gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ=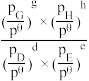 ;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
(4)在“碳中和”实施过程中,可将工业生产中产生的CO2气体通过如图所示的电解原理转化成重要的有机物,阴极的电极反应式为___________ 。
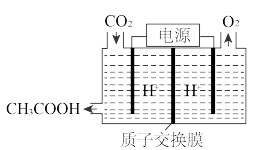
反应Ⅰ:2C3H8(g)+O2(g)
 2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1
2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1反应Ⅱ:2C3H8(g)+7O2(g)
 6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1
6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1回答下列问题:
(1)反应2C3H6(g)+6O2(g)
 6CO(g)+6H2O(g)的ΔH=
6CO(g)+6H2O(g)的ΔH=(2)在刚性绝热容器中发生反应Ⅰ,下列叙述能说明反应已达到平衡状态的是___________(填标号)。
| A.每断裂1 mol O=O键,同时生成4 mol O-H键 | B.容器内温度不再变化 |
| C.混合气体的密度不再变化 | D.n(C3H8) = n(C3H6) |
(3)在压强恒定为100 kPa条件下,将n(C3H8)
 n(O2)=2
n(O2)=2 1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
①曲线
②温度高于T1 K后曲线L2随温度升高而降低的原因为
③当温度高于
 gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ=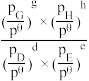 ;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。(4)在“碳中和”实施过程中,可将工业生产中产生的CO2气体通过如图所示的电解原理转化成重要的有机物,阴极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】2020年9月,习近平主席在第75届联合国大会提出我国要实现2030年碳达峰、2060年碳中和的目标。因此CO2的捕获、利用与封存成为科学家研究的重要课题。
I.研究表明CO2(g)和CH4(g)在催化剂存在下可发生反应制得合成气:
CO2(g)+CH4(g)⇌2CO(g)+2H2(g) ΔH1
(1)已知CH4(g)、CO(g)和H2(g)的燃烧焓(ΔH)分别为-890.3、-283.0和-285.8kJ·mol-1。则上述反应的焓变ΔH1=___________ kJ·mol-1。
(2)将原料按n(CH4):n(CO2)=1:1充入密闭容器中,保持体系压强为100kPa发生反应,达到平衡时CO2体积分数与温度的关系(图中黑线)如图所示。
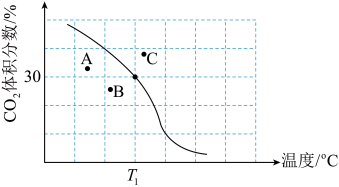
①T1℃、100kPa下,平衡时容器体积与初始容器体积之比为___________ ;该温度下,此反应的平衡常数Kp=___________ (kPa)2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②若A、B、C三点表示不同温度和压强下已达平衡时CO2的体积分数,___________ 点对应的平衡常数最小,___________ 点对应的压强最大。
(3)在其他条件相同,不同催化剂(A、B)作用下,使原料CO2(g)和CH4(g)反应相同的时间,CO(g)的产率随反应温度的变化如图:

①在催化剂A、B作用下,它们正、逆反应活化能差值分别用ΔEa(A)和ΔEa(B)表示,则ΔEa(A)_______ ΔEa(B)(选填“>”“<”或“=”)。
②y点对应的逆反应速率v(逆)___________ z点对应的正反应速率v(正)(选填“>”、“<”或“=”)。
II、以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示。电解所用电极材料均为惰性电极。
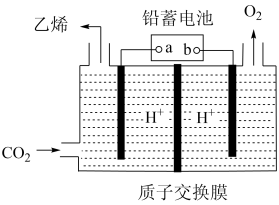
(4)阴极上的电极反应式为___________ 。
(5)每生成0.5mol乙烯,理论上需消耗铅蓄电池中___________ mol硫酸。
I.研究表明CO2(g)和CH4(g)在催化剂存在下可发生反应制得合成气:
CO2(g)+CH4(g)⇌2CO(g)+2H2(g) ΔH1
(1)已知CH4(g)、CO(g)和H2(g)的燃烧焓(ΔH)分别为-890.3、-283.0和-285.8kJ·mol-1。则上述反应的焓变ΔH1=
(2)将原料按n(CH4):n(CO2)=1:1充入密闭容器中,保持体系压强为100kPa发生反应,达到平衡时CO2体积分数与温度的关系(图中黑线)如图所示。

①T1℃、100kPa下,平衡时容器体积与初始容器体积之比为
②若A、B、C三点表示不同温度和压强下已达平衡时CO2的体积分数,
(3)在其他条件相同,不同催化剂(A、B)作用下,使原料CO2(g)和CH4(g)反应相同的时间,CO(g)的产率随反应温度的变化如图:

①在催化剂A、B作用下,它们正、逆反应活化能差值分别用ΔEa(A)和ΔEa(B)表示,则ΔEa(A)
②y点对应的逆反应速率v(逆)
II、以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示。电解所用电极材料均为惰性电极。

(4)阴极上的电极反应式为
(5)每生成0.5mol乙烯,理论上需消耗铅蓄电池中
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】以黄铜矿(主要成分为 )为原料,用
)为原料,用 溶液作浸取剂提取铜。
溶液作浸取剂提取铜。 均能导电。
均能导电。
(1) 有强氧化性,用
有强氧化性,用 溶液作浸取剂浸出
溶液作浸取剂浸出 的原理示意图如下。
的原理示意图如下。______ 。
②浸取初期,随着浸泡时间延长, 的浸出速率提高。可能的原因是
的浸出速率提高。可能的原因是______ 。
(2)在足量 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:
①结合离子方程式解释添加 可以显著提高
可以显著提高 元素的浸出率的原因:
元素的浸出率的原因:______ 。
②进一步研究发现添加的少量 可以多次循环使用,具有类似“催化剂”的作用。其中
可以多次循环使用,具有类似“催化剂”的作用。其中 “再生”的离子方程式为:
“再生”的离子方程式为:______ 。
(3)进一步从浸出液中提取铜并使 再生的流程示意图如下。
再生的流程示意图如下。 得到铁红,反应的化学方程式为
得到铁红,反应的化学方程式为______ 。
②由滤液B电解(Pt作电极)生成 的总反应的离子方程式为
的总反应的离子方程式为______ ;
③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:______ 。
 )为原料,用
)为原料,用 溶液作浸取剂提取铜。
溶液作浸取剂提取铜。已知:ⅰ.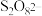 的结构式为
的结构式为 。
。
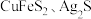 均能导电。
均能导电。(1)
 有强氧化性,用
有强氧化性,用 溶液作浸取剂浸出
溶液作浸取剂浸出 的原理示意图如下。
的原理示意图如下。
②浸取初期,随着浸泡时间延长,
 的浸出速率提高。可能的原因是
的浸出速率提高。可能的原因是(2)在足量
 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:添加 | 未加 | |
 元素的浸出率 元素的浸出率 | 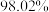 | 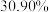 |
| 过程中产物形态 |
|
|
 可以显著提高
可以显著提高 元素的浸出率的原因:
元素的浸出率的原因:②进一步研究发现添加的少量
 可以多次循环使用,具有类似“催化剂”的作用。其中
可以多次循环使用,具有类似“催化剂”的作用。其中 “再生”的离子方程式为:
“再生”的离子方程式为:(3)进一步从浸出液中提取铜并使
 再生的流程示意图如下。
再生的流程示意图如下。
 得到铁红,反应的化学方程式为
得到铁红,反应的化学方程式为②由滤液B电解(Pt作电极)生成
 的总反应的离子方程式为
的总反应的离子方程式为③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2• 3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
(1)①仪器c的名称是_________________ 。
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞_________ (选填“a”、“b”或“a 和 b”)。
(2)装置A中Cu(NO3)2• 3H2O和SOC12发生反应的化学方程式是________________ 。
(3)装置B的作用是________________ 。
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2• 3H2O的实验方案如下:

已知几种离子生成氢氧化物沉淀的pH如下表
①步骤I中所用稀HNO3稍过量的目的是_____________ 。
②请补充完整由溶液I制备Cu(NO3)2• 3H2O晶体的实验方案:
向溶液I中加入__________ ,冰水洗涤得到Cu(NO3)2• 3H2O晶体。
 .
.
(1)①仪器c的名称是
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞
(2)装置A中Cu(NO3)2• 3H2O和SOC12发生反应的化学方程式是
(3)装置B的作用是
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2• 3H2O的实验方案如下:

已知几种离子生成氢氧化物沉淀的pH如下表
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
①步骤I中所用稀HNO3稍过量的目的是
②请补充完整由溶液I制备Cu(NO3)2• 3H2O晶体的实验方案:
向溶液I中加入
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】叠氮化钠( )为无色六角结晶性粉末,主要用于制造炸药、安全气囊。某化学探究小组拟在实验室中利用如图装置制取叠氮化钠。
)为无色六角结晶性粉末,主要用于制造炸药、安全气囊。某化学探究小组拟在实验室中利用如图装置制取叠氮化钠。
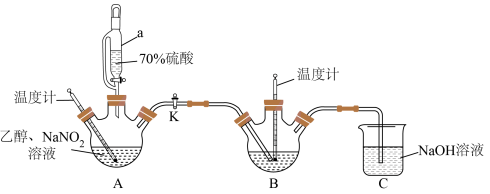
I.实验操作:
①向装置A的三颈烧瓶中加入乙醇20g、亚硝酸钠40g、水60g后,混合均匀;
②将装置A的三颈烧瓶中的混合液体加热到35℃左右,控制滴入70%硫酸的速率;
③在装置B的三颈烧瓶中预装由水合肼( )、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(
)、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(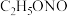 )进入装置B中,控制温度在80℃左右,持续加热40min。
)进入装置B中,控制温度在80℃左右,持续加热40min。
Ⅱ.部分药品的性质如下表:
已知: 。
。
回答下列问题:
(1)仪器a的名称为_______ 。
(2)对装置B中液体进行加热,合适的加热方式为_______ 。
(3)装置A保持温度35℃左右的原因是_______ 。
(4)装置B中水合肼、亚硝酸乙酯和氢氧化钠在80℃左右反应生成叠氮化钠、乙醇等物质,该反应的化学方程式为_______ 。
(5)产品的分离:将装置B中反应后的混合液倒入蒸馏烧瓶中,加热到80~90℃,除去混合物中的乙醇。将蒸馏后所得母液通过_______ (一系列的实验操作)得到叠氮化钠产品。叠氮化钠在不同温度及溶剂中的溶解度如图所示。

(6)叠氮化钠有毒,可以使用次氯酸钠溶液销毁容器中残留的叠氮化钠,反应后碱性明显增强,产生无色无味的无毒气体,写出离子方程式:_______ 。
(7)产品纯度测定:取6.0g产品,加入足量蒸馏水溶解,向溶液中加入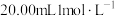 酸化的
酸化的 溶液(
溶液( ),反应后溶液呈紫红色。再用
),反应后溶液呈紫红色。再用 的
的 标准液滴定过量的
标准液滴定过量的 溶液,到达滴定终点时消耗标准液25.00mL
溶液,到达滴定终点时消耗标准液25.00mL
①叠氮化钠的纯度为_______ 。(保留小数点后1位)
②若用 标准液滴定时,开始时尖嘴处充满溶液,结束时出现气泡,其他操作及读数均正确,则测得样品中叠氮化钠的纯度
标准液滴定时,开始时尖嘴处充满溶液,结束时出现气泡,其他操作及读数均正确,则测得样品中叠氮化钠的纯度_______ (填“偏大”“偏小”或“无影响)。
 )为无色六角结晶性粉末,主要用于制造炸药、安全气囊。某化学探究小组拟在实验室中利用如图装置制取叠氮化钠。
)为无色六角结晶性粉末,主要用于制造炸药、安全气囊。某化学探究小组拟在实验室中利用如图装置制取叠氮化钠。
I.实验操作:
①向装置A的三颈烧瓶中加入乙醇20g、亚硝酸钠40g、水60g后,混合均匀;
②将装置A的三颈烧瓶中的混合液体加热到35℃左右,控制滴入70%硫酸的速率;
③在装置B的三颈烧瓶中预装由水合肼(
 )、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(
)、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(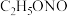 )进入装置B中,控制温度在80℃左右,持续加热40min。
)进入装置B中,控制温度在80℃左右,持续加热40min。Ⅱ.部分药品的性质如下表:
| 物质 | 密度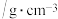 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 乙醇 | 0.816 | 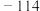 | 78.3 | 与水以任意比例互溶,可与醚、氯仿、丙酮混溶 |
| 亚硝酸乙酯 | 0.90 | 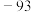 | 17.2 | 不溶于水,可溶于乙醇、乙醚 |
| 叠氮化钠 | 1.85 | 275 | 300 | 易溶于水和液氨,微溶于乙醇,不溶于乙醚 |
 。
。回答下列问题:
(1)仪器a的名称为
(2)对装置B中液体进行加热,合适的加热方式为
(3)装置A保持温度35℃左右的原因是
(4)装置B中水合肼、亚硝酸乙酯和氢氧化钠在80℃左右反应生成叠氮化钠、乙醇等物质,该反应的化学方程式为
(5)产品的分离:将装置B中反应后的混合液倒入蒸馏烧瓶中,加热到80~90℃,除去混合物中的乙醇。将蒸馏后所得母液通过

(6)叠氮化钠有毒,可以使用次氯酸钠溶液销毁容器中残留的叠氮化钠,反应后碱性明显增强,产生无色无味的无毒气体,写出离子方程式:
(7)产品纯度测定:取6.0g产品,加入足量蒸馏水溶解,向溶液中加入
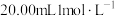 酸化的
酸化的 溶液(
溶液( ),反应后溶液呈紫红色。再用
),反应后溶液呈紫红色。再用 的
的 标准液滴定过量的
标准液滴定过量的 溶液,到达滴定终点时消耗标准液25.00mL
溶液,到达滴定终点时消耗标准液25.00mL①叠氮化钠的纯度为
②若用
 标准液滴定时,开始时尖嘴处充满溶液,结束时出现气泡,其他操作及读数均正确,则测得样品中叠氮化钠的纯度
标准液滴定时,开始时尖嘴处充满溶液,结束时出现气泡,其他操作及读数均正确,则测得样品中叠氮化钠的纯度
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
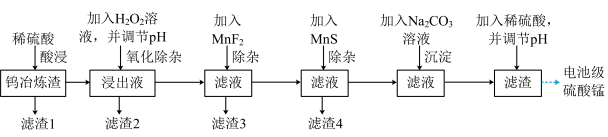
【推荐3】钨在自然界的储量只有620万吨,江西独占有520万吨。江西每年产生大量的钨冶炼渣(主要含 的氧化物以及少量重金属氧化物等),以钨冶炼渣为原料,提炼制备电池级硫酸锰的工艺流程如下:
的氧化物以及少量重金属氧化物等),以钨冶炼渣为原料,提炼制备电池级硫酸锰的工艺流程如下:
已知①溶液中金属离子的物质的量浓度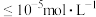 时可以看成沉淀完全,
时可以看成沉淀完全, 。
。
② 易被空气中的氧气氧化生成
易被空气中的氧气氧化生成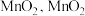 一般难溶于酸溶液。
一般难溶于酸溶液。
(1)“酸浸”时,为提高锰的浸出率,可采取的措施是_______ (写一种即可),滤渣1的主要成分为 、
、_______ (填化学式)。
(2)酸浸后所得浸出液中金属阳离子包括 ,写出生成
,写出生成 的离子方程式
的离子方程式_______ 。
(3)浸出液加入 需要过量的原因
需要过量的原因_______ 。若要使 和
和 沉淀完全,则需调节溶液的
沉淀完全,则需调节溶液的 最小值为
最小值为_______ 。
(4)滤渣3的主要成分是 和
和_______ 。
(5)加 的目的是
的目的是_______ 。
(6)分批加入 溶液的原因是
溶液的原因是_______ 。
(7)如图为 溶解度曲线。从
溶解度曲线。从 溶液中提取
溶液中提取 晶体的操作为
晶体的操作为_______ ,洗涤,干燥,碾磨,即得到了电池级硫酸锰。

 的氧化物以及少量重金属氧化物等),以钨冶炼渣为原料,提炼制备电池级硫酸锰的工艺流程如下:
的氧化物以及少量重金属氧化物等),以钨冶炼渣为原料,提炼制备电池级硫酸锰的工艺流程如下:
已知①溶液中金属离子的物质的量浓度
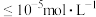 时可以看成沉淀完全,
时可以看成沉淀完全, 。
。②
 易被空气中的氧气氧化生成
易被空气中的氧气氧化生成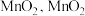 一般难溶于酸溶液。
一般难溶于酸溶液。(1)“酸浸”时,为提高锰的浸出率,可采取的措施是
 、
、(2)酸浸后所得浸出液中金属阳离子包括
 ,写出生成
,写出生成 的离子方程式
的离子方程式(3)浸出液加入
 需要过量的原因
需要过量的原因 和
和 沉淀完全,则需调节溶液的
沉淀完全,则需调节溶液的 最小值为
最小值为(4)滤渣3的主要成分是
 和
和(5)加
 的目的是
的目的是(6)分批加入
 溶液的原因是
溶液的原因是(7)如图为
 溶解度曲线。从
溶解度曲线。从 溶液中提取
溶液中提取 晶体的操作为
晶体的操作为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】用油造气的废镍催化剂(含NiCO3、Na2SiO3、少量Fe2+、Fe3+及Cr3+的化合物)制取NiSO4•7H2O的工艺流程如图所示(CTAC一种硅酸胶体凝聚剂)。回答下列问题:
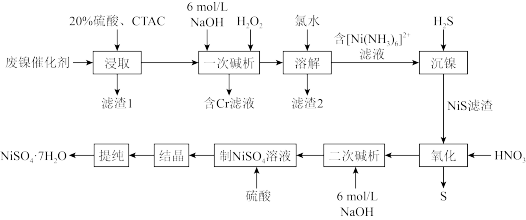
(1)“浸取”时,在硫酸浓度和用量、溶解时温度、搅拌速率均一定时,提高镍的回收率还可采取的措施是___ (写出一条)。
(2)“滤渣1”的主要成分是__ 。
(3)“一次碱析”时,Cr(OH)3转化为的CrO 的离子方程式为
的离子方程式为___ 。
(4)加氨水“溶解”的目的是__ ,‘滤渣2”的主要成分是__ 。
(5)“氧化”时,HNO3被还原为NO,该反应的化学方程式为__ 。

(1)“浸取”时,在硫酸浓度和用量、溶解时温度、搅拌速率均一定时,提高镍的回收率还可采取的措施是
(2)“滤渣1”的主要成分是
(3)“一次碱析”时,Cr(OH)3转化为的CrO
 的离子方程式为
的离子方程式为(4)加氨水“溶解”的目的是
(5)“氧化”时,HNO3被还原为NO,该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产Al(OH)3并获得Fe3O4的部分工艺流程如图:

(1)焙烧过程均会产生SO2,用于吸收SO2的试剂可以是______ 。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。

已知:多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1− )×100%
)×100%
①500℃焙烧(不添加CaO的矿粉)时,去除的硫元素主要来源于______ 。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低的主要原因是______ 。
(3)向含大量AlO2-的滤液中通入过量CO2,得到Al(OH)3白色沉淀,发生该反应的离子方程式为______ 。
(4)FeS2与滤渣中Fe2O3在缺氧条件下焙烧生成Fe3O4和SO2,理论上1molFeS2完全参与反应生成的Fe3O4的物质的量为______ mol。

(1)焙烧过程均会产生SO2,用于吸收SO2的试剂可以是
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。

已知:多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1−
 )×100%
)×100%①500℃焙烧(不添加CaO的矿粉)时,去除的硫元素主要来源于
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低的主要原因是
(3)向含大量AlO2-的滤液中通入过量CO2,得到Al(OH)3白色沉淀,发生该反应的离子方程式为
(4)FeS2与滤渣中Fe2O3在缺氧条件下焙烧生成Fe3O4和SO2,理论上1molFeS2完全参与反应生成的Fe3O4的物质的量为
您最近一年使用:0次
【推荐3】酒精检测仪中常装的重铬酸钾( )溶液来源于铬铁矿(主要成分为难溶于水的亚铬酸亚铁
)溶液来源于铬铁矿(主要成分为难溶于水的亚铬酸亚铁 ,还含有
,还含有 和少量的难溶于水和碱溶液的杂质),其制备过程如图所示:
和少量的难溶于水和碱溶液的杂质),其制备过程如图所示:

(1)亚铬酸亚铁 中Cr的化合价为
中Cr的化合价为_______ 。
(2)“碱熔”亚铬酸亚铁 转化为
转化为 和
和 ,请写出该反应的方程式:
,请写出该反应的方程式:_______ 。
(3)滤渣B的主要成分为_______ (写化学式)。
(4)“碱熔”时会产生一种温室气体,该气体可用于“调pH”,写出其离子方程式:_______ 。
(5)Cr转化时发生反应: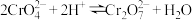 ,该转化中常用的酸为稀硫酸,不用稀盐酸的原因是
,该转化中常用的酸为稀硫酸,不用稀盐酸的原因是_______ 。
(6)处理含 的酸性废水有利于环保,已知室温下
的酸性废水有利于环保,已知室温下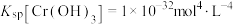 ,为使
,为使 转化为
转化为 而沉降,当检测到废水中
而沉降,当检测到废水中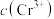 为
为 ,需调节溶液的pH至少为
,需调节溶液的pH至少为_______ 。
 )溶液来源于铬铁矿(主要成分为难溶于水的亚铬酸亚铁
)溶液来源于铬铁矿(主要成分为难溶于水的亚铬酸亚铁 ,还含有
,还含有 和少量的难溶于水和碱溶液的杂质),其制备过程如图所示:
和少量的难溶于水和碱溶液的杂质),其制备过程如图所示:
(1)亚铬酸亚铁
 中Cr的化合价为
中Cr的化合价为(2)“碱熔”亚铬酸亚铁
 转化为
转化为 和
和 ,请写出该反应的方程式:
,请写出该反应的方程式:(3)滤渣B的主要成分为
(4)“碱熔”时会产生一种温室气体,该气体可用于“调pH”,写出其离子方程式:
(5)Cr转化时发生反应:
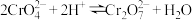 ,该转化中常用的酸为稀硫酸,不用稀盐酸的原因是
,该转化中常用的酸为稀硫酸,不用稀盐酸的原因是(6)处理含
 的酸性废水有利于环保,已知室温下
的酸性废水有利于环保,已知室温下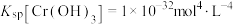 ,为使
,为使 转化为
转化为 而沉降,当检测到废水中
而沉降,当检测到废水中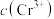 为
为 ,需调节溶液的pH至少为
,需调节溶液的pH至少为
您最近一年使用:0次





