利用炼锌钴渣[主要含 、
、 、
、 和
和 、
、 单质]制备
单质]制备 和高纯
和高纯 的流程如下。
的流程如下。 时,
时,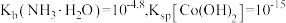
②锌的化合物与铝的化合物部分性质有相似性
请回答下列问题:
(1)写出“酸浸”过程中 发生反应的离子方程式
发生反应的离子方程式___________ 。
(2)“沉铁”过程中 实际用量远大于理论用量的主要原因
实际用量远大于理论用量的主要原因___________ ;该过程加入 的作用为
的作用为___________ 。
(3)“沉镍”过程 对溶液中
对溶液中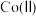 、
、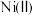 含量的影响如图。
含量的影响如图。
___________ 。
②该过程 可能发生的反应如下:
可能发生的反应如下:
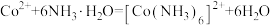
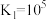


则
___________ 。
(4)“沉钴”过程生成 的离子方程式为
的离子方程式为___________ 。
(5)在电解过程中为了保持电解液成分稳定,应不断加入___________ (填化学式)。
(6)将含有未成对电子的物质置于外磁场中,会使磁场的强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
 、
、 、
、 和
和 、
、 单质]制备
单质]制备 和高纯
和高纯 的流程如下。
的流程如下。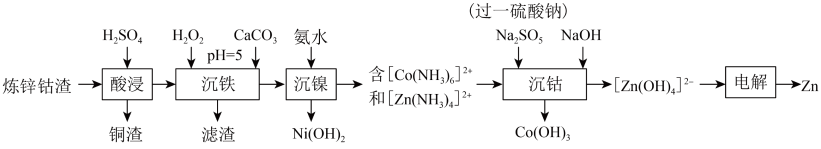
 时,
时,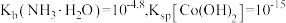
②锌的化合物与铝的化合物部分性质有相似性
请回答下列问题:
(1)写出“酸浸”过程中
 发生反应的离子方程式
发生反应的离子方程式(2)“沉铁”过程中
 实际用量远大于理论用量的主要原因
实际用量远大于理论用量的主要原因 的作用为
的作用为(3)“沉镍”过程
 对溶液中
对溶液中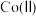 、
、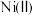 含量的影响如图。
含量的影响如图。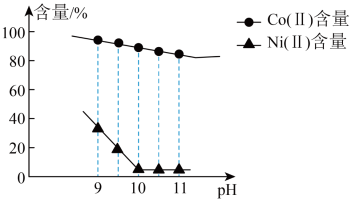

②该过程
 可能发生的反应如下:
可能发生的反应如下: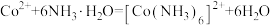
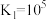


则

(4)“沉钴”过程生成
 的离子方程式为
的离子方程式为(5)在电解过程中为了保持电解液成分稳定,应不断加入
(6)将含有未成对电子的物质置于外磁场中,会使磁场的强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
A. | B. | C. | D.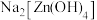 |
更新时间:2024-05-22 07:06:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】利用合成气(主要成分为CO、CO2、 H2) 一定条件下合成甲醇(CH3OH),发生的主要反应如下:
Ⅰ. CO(g) + 2H2(g)=CH3OH(g) △H。
Ⅱ. CO(g) + H2O(g)=CO2(g) +H2(g) ∆H2=-41.2 kJ/mol
回答下列问题:
(1)已知反应①中的相关化学键键能数据如下:
写出由二氧化碳、氢气制备甲醇的热化学方程式_______ 反应I在_______ (填“高温”、“低温”或“任意温度”)条件下自发进行。
(2)在T℃时,向5L恒容密闭容器中加入0.6 mol CO和0.45 molH2,发生反应Ⅰ。CO和CH3OH的浓度在不同时刻的变化状况如图所示:
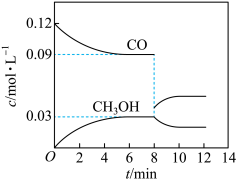
①下列能够说明反应在第6min时达到平衡状态的是______
A.混合气体的平均摩尔质量不再改变
B. CH3OH 的浓度不变
C. v(CO)正 : v(H2)逆= 2:1
D. P(CO):P( H2)= 1:2
第8 min时改变的条件是_______
②在第12 min时升高温度,重新达到平衡时,化学平衡常数将_______ (填 “增大”“不变”或“减小”),理由是_______
(3)某科研小组研究了反应CO(g) + 2H2(g)= CH3OH(g)的动力学,获得其速率方程v=k[c(H2)]1/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
CO的反应级数m=_______ , 当实验2进行到某时刻,测得c(H3)= 0.010 mol·L-1,则此时的反应速率v_______ mol·L-1·s-1(已知: ≈0.3)。
≈0.3)。
(4)利用CH4重整CO2的催化转化如图所示,CH4与CO2重整反应的方程式为_______ 。有关转化过程,下列说法正确的是_______ (填序号)。
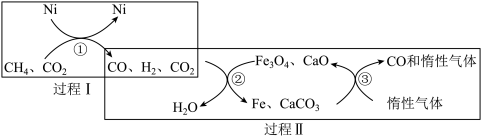
a. 过程Ⅰ中CO2未参与反应
b.过程Ⅱ实现了含碳物质与含氢物质的分离
c.转化②中CaO消耗过程中的CO2,有利于反应正向进行
d. 转化③中Fe与CaCO3,反应的物质的量之比为4:3
Ⅰ. CO(g) + 2H2(g)=CH3OH(g) △H。
Ⅱ. CO(g) + H2O(g)=CO2(g) +H2(g) ∆H2=-41.2 kJ/mol
回答下列问题:
(1)已知反应①中的相关化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
(2)在T℃时,向5L恒容密闭容器中加入0.6 mol CO和0.45 molH2,发生反应Ⅰ。CO和CH3OH的浓度在不同时刻的变化状况如图所示:

①下列能够说明反应在第6min时达到平衡状态的是
A.混合气体的平均摩尔质量不再改变
B. CH3OH 的浓度不变
C. v(CO)正 : v(H2)逆= 2:1
D. P(CO):P( H2)= 1:2
第8 min时改变的条件是
②在第12 min时升高温度,重新达到平衡时,化学平衡常数将
(3)某科研小组研究了反应CO(g) + 2H2(g)= CH3OH(g)的动力学,获得其速率方程v=k[c(H2)]1/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
| 实验序号 | c(H2)/mol/L | c(CO)/mol/L | v/mol/L |
| 1 | 0.100 | 0.100 | 1.2×10-2 |
| 2 | 0.050 | 0.100 | 8.4×10-3 |
| 3 | 0.100 | 0.200 | 2.4×10-2 |
 ≈0.3)。
≈0.3)。(4)利用CH4重整CO2的催化转化如图所示,CH4与CO2重整反应的方程式为

a. 过程Ⅰ中CO2未参与反应
b.过程Ⅱ实现了含碳物质与含氢物质的分离
c.转化②中CaO消耗过程中的CO2,有利于反应正向进行
d. 转化③中Fe与CaCO3,反应的物质的量之比为4:3
您最近一年使用:0次
【推荐2】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2 kJ,用H2表示的平均速率为_____________ 。
(2)合成氨厂可用反应CO(g)+H2O(g) H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1 mol、1 mol、2 mol、2 mol,此时该反应由______ 反应方向开始建立平衡。(选填“正”或“逆”)。
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为______________ 。
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有___________ 。
a.增加CO的用量 b.增加H2O(g)的用量 c.增大压强d.降低温度
 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2 kJ,用H2表示的平均速率为
(2)合成氨厂可用反应CO(g)+H2O(g)
 H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有
a.增加CO的用量 b.增加H2O(g)的用量 c.增大压强d.降低温度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】丁二烯是生产合成橡胶的主要原料。一定条件下,2,3-二甲基-1,3-丁二烯(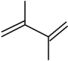 )与溴单质发生液相加成反应(1,2加成和1,4加成),已知溶剂极性越大越容易发生1,4加成。现体系中同时存在如下反应:
)与溴单质发生液相加成反应(1,2加成和1,4加成),已知溶剂极性越大越容易发生1,4加成。现体系中同时存在如下反应:
①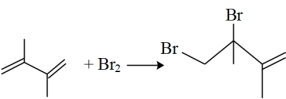
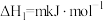
②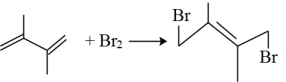
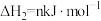
③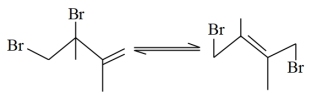

由阿伦尼乌斯公式推知,同一反应在不同温度(T)下,反应速率常数(k)与活化能(Ea)的关系如下: (其中R为常数)。已知体系中两种产物可通过
(其中R为常数)。已知体系中两种产物可通过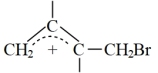 互相转化,反应历程及能量变化如下图所示:
互相转化,反应历程及能量变化如下图所示:
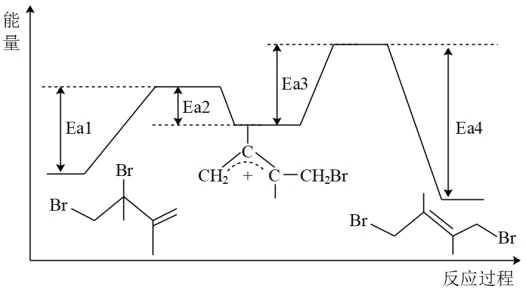
(1)由反应历程及能量变化图示判断,m_______ n(填“>”、“=”或“<”),
_______ 。(用含不同活化能 的式子表示)
的式子表示)
(2)其他条件不变的情况下,升高反应温度,对反应_______ (填①或②)的速率提高更有利,分析原因_______ 。
(3)由反应历程及能量变化图示判断,产物中_______ (用系统命名法命名)含量更大,若要提高该产物在平衡体系中的物质的量分数,还可采取的措施是_______ 。
(4)在一定温度下,向某反应容器中加入1.0mol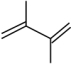 和一定量的
和一定量的 发生上述反应。测得
发生上述反应。测得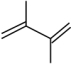 的平衡转化率为
的平衡转化率为 ,平衡时
,平衡时 为b mol,若以物质的量分数表示的平衡常数
为b mol,若以物质的量分数表示的平衡常数 ,反应③的平衡常数
,反应③的平衡常数 ,则产物
,则产物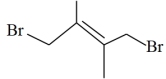 的选择性百分比为
的选择性百分比为_______ ,开始加入的 为
为_______ mol,反应①的平衡常数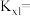
_______ 。
 )与溴单质发生液相加成反应(1,2加成和1,4加成),已知溶剂极性越大越容易发生1,4加成。现体系中同时存在如下反应:
)与溴单质发生液相加成反应(1,2加成和1,4加成),已知溶剂极性越大越容易发生1,4加成。现体系中同时存在如下反应:①

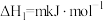
②
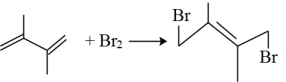
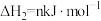
③


由阿伦尼乌斯公式推知,同一反应在不同温度(T)下,反应速率常数(k)与活化能(Ea)的关系如下:
 (其中R为常数)。已知体系中两种产物可通过
(其中R为常数)。已知体系中两种产物可通过 互相转化,反应历程及能量变化如下图所示:
互相转化,反应历程及能量变化如下图所示:
(1)由反应历程及能量变化图示判断,m

 的式子表示)
的式子表示)(2)其他条件不变的情况下,升高反应温度,对反应
(3)由反应历程及能量变化图示判断,产物中
(4)在一定温度下,向某反应容器中加入1.0mol
 和一定量的
和一定量的 发生上述反应。测得
发生上述反应。测得 的平衡转化率为
的平衡转化率为 ,平衡时
,平衡时 为b mol,若以物质的量分数表示的平衡常数
为b mol,若以物质的量分数表示的平衡常数 ,反应③的平衡常数
,反应③的平衡常数 ,则产物
,则产物 的选择性百分比为
的选择性百分比为 为
为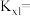
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。
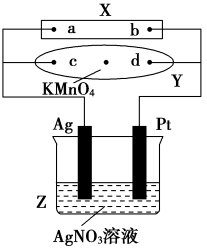
(1)Y中总反应的化学方程式为__________________ ,滤纸上c点附近会变________ 色。
(2)电解一段时间后,产生280 mL的气体(标准状况下),此时溶液的体积为500 mL,假设溶液中还有AgNO3存在,则Z中溶液的pH是________ ,需加入________ g的________ 可使溶液复原。

(1)Y中总反应的化学方程式为
(2)电解一段时间后,产生280 mL的气体(标准状况下),此时溶液的体积为500 mL,假设溶液中还有AgNO3存在,则Z中溶液的pH是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
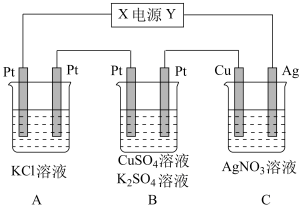
(1)电源电极X的名称为___________ ;
(2)pH变化:A______ ,B______ ,C______ ;(填“增大”“减小”或“不变”)
(3)通电5min后,B中共收集224mL气体(标准状况),溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为______________ (设电解前后溶液体积无变化)
(4)通电5min后,若A中KCl溶液要恢复到电解前的状态,需要加入________ 物质______ g。

(1)电源电极X的名称为
(2)pH变化:A
(3)通电5min后,B中共收集224mL气体(标准状况),溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为
(4)通电5min后,若A中KCl溶液要恢复到电解前的状态,需要加入
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】化学反应与能量变化是化学家研究的永恒话题。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把_______ 能转化为_______ 能的装置。
②工业制备纯硅的反应: ,生成的
,生成的 通入
通入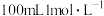 的
的 溶液恰好反应,则制备纯硅的过程中
溶液恰好反应,则制备纯硅的过程中_______ (填“吸收或“释放”)的热量为_______  。
。
(2)氢气是一种理想的绿色能源.请回答下列问题
①在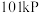 下,
下, 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出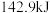 的热量。写出表示氢气燃烧热的热化学方程式
的热量。写出表示氢气燃烧热的热化学方程式_______ 。
②氢能的存储是氢能利用的前提,科学家研究出一种储氢合金 ,已知:
,已知:
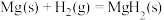
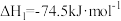
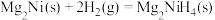
 ;
;

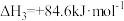
则
_______  。
。
(3)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图.请回答下列问题。
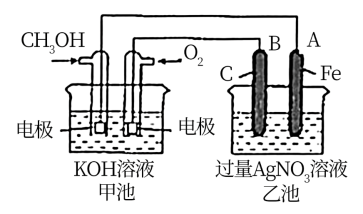
①乙池是_______ 装置(填“原电池”或“电解池”),A电极的名称是_______ ;B(石墨)电极的电极反应式为:_______ 。
②甲池中通入 一极的电极反应式为:
一极的电极反应式为:_______ 。
③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入_______ (填化学式)。
④研究证实,甲醇可由 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:_______ 。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把
②工业制备纯硅的反应:
 ,生成的
,生成的 通入
通入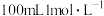 的
的 溶液恰好反应,则制备纯硅的过程中
溶液恰好反应,则制备纯硅的过程中 。
。(2)氢气是一种理想的绿色能源.请回答下列问题
①在
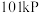 下,
下, 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出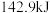 的热量。写出表示氢气燃烧热的热化学方程式
的热量。写出表示氢气燃烧热的热化学方程式②氢能的存储是氢能利用的前提,科学家研究出一种储氢合金
 ,已知:
,已知: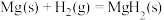
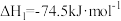
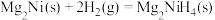
 ;
;
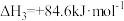
则

 。
。(3)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图.请回答下列问题。

①乙池是
②甲池中通入
 一极的电极反应式为:
一极的电极反应式为:③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入
④研究证实,甲醇可由
 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】化合物A是含有草酸根( )的铜配合物(结构如下图),可加热分解制备Cu纳米颗粒。请回答以下相关问题:
)的铜配合物(结构如下图),可加热分解制备Cu纳米颗粒。请回答以下相关问题:
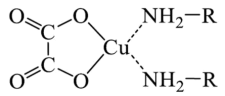
(1)草酸根中C原子的杂化方式为_______ 。
(2)上述的C、H、O、N四种元素中,第一电离能由小到大的顺序为_______ (用元素符号回答,下同),其中,第一电离能最大的元素的原子的价层电子的轨道表达式(电子排布图)为_______ ,该元素第一电离能较大的原因是_______ 。
(3)该配合物加热会生成一种气体,该气体与N2O是等电子体,其分子构型为_______ 。
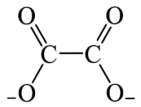
(4)草酸根( )的结构如下图所示,其中σ键和π键的比例为
)的结构如下图所示,其中σ键和π键的比例为_______ 。
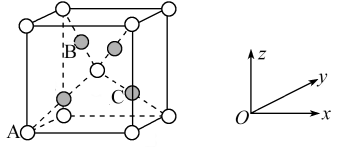
(5)在一定温度加热配合物会生成Cu2O,其中基态Cu+的价层电子排布式为_______ 。Cu2O的晶胞如下图所示,若A原子的坐标参数为(0,0,0),C原子的坐标参数为( ,
, ,
, ),则B原子的坐标参数为
),则B原子的坐标参数为_______ 。若最近的两个O2-的距离为anm,阿伏加德罗常数为NA,则该晶体的密度为_______ g·cm-3。
 )的铜配合物(结构如下图),可加热分解制备Cu纳米颗粒。请回答以下相关问题:
)的铜配合物(结构如下图),可加热分解制备Cu纳米颗粒。请回答以下相关问题:
(1)草酸根中C原子的杂化方式为
(2)上述的C、H、O、N四种元素中,第一电离能由小到大的顺序为
(3)该配合物加热会生成一种气体,该气体与N2O是等电子体,其分子构型为
(4)草酸根(
 )的结构如下图所示,其中σ键和π键的比例为
)的结构如下图所示,其中σ键和π键的比例为
(5)在一定温度加热配合物会生成Cu2O,其中基态Cu+的价层电子排布式为
 ,
, ,
, ),则B原子的坐标参数为
),则B原子的坐标参数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】我国科学家利用生物质合成共聚酯的单体,合成时涉及多种元素,回答下列问题:
(1)基态Cu+的电子排布式为_____ 。
(2)Cu、Zn、Al的第一电离能由大到小的顺序为_____ (填元素符号,下同)。
(3)H2C=CHCOOCH3中所含元素的电负性由小到大的顺序为_____ ,该有机物中,碳原子的杂化类型是_____ 。
(4)区别晶体SiO2和非晶体SiO2的方法是_____ 。
(5)有机物C和D的相对分子质量相差较小,但是D的沸点明显高于C的,其主要原因是_____ 。
(6)我国科学家开发钙钯络合氢化物(CaPdH2)来实现乙炔高选择性合成乙烯。CaPdH2由Ca2+和[PdH2]2-(富电子)构成。CaPdH2中存在的化学键有_____ (填标号)。
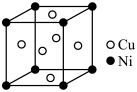
(7)白铜是我国使用最早的合金之一,白铜晶胞结构如图所示。已知晶体密度为dg·cm-3,设NA为阿伏加德罗常数的值。Cu和Ni之间的最短距离为_____ (只列计算式)nm。

(1)基态Cu+的电子排布式为
(2)Cu、Zn、Al的第一电离能由大到小的顺序为
(3)H2C=CHCOOCH3中所含元素的电负性由小到大的顺序为
(4)区别晶体SiO2和非晶体SiO2的方法是
(5)有机物C和D的相对分子质量相差较小,但是D的沸点明显高于C的,其主要原因是
(6)我国科学家开发钙钯络合氢化物(CaPdH2)来实现乙炔高选择性合成乙烯。CaPdH2由Ca2+和[PdH2]2-(富电子)构成。CaPdH2中存在的化学键有
| A.离子键 | B.配位键 | C.非极性键 | D.金属键 |

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】湖南是我国矿产资源大省,磷、锌储量丰富。回答下列问题:
(1)基态Zn原子核外电子共有_______ 种空间运动状态;锌在反应中易失去2个电子,则基态 的价电子轨道表示式(电子排布图)为
的价电子轨道表示式(电子排布图)为_______ 。
(2)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为整合物。 与EDTA形成的螯合物的结构如图所示:
与EDTA形成的螯合物的结构如图所示:

①该配合物的组成元素中电负性最大的是_______ (填元素符号)。
②1个该配合物分子中通过螯合作用形成的配位键有_______ 个,该配合物中碳原子的杂化方式为_______ 。
(3)磷酸为磷的最高价含氧酸,其空间结构如下:
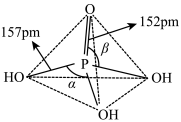
①键能大小比较:磷氧双键_______ (填“大于”“等于”或“小于”)磷氧单键。
②键角大小比较:
_______  (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。
③纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是_______ 。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示(其晶胞参数为a pm);

①固态磷化硼属于_______ (填“分子”“离子”或“原子”)晶体。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知原子分数坐标:M点为(0,0,0)、G点为(1,1,1),则Q点的原子分数坐标为_______ 。
③磷化硼晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)基态Zn原子核外电子共有
 的价电子轨道表示式(电子排布图)为
的价电子轨道表示式(电子排布图)为(2)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为整合物。
 与EDTA形成的螯合物的结构如图所示:
与EDTA形成的螯合物的结构如图所示:
①该配合物的组成元素中电负性最大的是
②1个该配合物分子中通过螯合作用形成的配位键有
(3)磷酸为磷的最高价含氧酸,其空间结构如下:

①键能大小比较:磷氧双键
②键角大小比较:

 (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。③纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示(其晶胞参数为a pm);

①固态磷化硼属于
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知原子分数坐标:M点为(0,0,0)、G点为(1,1,1),则Q点的原子分数坐标为
③磷化硼晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】亚硝酸钠NaNO2主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物制备产品NaNO2。
回答下列问题:
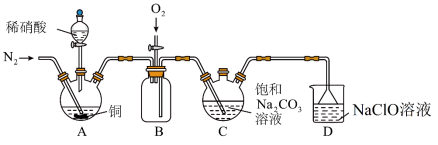
(1)实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和如图装置(净化装置略去),选出一种可行的方法,写出反应的化学方程式___________ 。【可供选择的试剂:CuO(s)、NH3(g)、Cl2(g)、O2(g)、饱和NaNO2(aq)、饱和NH4Cl(aq)】___________ 。
(3)装置C中NO不能单独被纯碱溶液吸收,若要使氮的氧化物完全被纯碱溶液吸收且产品纯度最高,则n(NO):n(NO2)=___________ ;装置D中倒置漏斗的作用是___________ 。
(4)设计实验探究NaNO2的性质。实验完毕后,从装置C中分离出NaNO2固体粗产品,取少量粗产品配制成溶液,分成2份分别进行甲、乙两组实验,实验操作及现象、结论如表。
①上述实验___________ (填标号)的结论不可靠,理由是___________ 。
②经实验测得实验乙反应后的溶液中氮元素仅以NO 的形式存在,酸性KMnO4溶液与NO
的形式存在,酸性KMnO4溶液与NO 反应的离子方程式为
反应的离子方程式为___________ 。
回答下列问题:
(1)实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和如图装置(净化装置略去),选出一种可行的方法,写出反应的化学方程式
(3)装置C中NO不能单独被纯碱溶液吸收,若要使氮的氧化物完全被纯碱溶液吸收且产品纯度最高,则n(NO):n(NO2)=
(4)设计实验探究NaNO2的性质。实验完毕后,从装置C中分离出NaNO2固体粗产品,取少量粗产品配制成溶液,分成2份分别进行甲、乙两组实验,实验操作及现象、结论如表。
| 实验操作及现象 | 结论 | |
| 甲 | 滴加少量酸性KI淀粉溶液,振荡,溶液变蓝 | 酸性条件下NO 具有氧化性 具有氧化性 |
| 乙 | 滴加少量酸性KMnO4溶液,振荡,紫色褪去 | 酸性条件下NO 具有还原性 具有还原性 |
②经实验测得实验乙反应后的溶液中氮元素仅以NO
 的形式存在,酸性KMnO4溶液与NO
的形式存在,酸性KMnO4溶液与NO 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】S2Cl2用作橡胶的低温硫化剂和粘结剂,由硫与限量氯气在50~60℃反应制得,进一步氯化可得SCl2、S2Cl2、SCl2的某些性质如下:
用如图所示装置制备S2Cl2回答下列问题:
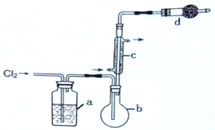
(1)写出S2Cl2的电子式_________ 。
(2)写出仪器c的名称_________ ;实验开始前先在b中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一固体薄层,这样做的目的是_________ 。
(3)实验时,b装置需加热。最好采用何种方式加热_________ 。
(4)b中的反应开始前,需排除装置中的空气,简述相关操作:_________ 。
(5)装置d中盛放的试剂是_________ ;其作用是①_________ ②_________ 。
(6)为了获得更纯净的S2Cl2,需要对产品进行的操作是_________ 。
(7)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的方程式_________ 。
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,通水即分解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |

(1)写出S2Cl2的电子式
(2)写出仪器c的名称
(3)实验时,b装置需加热。最好采用何种方式加热
(4)b中的反应开始前,需排除装置中的空气,简述相关操作:
(5)装置d中盛放的试剂是
(6)为了获得更纯净的S2Cl2,需要对产品进行的操作是
(7)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】氢化钙固体可作为轻便的氢气发生剂,是登山运动员常用的能源提供剂。氢化钙对湿气敏感,极易潮解。某兴趣小组拟选用如下装置制备氢化钙。
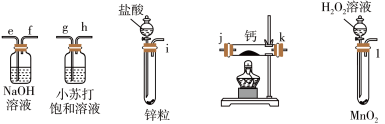
请回答下列问题:
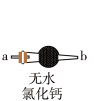
(1)上图中装无水氯化钙的仪器名称为_______ ,其作用是_______ 。
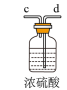
(2)请选择必要的装置,按气流方向连接顺序为_______ (填仪器接口的字母编号)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品→打开分液漏斗活塞→_______→_______→_______→_______(填字母编号)。_______
A.加热反应一段时间 B.收集气体并检验其纯度 C.关闭分液漏斗活塞 D.停止加热,充分冷却
(4)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。该同学的判断是否正确?_______ (填“是”或“否”),原因是_______ 。



请回答下列问题:
(1)上图中装无水氯化钙的仪器名称为
(2)请选择必要的装置,按气流方向连接顺序为
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品→打开分液漏斗活塞→_______→_______→_______→_______(填字母编号)。
A.加热反应一段时间 B.收集气体并检验其纯度 C.关闭分液漏斗活塞 D.停止加热,充分冷却
(4)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。该同学的判断是否正确?
您最近一年使用:0次



