铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3 + 3NaClO + 4NaOH =2Na2FeO4 + 3X + 5H2O, 则X的化学式_______ ,反应中_______ 被氧化。
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为_______ ;
“滤渣A”主要成分的化学式为_______ 。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + +_______H2O =15Fe2 + + _______SO +_______。
+_______。
_______
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为_______ 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,如果pH过大,可能引起的后果是_______ (几种离子沉淀的pH见表);滤液B可以回收的物质有(写化学式)_______ 。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3 + 3NaClO + 4NaOH =2Na2FeO4 + 3X + 5H2O, 则X的化学式
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为
“滤渣A”主要成分的化学式为
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + +_______H2O =15Fe2 + + _______SO
 +_______。
+_______。③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.2 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
更新时间:2019-01-30 18:14:09
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】水体中的Cr2O 、HCrO
、HCrO 和CrO
和CrO 是高毒性的重金属离子,可用Cr(Ⅵ)表示。常用的处理方法是将Cr(Ⅵ)还原为低毒性的Cr3+或Cr(OH)3。
是高毒性的重金属离子,可用Cr(Ⅵ)表示。常用的处理方法是将Cr(Ⅵ)还原为低毒性的Cr3+或Cr(OH)3。
(1)在一定pH的水溶液中,HS-、S2-可与CrO 反应生成Cr(OH)3和单质硫。水溶液中S2-能与单质硫反应生成S
反应生成Cr(OH)3和单质硫。水溶液中S2-能与单质硫反应生成S ,S
,S 能还原Cr(Ⅵ)。
能还原Cr(Ⅵ)。
①在pH=9的水溶液中CrO 与HS-反应的离子方程式为
与HS-反应的离子方程式为_______ 。
②25℃时用过量S2-还原Cr(Ⅵ),发现反应后期Cr(Ⅵ)被还原的速率反而加快。产生该现象的原因可能是_______ ;验证的实验方法是_______ 。
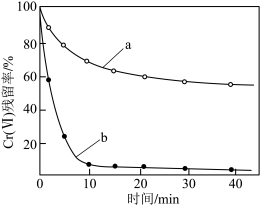
(2)金属也可用于还原废水中的Cr(Ⅵ)。其他条件相同时,用相同物质的量的Zn粉、Zn-Cu粉分别处理pH=2.5的含Cr(Ⅵ)废水,废水中Cr(Ⅵ)残留率随时间的变化如图所示。图中b对应的实验方法处理含Cr(Ⅵ)废水的效果更好,其原因是_______ 。
(3)用氧化铁包裹的纳米铁粉(用Fe@Fe2O3表示)能有效还原水溶液中的Cr(Ⅵ)。Fe@Fe2O3还原近中性废水中Cr(Ⅵ)的可能反应机理如图所示。Fe@Fe2O3中Fe还原CrO 的过程可描述为
的过程可描述为_______ 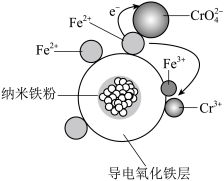 。
。
 、HCrO
、HCrO 和CrO
和CrO 是高毒性的重金属离子,可用Cr(Ⅵ)表示。常用的处理方法是将Cr(Ⅵ)还原为低毒性的Cr3+或Cr(OH)3。
是高毒性的重金属离子,可用Cr(Ⅵ)表示。常用的处理方法是将Cr(Ⅵ)还原为低毒性的Cr3+或Cr(OH)3。(1)在一定pH的水溶液中,HS-、S2-可与CrO
 反应生成Cr(OH)3和单质硫。水溶液中S2-能与单质硫反应生成S
反应生成Cr(OH)3和单质硫。水溶液中S2-能与单质硫反应生成S ,S
,S 能还原Cr(Ⅵ)。
能还原Cr(Ⅵ)。①在pH=9的水溶液中CrO
 与HS-反应的离子方程式为
与HS-反应的离子方程式为②25℃时用过量S2-还原Cr(Ⅵ),发现反应后期Cr(Ⅵ)被还原的速率反而加快。产生该现象的原因可能是
(2)金属也可用于还原废水中的Cr(Ⅵ)。其他条件相同时,用相同物质的量的Zn粉、Zn-Cu粉分别处理pH=2.5的含Cr(Ⅵ)废水,废水中Cr(Ⅵ)残留率随时间的变化如图所示。图中b对应的实验方法处理含Cr(Ⅵ)废水的效果更好,其原因是

(3)用氧化铁包裹的纳米铁粉(用Fe@Fe2O3表示)能有效还原水溶液中的Cr(Ⅵ)。Fe@Fe2O3还原近中性废水中Cr(Ⅵ)的可能反应机理如图所示。Fe@Fe2O3中Fe还原CrO
 的过程可描述为
的过程可描述为 。
。
您最近一年使用:0次
【推荐2】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是___________ 。
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为___________ 。
(3)根据上述反应可推知___________。
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方向和数目:  。
。___________
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为
(3)根据上述反应可推知___________。
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
 。
。
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】工业上一般在酸性条件下用N2H4 • H2O(水合肼)、SO2和FeSO4来处理含Cr2O72-废水。回答下列问题:
(1)N2H4 • H2O(水合肼)与Cr2O72-反应时,产物中含有N2和以Cr3+。该反应的离子方程式为___________ ,反应中水合肼作_____________ (填“氧化剂”或“还原剂”)。
(2)SO2处理含Cr2O72-的废水时,先向废水中通入过量SO2,再用NaOH中和废水,使其pH值为8,过滤出Cr(OH)3。
①废水中的Cr2O72-与SO2反应时,氧化剂与还原剂的物质的量之比为____________ 。
②用碱中和时,pH不宜过大,否则沉淀又逐渐溶解,已知Cr3+与Al3+化学性质相似,写出pH过大时沉淀溶解的离子方程式________________ 。
(3)铁氧体法是用FeSO4作还原剂,在pH≈2时将Cr2O72- 还原为Cr3+,然后调节pH为7.5~8.5,再加热得到铁氧体(组成类似于Fe3O4,部分Fe3+被Cr3+替换)。现有100 L含Cr2O72-浓度为2×10-4 mol·L-1的强酸性废水,向其中加入一定量的FeSO4·7H2O,搅拌,充分反应后再加入NaOH溶液调节pH并加热,使其恰好转化为 [Fe2+Fex3+Cry3+ ]O4。则处理100L该废水时需加入的FeSO4·7H2O的质量为________ g。
(1)N2H4 • H2O(水合肼)与Cr2O72-反应时,产物中含有N2和以Cr3+。该反应的离子方程式为
(2)SO2处理含Cr2O72-的废水时,先向废水中通入过量SO2,再用NaOH中和废水,使其pH值为8,过滤出Cr(OH)3。
①废水中的Cr2O72-与SO2反应时,氧化剂与还原剂的物质的量之比为
②用碱中和时,pH不宜过大,否则沉淀又逐渐溶解,已知Cr3+与Al3+化学性质相似,写出pH过大时沉淀溶解的离子方程式
(3)铁氧体法是用FeSO4作还原剂,在pH≈2时将Cr2O72- 还原为Cr3+,然后调节pH为7.5~8.5,再加热得到铁氧体(组成类似于Fe3O4,部分Fe3+被Cr3+替换)。现有100 L含Cr2O72-浓度为2×10-4 mol·L-1的强酸性废水,向其中加入一定量的FeSO4·7H2O,搅拌,充分反应后再加入NaOH溶液调节pH并加热,使其恰好转化为 [Fe2+Fex3+Cry3+ ]O4。则处理100L该废水时需加入的FeSO4·7H2O的质量为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】(1)已知用金属钠制取氧化钠,可有多种方法:
①4Na+O2===2Na2O
②4Na+CO2===2Na2O+C
③2NaNO2+6Na===4Na2O+N2↑
在上述三种方法中最好的是_______ ,原因是______________________________________ 。该反应中作氧化剂的是________ 。
(2)据资料介绍:过氧化钠是钠在空气中燃烧的主要产物,由于空气中还含有其他成分,因此还存在其他产物,如氮化钠。已知氮化钠与水反应能生成氢氧化钠和氨气,则氮化钠与水反应的化学方程式为____________________________ 。
①4Na+O2===2Na2O
②4Na+CO2===2Na2O+C
③2NaNO2+6Na===4Na2O+N2↑
在上述三种方法中最好的是
(2)据资料介绍:过氧化钠是钠在空气中燃烧的主要产物,由于空气中还含有其他成分,因此还存在其他产物,如氮化钠。已知氮化钠与水反应能生成氢氧化钠和氨气,则氮化钠与水反应的化学方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】I:氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH不稳定、易分解、在氯气中能燃烧,与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+= Cu2++Cu。根据以上信息回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是____________ 。
(2)写出CuH在氯气中燃烧的化学反应方程式________________________ 。
(3)CuH溶解在稀盐酸中生成的气体是______________ ,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是__________ 。
II:用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为__________________________ 。
(2) 有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是___________ 。
(3)某同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是__________ 。
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.0×10-3mol·L-1。试计算此时溶液中Cl-的浓度是_________ 。
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是
(2)写出CuH在氯气中燃烧的化学反应方程式
(3)CuH溶解在稀盐酸中生成的气体是
II:用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为
(2) 有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是
(3)某同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.0×10-3mol·L-1。试计算此时溶液中Cl-的浓度是
您最近一年使用:0次
【推荐3】一场“严查酒后驾驶”行动在全国展开,交警所用的酒精测试仪装有用硫酸酸化的三氧化铬(CrO3),遇司机1∶3中呼出的酒精蒸气后,其颜色由红色变为蓝绿色,用这种现象可测得司机是否是酒后驾车。反应如下:2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O,此反应中的还原剂是__________ 。酒精的化学名称为乙醇,其结构简式为CH3CH2OH, 其分子式为C2H6O,摩尔质量为__________ 。检测人的血液中酒精的含量,参考指标常以两种计量单位表示。即“mmol/L”和"mg/100mL"。以“mmol/L”表示时,司机醉驾认定标准为血液中的酒精浓度达到17.4mmol/L以上。若某司机血液酒精浓度检测结果为133mg/100mL。他(她)是否为醉酒驾车__________ (填是或否)。一瓶500mL的白酒含乙醇184g,这瓶白酒中酒精的物质的量浓度为__________ mol/L。
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】铁是人类较早使用的金属之一,运用铁及其化合物的知识,完成下列问题。
(1)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________ 。某问学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少最待侧溶液,滴入KSCN溶液后显红色。由此可知,该溶液中所含金属阳离子有_________ 。
(2)欲从废液中回收铜,并重新获得FeCl3溶液。某同学设计如下实验方案:
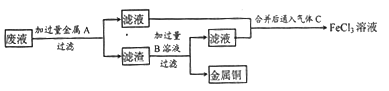
①写出上述实验中有关物质的化学式:A_______ ;B___________ 。
②写出通入气体C的化学方程式:___________ 。
(1)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(2)欲从废液中回收铜,并重新获得FeCl3溶液。某同学设计如下实验方案:

①写出上述实验中有关物质的化学式:A
②写出通入气体C的化学方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】铁、铝、铜都是中学化学常见的金属.
(1)FeCl3溶液用于腐蚀印刷铜板,反应的离子方程式为:_______________________________ 。
(2)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为:___________________________ 。
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为______________________________ 。
(4)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①过量的铁会与稀硝酸反应生成硝酸亚铁,请写出该反应的化学方程式:_______________
②步骤Ⅱ中发生反应:4 Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3•nH2O+8HNO3,4Fe+10HNO3=4Fe(NO3)2+NH4NO3+3H2O,
第一个反应的还原剂是_________ ,第二个反应每生成1molNH4NO3,被还原的硝酸的物质的量是________ 。
③如何检验NH4NO3溶液中的NH4+离子,请描述操作____________________ ,写出相关的离子反应方程式__________________________ 。
④Fe(NO3)2在保存过程中容易被氧化,为防止被氧化常加入____________ 。
⑤上述生产结束后,流程中氮元素最主要的存在形式为(填字母)_______________ 。
a、氮氧化物 b、硝酸铵 c、硝酸亚铁 d、硝酸
(1)FeCl3溶液用于腐蚀印刷铜板,反应的离子方程式为:
(2)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为:
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
(4)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①过量的铁会与稀硝酸反应生成硝酸亚铁,请写出该反应的化学方程式:
②步骤Ⅱ中发生反应:4 Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3•nH2O+8HNO3,4Fe+10HNO3=4Fe(NO3)2+NH4NO3+3H2O,
第一个反应的还原剂是
③如何检验NH4NO3溶液中的NH4+离子,请描述操作
④Fe(NO3)2在保存过程中容易被氧化,为防止被氧化常加入
⑤上述生产结束后,流程中氮元素最主要的存在形式为(填字母)
a、氮氧化物 b、硝酸铵 c、硝酸亚铁 d、硝酸
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】钛白粉(纳米级TiO2)广泛用作功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料,是白色颜料中着色力最强的一种,具有优良的遮盖力和着色牢度,适用于不透明的白色制品。以钛铁矿(主要成分为FeTiO3、MgO)为原料制备高纯度钛白粉,同时得到绿矾的工艺流程如图1。
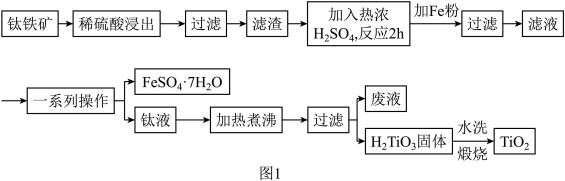
已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是___________ 。
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是___________ 和___________ ,原因为___________ 。

(3)若用浓硫酸浸出后Ti元素的存在形式为 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为___________ 。
(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是___________ ,过滤时用到的玻璃仪器有玻璃棒、___________ 。
(5)将钛液加热煮沸的目的是___________ 。
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为___________ kg。

已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是

(3)若用浓硫酸浸出后Ti元素的存在形式为
 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是
(5)将钛液加热煮沸的目的是
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为
您最近一年使用:0次



