铜、铁、铝是重要的金属材料,铜、铁、铝及其化合物有非常重要的用途。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________ .电解粗铜制取精铜,电解时,阳极材料是________ 。
(2)铁元素与氯元素可形成FeCl2和FeCl3两种化合物,下列说法正确的是______ (填序号)。
①保存FeCl2溶液时,需向溶液中加入少量Fe
②FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③铜片、碳棒和FeCl3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉-碘化钾溶液中滴加几滴FeCl2的浓溶液,原无色溶液变为蓝色
⑤纯铁与稀盐酸反应产生氢气的速率较慢;再加入少量CuCl2·2H2O晶体,速率加快
(3)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。K2FeO4可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式:__________________ 。
(4)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是________ 。
a.NaOH溶液 b.氨水 c.CO2 d.盐酸
(5)四氢铝锂(LiAlH4)是有机合成中重要的还原剂,溶解于NaOH溶液时产生一种无色气体,请完成并配平该反应的离子方程式。
LiAlH4+_________ =____________ +___________ +__________
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为
(2)铁元素与氯元素可形成FeCl2和FeCl3两种化合物,下列说法正确的是
①保存FeCl2溶液时,需向溶液中加入少量Fe
②FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③铜片、碳棒和FeCl3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉-碘化钾溶液中滴加几滴FeCl2的浓溶液,原无色溶液变为蓝色
⑤纯铁与稀盐酸反应产生氢气的速率较慢;再加入少量CuCl2·2H2O晶体,速率加快
(3)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。K2FeO4可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式:
(4)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是
a.NaOH溶液 b.氨水 c.CO2 d.盐酸
(5)四氢铝锂(LiAlH4)是有机合成中重要的还原剂,溶解于NaOH溶液时产生一种无色气体,请完成并配平该反应的离子方程式。
LiAlH4+
更新时间:2016-12-08 23:01:58
|
相似题推荐
【推荐1】绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
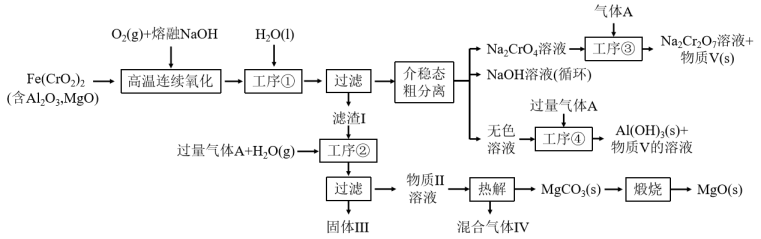
回答下列问题:
(1) 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为_______ 。
(2)工序③操作名称为_______ 。
(3)滤渣I的主要成分是_______ (填化学式)。气体A的化学式为_______ 。
(4)工序④中发生反应的离子方程式为_______ 。
(5)热解工序产生的混合气体最适宜返回工序_______ (填“①”或“②”或“③”或“④”)参与内循环。
(6)工序④溶液中的铝元素恰好完全转化为沉淀的pH为_______ 。(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全;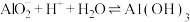 :
: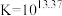 )
)
 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)
 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为(2)工序③操作名称为
(3)滤渣I的主要成分是
(4)工序④中发生反应的离子方程式为
(5)热解工序产生的混合气体最适宜返回工序
(6)工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 为沉淀完全;
为沉淀完全;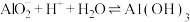 :
: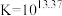 )
)
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
【推荐2】镓的化合物
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式_____ 。
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态_____ ,画出C和D的结构_____ 。
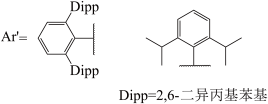
(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式_____ 。
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态

(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐3】我国C919大飞机制造过程中用到的某些新型材料是以 作催化剂制备的。
作催化剂制备的。 是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用
是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用 溶液与
溶液与 气体制备
气体制备 。回答下列问题:
。回答下列问题:
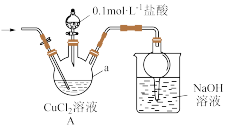
(1)检查装置气密性并加入药品,①打开止水夹先氮气通一段时间,后关闭止水夹;②打开分液漏斗旋塞,向仪器a中加盐酸调pH至2~3,关闭分液漏斗旋塞;③……,溶液中产生白色沉淀;④待反应完全后,再通一段时间。装置A中发生反应的离子方程式为_______ ;仪器a的名称是_______ ;操作③是_______ 。
(2)将装置A中的混合物过滤、洗涤、干燥后密封保存,洗涤时选择的最佳洗涤液是___ (填标号);判断沉淀洗涤干净的实验操作是___ 。
A.蒸馏水 B.稀硫酸 C.95%的乙醇 D.饱和食盐水
(3)测定产品纯度:称取所制备的CuCl产品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用cmol/L的Ce(SO4)2标准溶液滴定至终点,再重复滴定2次,三次平均消耗Ce(SO4)2标准溶液VmL,反应中Ce4+被还原为Ce3+,则样品中CuCl (摩尔质量为Mg/mol)的质量分数为___ 。滴定时Ce(SO4)2标准溶液应盛放在_______ (填“酸式”或“碱式”)滴定管中;下列操作会导致质量分数的测定值偏大的是_______ (填标号)。
A.滴定终点时,仰视读数
B.滴定前锥形瓶用蒸馏水洗净后没有干燥
C.滴定管在滴定前有气泡,滴定后气泡消失
D.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
 作催化剂制备的。
作催化剂制备的。 是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用
是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用 溶液与
溶液与 气体制备
气体制备 。回答下列问题:
。回答下列问题:
(1)检查装置气密性并加入药品,①打开止水夹先氮气通一段时间,后关闭止水夹;②打开分液漏斗旋塞,向仪器a中加盐酸调pH至2~3,关闭分液漏斗旋塞;③……,溶液中产生白色沉淀;④待反应完全后,再通一段时间。装置A中发生反应的离子方程式为
(2)将装置A中的混合物过滤、洗涤、干燥后密封保存,洗涤时选择的最佳洗涤液是
A.蒸馏水 B.稀硫酸 C.95%的乙醇 D.饱和食盐水
(3)测定产品纯度:称取所制备的CuCl产品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用cmol/L的Ce(SO4)2标准溶液滴定至终点,再重复滴定2次,三次平均消耗Ce(SO4)2标准溶液VmL,反应中Ce4+被还原为Ce3+,则样品中CuCl (摩尔质量为Mg/mol)的质量分数为
A.滴定终点时,仰视读数
B.滴定前锥形瓶用蒸馏水洗净后没有干燥
C.滴定管在滴定前有气泡,滴定后气泡消失
D.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
您最近一年使用:0次
【推荐1】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是________ 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____ (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______ (填离子符号),由此可以证明该氧化还原反应为______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______ ;生成沉淀的原因是______ (用平衡移动原理解释)。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐1】铁及其化合物在日常生活、生产中应用广泛。研究铁及其化合物的应用意义重大。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理___________ 。
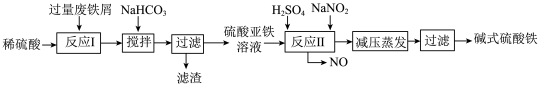
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式___________ 。
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为____________ 。
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为____________ g。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________ 。
(3)铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li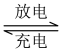 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________ 。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________ 。(忽略溶液的体积变化)。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |  |  |  |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①写出反应I中发生的氧化还原反应的离子方程式
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为
(3)铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li
 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐2】2023年9月23日第19届亚运会在我国杭州正式开幕。开幕式主火炬首次使用了零碳甲醇 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:
反应 ;
;
反应ii: 。
。
(1)反应体系中存在反应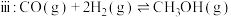 ,则
,则
____________  。
。
(2)将 和
和 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示: 点
点 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为____________ 。(计算结果保留三位有效数字)。
(2) 轴上
轴上 点的数值比
点的数值比 点
点____________ (填“大”或“小”)。
(3)在不同压强下,按照 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和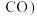 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: 由大到小的顺序为
由大到小的顺序为____________ 。
②曲线____________ (填“ ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。
③在 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数
____________ (填含 的表达式)。
的表达式)。
(4)光催化 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
①光催化原理与电解原理类似,写出高能导带的电极反应式:____________ 。
②太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成____________ (填写微粒名称)参与 的还原再生。
的还原再生。
 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:反应
 ;
;反应ii:
 。
。(1)反应体系中存在反应
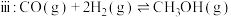 ,则
,则
 。
。(2)将
 和
和 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示: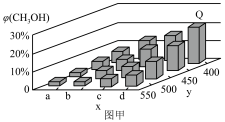
 点
点 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为(2)
 轴上
轴上 点的数值比
点的数值比 点
点(3)在不同压强下,按照
 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: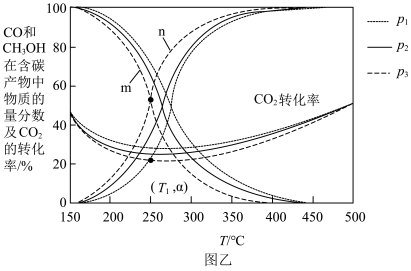
 由大到小的顺序为
由大到小的顺序为②曲线
 ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。③在
 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数
 的表达式)。
的表达式)。(4)光催化
 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。①光催化原理与电解原理类似,写出高能导带的电极反应式:
②太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成
 的还原再生。
的还原再生。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示:
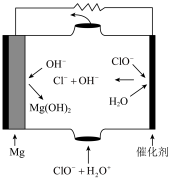
该电池的正极反应式为__________________________________ 。
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=H2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) =2Mg(s)+Mg2NiH4(s)的△H3=__________ 。
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。
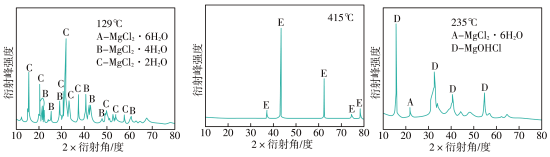
测得E中Mg元素质量分数为60.0%,则E的化学式为_______ 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为__________________ 。
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2==MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________ 。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示:

该电池的正极反应式为
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=H2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) =2Mg(s)+Mg2NiH4(s)的△H3=
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。

测得E中Mg元素质量分数为60.0%,则E的化学式为
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2==MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
【推荐1】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1=-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为__________ 。
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1=-90kJ·mol-1K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2K2
已知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1kJ·mol-1K3
H2O(l)=H2O(g) △H4=+44.0kJ·mol-1K4
则△H2=______ K2=_______ (用含K1、K3、K 4的代数式表示)
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________ 。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
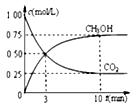
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________ (用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______ (填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为_____ 。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______ 。硝酸浓度不能过大,其原因是___________________________________________ 。
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1=-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1=-90kJ·mol-1K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2K2
已知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1kJ·mol-1K3
H2O(l)=H2O(g) △H4=+44.0kJ·mol-1K4
则△H2=
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g)
 CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)①下列能说明该反应已达到平衡状态的是
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为

(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐2】某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如右图所示。

(1)简述配制饱和食盐水的操作:__________
(2)电解饱和食盐水的离子方程式为__________
实验二:电解不饱和食盐水及产物分析。
相同条件下,电解1 mol·L一1NaCl溶液并收集两极产生的气体。在X处收集到V1mL气体,同时,在Y处收集到V2mL气体,停止电解。结果发现V2<V1,且与电解饱和食盐水相比,Y处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
i.有部分C12溶解于NaCl溶液中;ii.有O2生成。
(3)设计实验证明有部分C12溶解于NaCl溶液中。实验方案为______ 。
(4)证明有O2生成并测定O2的体积。
按如图所示装置进行实验。通过注射器缓缓地将在Y处收集到的V2mL气体全部推入装置A(盛有足量试剂)中,最终,量气管中收集到V3mL气体(设V1、V2、V3均在相同条件下测得)。
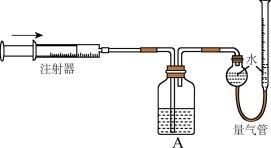
①装置A的作用是____ 。
②本实验中,观察到___ 的现象,说明石墨电极上有O2生成。
③实验中是否需要预先除净装置中的空气?___ (填“是”或“否”)。
(5)实验二中,在石墨电极上生成Cl2的总体积为____ mL(用代数式表示)。
实验反思:
(6)由以上实验推知,欲通过电解食盐水持续地获得较纯净的氯气,电解时应控制的条件:
①_____ ;②______ 。要进一步证明该推论,还需进行电解不同浓度食盐水的平行实验。

(1)简述配制饱和食盐水的操作:
(2)电解饱和食盐水的离子方程式为
实验二:电解不饱和食盐水及产物分析。
相同条件下,电解1 mol·L一1NaCl溶液并收集两极产生的气体。在X处收集到V1mL气体,同时,在Y处收集到V2mL气体,停止电解。结果发现V2<V1,且与电解饱和食盐水相比,Y处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
i.有部分C12溶解于NaCl溶液中;ii.有O2生成。
(3)设计实验证明有部分C12溶解于NaCl溶液中。实验方案为
(4)证明有O2生成并测定O2的体积。
按如图所示装置进行实验。通过注射器缓缓地将在Y处收集到的V2mL气体全部推入装置A(盛有足量试剂)中,最终,量气管中收集到V3mL气体(设V1、V2、V3均在相同条件下测得)。

①装置A的作用是
②本实验中,观察到
③实验中是否需要预先除净装置中的空气?
(5)实验二中,在石墨电极上生成Cl2的总体积为
实验反思:
(6)由以上实验推知,欲通过电解食盐水持续地获得较纯净的氯气,电解时应控制的条件:
①
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
【推荐3】某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
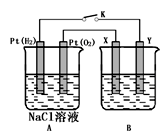
(1)通O2的Pt电极为电池_________ 极(填电极名称),其电极反应式为_____________ 。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为________ ,电解质溶液为_________ 。
(3)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,在_________ 电极(填“X”或“Y”)周围有固体沉积,沉积固体的成分为__________ 。
(4)若X、Y均为Pt,B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变)。恢复到常温下,B电池溶液的pH=__________ ,要使该溶液恢复到原来的状态,需加入_________ (填物质并注明物质的量)。
(5)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为______________ 。
(6)若X、Y均是Pt,电解质溶液为饱和Na2SO4溶液,通电一段时间后,在阴极上逸出c mol气体,同时有N g Na2SO4•10H2O 晶体析出,若温度不变,此时剩余溶液的溶质的质量分数为_________________ 。
(学法题)通过以上题目,请总结书写电极反应式的关键___________ 。

(1)通O2的Pt电极为电池
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为
(3)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,在
(4)若X、Y均为Pt,B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变)。恢复到常温下,B电池溶液的pH=
(5)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为
(6)若X、Y均是Pt,电解质溶液为饱和Na2SO4溶液,通电一段时间后,在阴极上逸出c mol气体,同时有N g Na2SO4•10H2O 晶体析出,若温度不变,此时剩余溶液的溶质的质量分数为
(学法题)通过以上题目,请总结书写电极反应式的关键
您最近一年使用:0次



