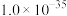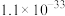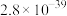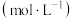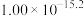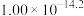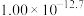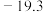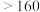绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
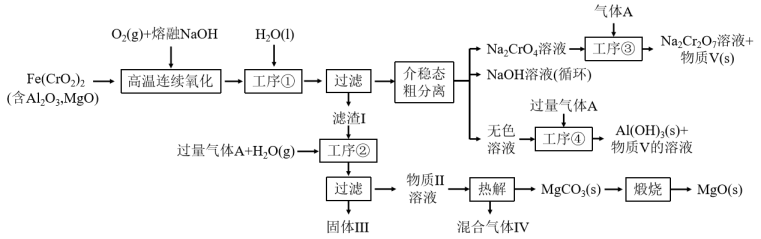
回答下列问题:
(1)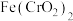 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为_______ 。
(2)工序③操作名称为_______ 。
(3)滤渣I的主要成分是_______ (填化学式)。气体A的化学式为_______ 。
(4)工序④中发生反应的离子方程式为_______ 。
(5)热解工序产生的混合气体最适宜返回工序_______ (填“①”或“②”或“③”或“④”)参与内循环。
(6)工序④溶液中的铝元素恰好完全转化为沉淀的pH为_______ 。(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全;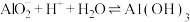 :
: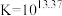 )
)
 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)
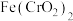 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为(2)工序③操作名称为
(3)滤渣I的主要成分是
(4)工序④中发生反应的离子方程式为
(5)热解工序产生的混合气体最适宜返回工序
(6)工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 为沉淀完全;
为沉淀完全;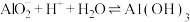 :
: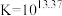 )
)
21-22高三上·福建福州·期中 查看更多[3]
更新时间:2022-03-14 09:09:42
|
相似题推荐
解答题-实验探究题
|
困难
(0.15)
【推荐1】某研究小组将纯净的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图:

实验1中溶液pH变小的原因是_______________ ;V1时,实验2中溶液pH小于实验1的原因是_______________ (用离子方程式表示)。
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤。
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |

实验1中溶液pH变小的原因是
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤。
| 实验步骤 | 实验现象 | 结论 |
| 实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
| 实验4: |
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐2】镓是优良的半导体材料。氮化镓是制作发光二极管的新材料,用于雷达、卫星通信设备等。某工厂利用铝土矿(主要成分为 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
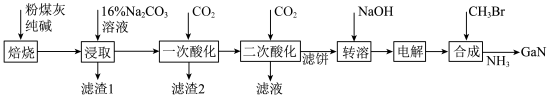
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度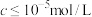 时,可认为已除尽。
时,可认为已除尽。
③金属离子氢氧化物的溶度积(25℃)
④ 、
、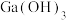 均为两性,
均为两性,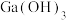 的酸性略强于
的酸性略强于 。
。
回答下列问题:
(1)写出元素镓在周期表中的位置______ ,其简化电子排布式为______ 。
(2)“焙烧”后所得产物主要有______ (写化学式)。
(3)“一次酸化”的目的是______ 。
(4)“二次酸化”中 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式______ 。
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式______ 。
(7)25℃时,已知: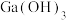 可溶于氨水中,
可溶于氨水中,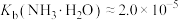 ,反应
,反应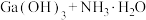
 的平衡常数
的平衡常数 ,计算反应
,计算反应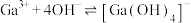 的平衡常数
的平衡常数
______ 。
 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度
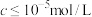 时,可认为已除尽。
时,可认为已除尽。③金属离子氢氧化物的溶度积(25℃)
|
|
| |
|
|
|
|
 、
、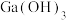 均为两性,
均为两性,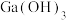 的酸性略强于
的酸性略强于 。
。回答下列问题:
(1)写出元素镓在周期表中的位置
(2)“焙烧”后所得产物主要有
(3)“一次酸化”的目的是
(4)“二次酸化”中
 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式
(7)25℃时,已知:
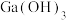 可溶于氨水中,
可溶于氨水中,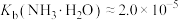 ,反应
,反应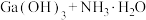
 的平衡常数
的平衡常数 ,计算反应
,计算反应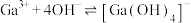 的平衡常数
的平衡常数
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
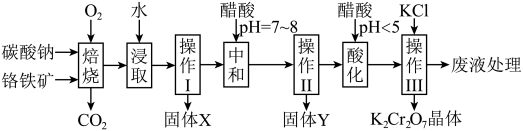
【推荐3】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: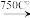 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3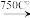 2NaAlO2 +CO2↑;
2NaAlO2 +CO2↑;
③Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是_____ 。
(2)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr207 + 2KCl=K2Cr2O7 ↓+ 2NaCl,该反应在溶液中能发生的理由是_____
(3)操作III有多步组成,获得K2Cr2O7晶体的操作依次是:加入KC1固体、蒸发浓缩、_____ 、过滤、_____ 、干燥。
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量_____ (填写试剂)、溶解、过滤、再通入足量_____ 气体.......灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为_____ (用含m、n的代数式表示)。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min。然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2SO3标准溶液滴定若实验中共用去Na2S2O3标准溶液47.40mL,则所得产品中重铬酸钾的纯度为_____ 。(保留3位有效数字)
已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O +6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O =2I-+S4O
=2I-+S4O
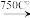 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;②Na2CO3+Al2O3
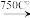 2NaAlO2 +CO2↑;
2NaAlO2 +CO2↑;③Cr2O72-+H2O
 2CrO42-+2H+
2CrO42-+2H+根据题意回答下列问题:
(1)操作I的名称是
(2)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr207 + 2KCl=K2Cr2O7 ↓+ 2NaCl,该反应在溶液中能发生的理由是
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g 水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
(3)操作III有多步组成,获得K2Cr2O7晶体的操作依次是:加入KC1固体、蒸发浓缩、
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min。然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2SO3标准溶液滴定若实验中共用去Na2S2O3标准溶液47.40mL,则所得产品中重铬酸钾的纯度为
已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O =2I-+S4O
=2I-+S4O
您最近一年使用:0次
【推荐1】某化合物X由两种短周期元素组成,校学习兴趣小组设计并完成了如下实验(部分产物已略去):
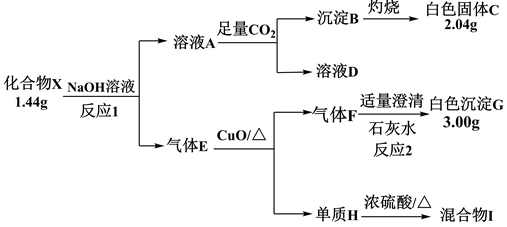
已知白色固体C为常见的耐高温材料,请回答下列问题:
(1)写出化合物X中含有的元素___________ (用元素符号表示)。
(2)写出反应1的化学方程式___________ 。
(3)写出反应2的离子方程式___________ 。
(4)设计实验方案检验混合物I中的金属阳离子:___________ 。
(5)实验表明:常温下,将溶液D置于敞口容器中,加入几滴酚酞,一段时间后,溶液的红色明显加深,可能的原因是___________ 。

已知白色固体C为常见的耐高温材料,请回答下列问题:
(1)写出化合物X中含有的元素
(2)写出反应1的化学方程式
(3)写出反应2的离子方程式
(4)设计实验方案检验混合物I中的金属阳离子:
(5)实验表明:常温下,将溶液D置于敞口容器中,加入几滴酚酞,一段时间后,溶液的红色明显加深,可能的原因是
您最近一年使用:0次
【推荐1】某工厂利用如下流程处理废旧电池正极材料(主要成分为 、
、 、
、 ),制备三元锂电池正极材料
),制备三元锂电池正极材料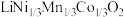 。
。

回答下列问题:
(1)“酸浸”中 发生反应的离子方程式为
发生反应的离子方程式为__________________ ;
 也与部分
也与部分 发生了反应,“酸浸”
发生了反应,“酸浸” 的作用是
的作用是________________________ 。
(2)“含铁沉淀”的主要成分为______ (填化学式);部分离子浓度及对应氢氧化物的 如下表,则“调
如下表,则“调 ”过程
”过程 不应超过
不应超过______ 。
(3)若“调 ”过程中,
”过程中, 、
、 、
、 浓度不变,则“调浓度”过程需要向溶液中添加的物质X为______(填标号)。
浓度不变,则“调浓度”过程需要向溶液中添加的物质X为______(填标号)。
(4)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行______ (填“预烧”“酸洗”“搅拌”)。
(5)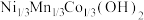 与
与 焙烧生成
焙烧生成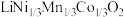 的总反应方程式为
的总反应方程式为__________________ 。
(6) 的晶胞结构示意图如(a)所示。其中
的晶胞结构示意图如(a)所示。其中 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
①下列状态的锂中,失去一个电子所需能量最大的是______ 。
A. B.
B. C.
C.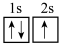 D.
D.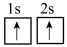
②该晶胞呈长方体,晶胞边长分别为 、
、 、
、 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该晶体的密度可表示为
,该晶体的密度可表示为_____  (用含有
(用含有 的代数式表示)。
的代数式表示)。
③电池充电时, 脱出部分
脱出部分 ,形成
,形成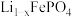 ,结构示意图如(b)所示,则其中
,结构示意图如(b)所示,则其中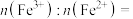
______ 。
 、
、 、
、 ),制备三元锂电池正极材料
),制备三元锂电池正极材料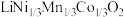 。
。
回答下列问题:
(1)“酸浸”中
 发生反应的离子方程式为
发生反应的离子方程式为 也与部分
也与部分 发生了反应,“酸浸”
发生了反应,“酸浸” 的作用是
的作用是(2)“含铁沉淀”的主要成分为
 如下表,则“调
如下表,则“调 ”过程
”过程 不应超过
不应超过离子 | 浓度 | 氢氧化物 |
| 1.00 |
|
| 1.00 |
|
| 1.40 |
|
(3)若“调
 ”过程中,
”过程中, 、
、 、
、 浓度不变,则“调浓度”过程需要向溶液中添加的物质X为______(填标号)。
浓度不变,则“调浓度”过程需要向溶液中添加的物质X为______(填标号)。A. | B. | C. | D. |
(4)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的
 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行(5)
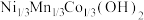 与
与 焙烧生成
焙烧生成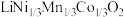 的总反应方程式为
的总反应方程式为(6)
 的晶胞结构示意图如(a)所示。其中
的晶胞结构示意图如(a)所示。其中 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。①下列状态的锂中,失去一个电子所需能量最大的是
A.
 B.
B. C.
C. D.
D.
②该晶胞呈长方体,晶胞边长分别为
 、
、 、
、 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该晶体的密度可表示为
,该晶体的密度可表示为 (用含有
(用含有 的代数式表示)。
的代数式表示)。
③电池充电时,
 脱出部分
脱出部分 ,形成
,形成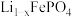 ,结构示意图如(b)所示,则其中
,结构示意图如(b)所示,则其中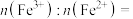
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐2】以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:
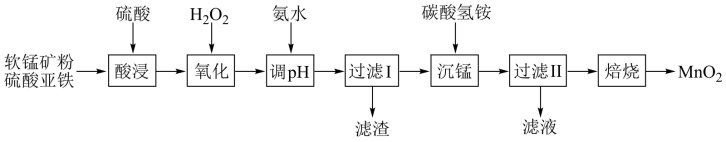
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子的物质的量浓度小于或等于1×10-5 mol·L-1时,可视为该金属离子已被沉淀完全。
(1)“酸浸”实验中,锰的浸出率结果如下图所示。由图可知,软锰矿粉酸浸的适宜条件是___________ 。

(2)酸浸后,锰主要以Mn2+的形式存在,写出相应的离子方程式___________  。
。
(3)若氧化后c(Al3+)=0.02 mol/L,加入氨水(设溶液体积增加1倍),使Fe3+完全沉淀,此时是否有Al(OH)3沉淀生成?___________ (列式计算);想要达到实验目的,加入氨水应调节pH的范围为___________ 。
(4)加入碳酸氢铵产生沉淀的过程称为“沉锰”,“过滤II”所得滤渣为MnCO3。
①“沉锰”过程中放出CO2,反应的离子方程式为___________ 。
②“沉锰”过程中沉锰速率与温度的关系如图所示。
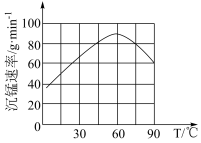
当温度高于60℃时,沉锰速率随着温度升高而减慢的原因是___________ 。
(5)写出焙烧过程的化学方程式___________ 。

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子的物质的量浓度小于或等于1×10-5 mol·L-1时,可视为该金属离子已被沉淀完全。
(1)“酸浸”实验中,锰的浸出率结果如下图所示。由图可知,软锰矿粉酸浸的适宜条件是

(2)酸浸后,锰主要以Mn2+的形式存在,写出相应的离子方程式
 。
。(3)若氧化后c(Al3+)=0.02 mol/L,加入氨水(设溶液体积增加1倍),使Fe3+完全沉淀,此时是否有Al(OH)3沉淀生成?
(4)加入碳酸氢铵产生沉淀的过程称为“沉锰”,“过滤II”所得滤渣为MnCO3。
①“沉锰”过程中放出CO2,反应的离子方程式为
②“沉锰”过程中沉锰速率与温度的关系如图所示。

当温度高于60℃时,沉锰速率随着温度升高而减慢的原因是
(5)写出焙烧过程的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
困难
(0.15)
【推荐3】某混合物含有下列物质中的3种或更多种,各0.01 mol:(NH4)2SO3、NaCl、CaSO4、 K2CrO4、 Mg(NO3)2、 NH4Cl;将该混合物置于水中,充分反应后离心分离得到白色沉淀和0.1 dm3无色溶液。向该溶液中通入0.01 mol氨气,无沉淀生成:若将氨气换成0.01mol NaF,则有白色沉淀生成。指出该混合物中肯定存在的物质_____ 、肯定不存在的物质_____ 、不能判断是否存在的物质各有哪些______ 。并对肯定存在的物质简要说明理由______ 。
已知: K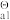 (H2SO3)=1.3 ×10-2 K
(H2SO3)=1.3 ×10-2 K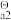 (H2SO3)=6.2 ×10-8 K
(H2SO3)=6.2 ×10-8 K (NH3·H2O)=1.8 ×10-5 K
(NH3·H2O)=1.8 ×10-5 K (CaSO4)=4.9 ×10-5 K
(CaSO4)=4.9 ×10-5 K (CaSO3)= 6.8 ×10-8 K
(CaSO3)= 6.8 ×10-8 K (MgSO3)=3.2 ×10-3 K
(MgSO3)=3.2 ×10-3 K (CaCrO4)=7.l ×10-4 K
(CaCrO4)=7.l ×10-4 K (CaF2)=5.3 ×10-9 K
(CaF2)=5.3 ×10-9 K (MgF2)= 5.2 ×10-11 K
(MgF2)= 5.2 ×10-11 K [Mg(OH)2]= 5.6 ×10-12 K
[Mg(OH)2]= 5.6 ×10-12 K [Ca(OH)2 ]=5.5 ×10-6
[Ca(OH)2 ]=5.5 ×10-6
已知: K
 (H2SO3)=1.3 ×10-2 K
(H2SO3)=1.3 ×10-2 K (H2SO3)=6.2 ×10-8 K
(H2SO3)=6.2 ×10-8 K (NH3·H2O)=1.8 ×10-5 K
(NH3·H2O)=1.8 ×10-5 K (CaSO4)=4.9 ×10-5 K
(CaSO4)=4.9 ×10-5 K (CaSO3)= 6.8 ×10-8 K
(CaSO3)= 6.8 ×10-8 K (MgSO3)=3.2 ×10-3 K
(MgSO3)=3.2 ×10-3 K (CaCrO4)=7.l ×10-4 K
(CaCrO4)=7.l ×10-4 K (CaF2)=5.3 ×10-9 K
(CaF2)=5.3 ×10-9 K (MgF2)= 5.2 ×10-11 K
(MgF2)= 5.2 ×10-11 K [Mg(OH)2]= 5.6 ×10-12 K
[Mg(OH)2]= 5.6 ×10-12 K [Ca(OH)2 ]=5.5 ×10-6
[Ca(OH)2 ]=5.5 ×10-6
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
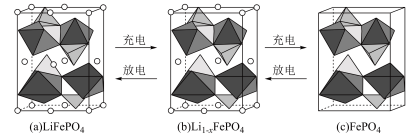
【推荐1】为了实现碳达峰、碳中和目标,建立清洁低碳的能源体系,如何处置和利用废旧电池,已成为当前行业亟需解决的问题。一种废旧磷酸铁锂电池正极材料(主要成分为LiFePO4,另含有少量Al)回收利用的工艺流程如图所示。
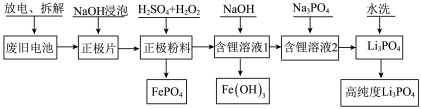
回答下列问题:
(1)拆解废旧磷酸铁锂电池会产生粉尘、废气等,采用_____ (填“封闭式全自动化拆解设备”或“开放式人工手动”)拆解,能避免环境污染并提高拆解效率.拆解后的正极片用NaOH溶液浸泡,目的是_____ 。
(2)正极粉料中加入硫酸酸化的双氧水,其中双氧水的作用是_____ 。生成FePO4的化学方程式为_____ 。
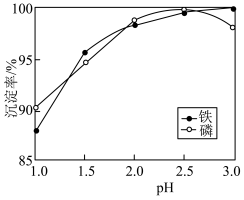
(3)溶液的pH对铁和磷的沉淀率的影响如图所示。沉淀铁和磷时,应选择溶液的pH为2.5。当pH>2.5时,铁、磷沉淀率发生不同变化的原因是_____ 。
(4)已知:Ksp(FePO4)=1.0×10-15,Ksp[Fe(OH)3]=2.8×10-39。向“含锂溶液1”[其中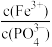 =1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中
=1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中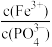 =
=_____ 。
(5)向“含锂溶液2”中加入Na3PO4溶液,得到Li3PO4沉淀。所加的Na3PO4溶液可通过向流程中的_____ (填化学式)中加入NaOH溶液制得。
(6)检验水洗Li3PO4已洗涤干净的操作方法是_____ 。

回答下列问题:
(1)拆解废旧磷酸铁锂电池会产生粉尘、废气等,采用
(2)正极粉料中加入硫酸酸化的双氧水,其中双氧水的作用是
(3)溶液的pH对铁和磷的沉淀率的影响如图所示。沉淀铁和磷时,应选择溶液的pH为2.5。当pH>2.5时,铁、磷沉淀率发生不同变化的原因是

(4)已知:Ksp(FePO4)=1.0×10-15,Ksp[Fe(OH)3]=2.8×10-39。向“含锂溶液1”[其中
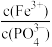 =1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中
=1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中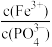 =
=(5)向“含锂溶液2”中加入Na3PO4溶液,得到Li3PO4沉淀。所加的Na3PO4溶液可通过向流程中的
(6)检验水洗Li3PO4已洗涤干净的操作方法是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
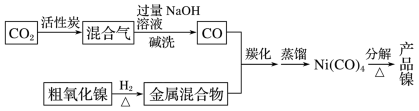
【推荐2】镍在工业生产中有重要作用,以粗氧化镍(主要含 、
、 、Fe2O3等)为原料制备纯镍的流程示意图如下:
、Fe2O3等)为原料制备纯镍的流程示意图如下:
(1)已知C与CO的燃烧热分别为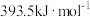 、
、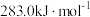 ,则反应
,则反应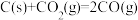
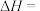
________  。
。
(2)碱洗过程中发生反应的离子方程式为________ 。
(3)羰化反应为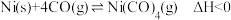 。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
①反应Ⅰ在该温度下的平衡常数K=________ (含x的表达式表示,不考虑单位)。
②下列不能说明反应Ⅲ达到平衡状态的是________ 。
a、平衡常数K不再改变 b.Ni的质量不再改变
c.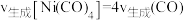 d.容器内的压强不再改变
d.容器内的压强不再改变
③比较平衡时下列物理量的大小:CO的体积分数Ⅰ________ Ⅱ;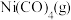 的浓度Ⅰ
的浓度Ⅰ________ Ⅲ(填“>”、“<”或“=”)
(4)羰化后的产物为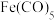 、
、 、
、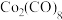 ,有关性质如下表。蒸馏提取
,有关性质如下表。蒸馏提取 应选择的适宜温度范围是
应选择的适宜温度范围是________ 。
(5)采用较高温度下分解 制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:________ 。
 、
、 、Fe2O3等)为原料制备纯镍的流程示意图如下:
、Fe2O3等)为原料制备纯镍的流程示意图如下:
(1)已知C与CO的燃烧热分别为
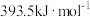 、
、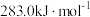 ,则反应
,则反应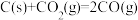
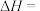
 。
。(2)碱洗过程中发生反应的离子方程式为
(3)羰化反应为
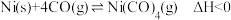 。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:反应时间 |
| CO |
| |
反应Ⅰ:恒温恒容 | 0 min | 足量 | 4 mol | 0 |
| x mol | |||
反应Ⅱ:恒温恒压 | 0 min | 足量 | 4 mol | 0 |
反应Ⅲ:绝热恒容 | 0 min | 0 | 0 | 1 mol |
②下列不能说明反应Ⅲ达到平衡状态的是
a、平衡常数K不再改变 b.Ni的质量不再改变
c.
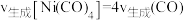 d.容器内的压强不再改变
d.容器内的压强不再改变③比较平衡时下列物理量的大小:CO的体积分数Ⅰ
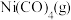 的浓度Ⅰ
的浓度Ⅰ(4)羰化后的产物为
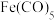 、
、 、
、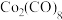 ,有关性质如下表。蒸馏提取
,有关性质如下表。蒸馏提取 应选择的适宜温度范围是
应选择的适宜温度范围是物质 |
|
|
|
沸点/℃ | 106 | 43.2 | 52 |
熔点/℃ |
|
| 31 |
分解温度/℃ |
| 135 | — |
 制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐3】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
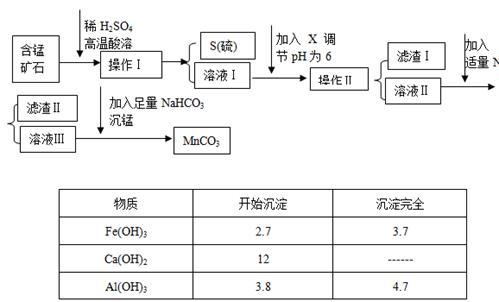
回答下列问题:
(1)操作Ⅰ为:___________ 。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为( )
(4)滤渣Ⅰ为___________ ,滤渣Ⅱ为___________ 。
(5)沉锰的化学方程式为:______________________ 。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________ 。

回答下列问题:
(1)操作Ⅰ为:
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为
| A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为
(5)沉锰的化学方程式为:
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:
您最近一年使用:0次