在HNO2溶液中存在如下平衡:HNO2 H++
H++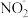 ,向该溶液中加入少量的下列物质后,能使电离平衡向右移动且使H+ 数目增多的是
,向该溶液中加入少量的下列物质后,能使电离平衡向右移动且使H+ 数目增多的是
 H++
H++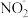 ,向该溶液中加入少量的下列物质后,能使电离平衡向右移动且使H+ 数目增多的是
,向该溶液中加入少量的下列物质后,能使电离平衡向右移动且使H+ 数目增多的是| A.水 | B.NaOH | C.NaNO2 | D.HNO3 |
更新时间:2016-12-09 07:17:07
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】室温下,关于1.0mL0.1mol/L氨水。下列判断正确的是
| A.溶液的pH等于13 |
| B.加入少量NH4Cl固体,c (OH-)不变 |
C.c(OH-)=c ( )+c(H+) )+c(H+) |
| D.与1.0mL0.1mol/L盐酸混合后,溶液呈中性 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】一定温度下,在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
 CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )| A.加入少量NaOH固体,平衡向正方向移动,电离平衡常数增大 |
| B.滴加少量0.1mol/LHCl溶液,平衡逆方向移动,溶液中c(H+)增大 |
| C.加水,电离平衡右移,电离程度增大,所有离子浓度增大 |
| D.加入少量NaCl溶液,平衡不移动 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】下列叙述中正确的是( )
| A.可用明矾和漂白粉处理自来水,二者的作用原理相同 |
B.室温下向10mLpH=3的醋酸溶液中加水稀释后,溶液中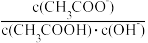 不变 不变 |
| C.氯水、氨水、王水是混合物,水银、水玻璃是纯净物 |
| D.可用澄清的石灰水鉴别碳酸钠和碳酸氢钠 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】向10mL氨水中加入蒸馏水,将其稀释到1L后,下列变化中不正确的是
A. 的电离程度增大 的电离程度增大 |
B. 增大 增大 |
C. 的数目增多 的数目增多 |
D.  增大 增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐3】下列说法正确的是
| A.pH=3的醋酸溶液的物质的量浓度大于pH=4的醋酸溶液的10倍 |
B.常温下,pH之和为14的氨水和醋酸等体积混合后的溶液中c(NH )>c(CH3COO-) )>c(CH3COO-) |
| C.相同浓度的盐酸和醋酸两溶液,与同浓度NaOH完全中和,所需NaOH的量相同 |
| D.常温下,pH=4的HF溶液,加水稀释后,溶液中导电微粒的物质的量的浓度变大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】在 溶液中存在电离平衡:
溶液中存在电离平衡: ,要使溶液中
,要使溶液中 浓度增大,且电离平衡逆向移动,可采取的措施是( )
浓度增大,且电离平衡逆向移动,可采取的措施是( )
 溶液中存在电离平衡:
溶液中存在电离平衡: ,要使溶液中
,要使溶液中 浓度增大,且电离平衡逆向移动,可采取的措施是( )
浓度增大,且电离平衡逆向移动,可采取的措施是( )| A.加水 | B.加热 | C.加 固体 固体 | D.加 固体 固体 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】氨水中存在电离平衡: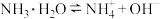 。下列叙述正确的是( )
。下列叙述正确的是( )
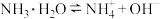 。下列叙述正确的是( )
。下列叙述正确的是( )A.加水后,溶液中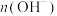 增大 增大 |
B.加入少量浓盐酸,溶液中 增大 增大 |
C.加入少量浓 溶液,电离平衡正向移动 溶液,电离平衡正向移动 |
D.加入少量 固体,溶液中 固体,溶液中 减小 减小 |
您最近一年使用:0次



