【化学——选修3:物质结构与性质】
铁是最常见的金属材料。铁能形成 [Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物。
(1)基态Fe3+的M层电子排布式为______________ ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是__________ 、__________ ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=__ 。 Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________ (填晶体类型)。
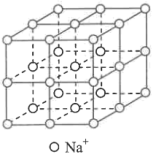
(4)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为_______ ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为_______ g/cm3。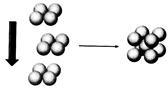
铁是最常见的金属材料。铁能形成 [Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物。
(1)基态Fe3+的M层电子排布式为
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(4)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为

更新时间:2016-12-09 02:07:36
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
【推荐1】蛋氨酸铬(III)配合物是一种治疗II型糖尿病的药物,其结构简式如图所示。回答下列相关问题:
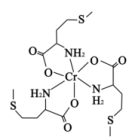
(1)基态Cr原子核外有_______ 种运动状态的电子,下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是_______ (填标号)。
A.[Ar]3d54s1 B.[Ar]3d5 C.[Ar]3d44s14p1 D.[Ar]3d54p1
(2)蛋氨酸铬(III)配合物的中心铬离子的配位数为_______ ;N的_______ 杂化轨道与Cr的空轨道形成配位键。
(3)哈勃−韦斯(Haber−Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。Cr3+_______ (填“能”或“不能”)催化双氧水分解。
(4)化学式为CrCl3·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,Cr3+的配位数均为6,将它们配制成等体积等物质的量浓度的溶液,分别加入足量AgNO3溶液,依次所得AgCl沉淀的物质的量之比为3:2:1,则呈亮绿色的配合物,其内界离子的化学式为_______ 。H2O分子与Cr3+形成配位键后H−O−H键角_______ (填“变大”“变小”或“不变”)。
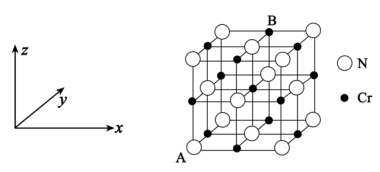
(5)氮化铬的晶体结构类型与氯化钠相似,其晶胞结构如图所示。A点分数坐标为(0,0,0),则B点分数坐标为_______ 。已知氮化铬的晶体密度为dg·cm−3,摩尔质量为M mol∙L−1,NA为阿伏加德罗常数,则晶胞参数为_______ cm(只要求列表达式,不必计算数值)。

(1)基态Cr原子核外有
A.[Ar]3d54s1 B.[Ar]3d5 C.[Ar]3d44s14p1 D.[Ar]3d54p1
(2)蛋氨酸铬(III)配合物的中心铬离子的配位数为
(3)哈勃−韦斯(Haber−Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。Cr3+
(4)化学式为CrCl3·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,Cr3+的配位数均为6,将它们配制成等体积等物质的量浓度的溶液,分别加入足量AgNO3溶液,依次所得AgCl沉淀的物质的量之比为3:2:1,则呈亮绿色的配合物,其内界离子的化学式为
(5)氮化铬的晶体结构类型与氯化钠相似,其晶胞结构如图所示。A点分数坐标为(0,0,0),则B点分数坐标为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】2020年12月17日我国月球探测器“嫦娥五号”成功携带月壤,返回地球。月壤主要由氧(O)、硅(Si)、铝(Al)、铁(Fe)、铜(Cu)、镍(Ni)等多种元素组成。回答下列问题:
(1) 是“嫦娥五号”中用到的一种耐火材料,其熔点高、硬度大。工业上电解熔融
是“嫦娥五号”中用到的一种耐火材料,其熔点高、硬度大。工业上电解熔融 冶炼Al,
冶炼Al, 属于
属于___________ 晶体,第一电离能Ⅰ1 (Mg)与Ⅰ1 (Al)的关系是Ⅰ1 (Mg)___________ Ⅰ1 (Al)(填“>”、“<”或“=”)。
(2) 可与邻二氮菲(
可与邻二氮菲(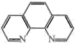 )中N原子通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定
)中N原子通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定 浓度,基态
浓度,基态 离子的价层电子排布式为
离子的价层电子排布式为___________ ,价层电子占据的原子轨道数为___________ ,邻二氮菲中N原子的杂化类型为___________ 。
(3)将金属铜投入氨水与 的混合溶液中,铜片溶解,溶液呈深蓝色,该反应的离子方程式为
的混合溶液中,铜片溶解,溶液呈深蓝色,该反应的离子方程式为___________ 。
(4)月壤中含有丰富的珍贵的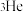 ,中国科学家在2017年成功合成钠氦化合物,使这个最稳定的元素“脱单”。该化合物晶胞中
,中国科学家在2017年成功合成钠氦化合物,使这个最稳定的元素“脱单”。该化合物晶胞中 的排布如图所示,电子对(
的排布如图所示,电子对(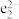 )和
)和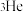 原子交替分布填充在小立方体的中心,晶胞中距
原子交替分布填充在小立方体的中心,晶胞中距 最近的He原子数目为
最近的He原子数目为___________ ,该化合物的化学式可表示为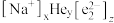 ,则x=
,则x=___________ (用z表达),晶胞参数为a pm,该晶体密度为___________  (写出表达式)。
(写出表达式)。
(1)
 是“嫦娥五号”中用到的一种耐火材料,其熔点高、硬度大。工业上电解熔融
是“嫦娥五号”中用到的一种耐火材料,其熔点高、硬度大。工业上电解熔融 冶炼Al,
冶炼Al, 属于
属于(2)
 可与邻二氮菲(
可与邻二氮菲( )中N原子通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定
)中N原子通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定 浓度,基态
浓度,基态 离子的价层电子排布式为
离子的价层电子排布式为(3)将金属铜投入氨水与
 的混合溶液中,铜片溶解,溶液呈深蓝色,该反应的离子方程式为
的混合溶液中,铜片溶解,溶液呈深蓝色,该反应的离子方程式为(4)月壤中含有丰富的珍贵的
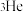 ,中国科学家在2017年成功合成钠氦化合物,使这个最稳定的元素“脱单”。该化合物晶胞中
,中国科学家在2017年成功合成钠氦化合物,使这个最稳定的元素“脱单”。该化合物晶胞中 的排布如图所示,电子对(
的排布如图所示,电子对(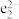 )和
)和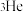 原子交替分布填充在小立方体的中心,晶胞中距
原子交替分布填充在小立方体的中心,晶胞中距 最近的He原子数目为
最近的He原子数目为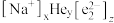 ,则x=
,则x= (写出表达式)。
(写出表达式)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】AgNO3是重要的化学试剂,常用于化学检验、医药和电子工业。回答下列问题:
(1)Ag与Cu为同族紧邻元素,二者基态原子的价电子排布相似,Ag在元素周期表中的位置为______ 。
(2)基态Ag+的价电子排布图为______ ; 的空间构型为
的空间构型为______ 。
(3)由AgNO3制备的[Ag(NH3)2]OH可用于检验醛基。[Ag(NH3)2]OH中向中心原子提供孤电子对的原子为______ ;若分子式为C3H6O的有机物经检验含醛基,则其分子中碳原子的杂化方式为______ 。
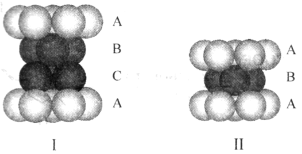
(4)银晶体为面心立方堆积,下图中可以表示银的堆积方式的为______ (填标号);银晶胞的边长为apm,则银晶胞的密度为______ g∙cm-3(用含a、NA的计算式表示)。
(1)Ag与Cu为同族紧邻元素,二者基态原子的价电子排布相似,Ag在元素周期表中的位置为
(2)基态Ag+的价电子排布图为
 的空间构型为
的空间构型为(3)由AgNO3制备的[Ag(NH3)2]OH可用于检验醛基。[Ag(NH3)2]OH中向中心原子提供孤电子对的原子为
(4)银晶体为面心立方堆积,下图中可以表示银的堆积方式的为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐1】C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用,请回答下列问题:
(1)Ge原子的核外电子排布式为_______ 。
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是_______ 。
(3)按要求指出下列氧化物的空间构型、成键方式或性质。
①CO2分子的空间构型及碳氧之间的成键方式_______ ;
②SiO2晶体的空间构型及硅氧之间的成键方式_______ 。
(1)Ge原子的核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质。
①CO2分子的空间构型及碳氧之间的成键方式
②SiO2晶体的空间构型及硅氧之间的成键方式
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】铝镍钴系永磁合金以铁,镍、铝元素为主要成分,还含有铜、钴、钛等元素.具有高剩磁和低温度系数,磁性稳定.现多用于仪表工业中制造磁电系仪表、流量计、微特电机,继电器等。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小, 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为________ ,熔沸点:
____  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(2) 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是___________ 。
(3)氢能源发展的关键环节是新型储氢材料,氨硼烷 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
①氨硼烷分子中B原子采取_________ 杂化。
②氨硼烷晶体中存在的作用力有范德华力,极性键、________ 和________ 。
(4)立方氮化硼 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
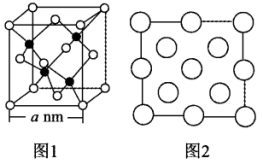
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置________ 。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,
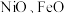 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(2)
 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是(3)氢能源发展的关键环节是新型储氢材料,氨硼烷
 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。①氨硼烷分子中B原子采取
②氨硼烷晶体中存在的作用力有范德华力,极性键、
(4)立方氮化硼
 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。
(1)GaAs、GaN结构相似,晶体类型都为共价晶体,沸点GaAs___________ GaN(填“>”或“<”,下同),第一电离能Ga___________ As。
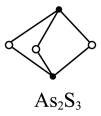
(2)成语“信口雌黄”中雌黄的分子式为As2S3,分子结构如图,As原子的杂化方式为___________ 。
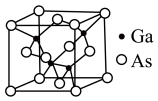
(3)GaAs的晶胞结构如图,在GaAs晶体中,与As原子最近且等距离的As原子数为______ 。
(4)若砷化镓晶胞边长为apm,则Ga与最近As的核间距为___________ cm。
(1)GaAs、GaN结构相似,晶体类型都为共价晶体,沸点GaAs
(2)成语“信口雌黄”中雌黄的分子式为As2S3,分子结构如图,As原子的杂化方式为

(3)GaAs的晶胞结构如图,在GaAs晶体中,与As原子最近且等距离的As原子数为

(4)若砷化镓晶胞边长为apm,则Ga与最近As的核间距为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:

(1)每一个晶胞中均摊到_______ 个钨原子。
(2)计算晶胞的边长a(写出计算过程)_______ 。
(3)计算钨的原子半径r_____ (提示:只有体对角线上的各个球才是彼此接触的)。

(1)每一个晶胞中均摊到
(2)计算晶胞的边长a(写出计算过程)
(3)计算钨的原子半径r
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐2】完成下列小题
(1)①下列说法不正确的是_____ (填序号)。
A.因为二氧化硅的相对分子质量比二氧化碳大,所以沸点: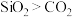
B.稳定性: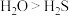 ,水分子更稳定的原因是水分子间存在氢键
,水分子更稳定的原因是水分子间存在氢键
C. 与CO为等电子体,结构相似
与CO为等电子体,结构相似
②复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式为[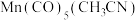 ],下列说法正确的是
],下列说法正确的是_____ (填字母标号)。
A.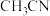 与Mn原子配位时,提供孤电子对的是C原子
与Mn原子配位时,提供孤电子对的是C原子
B.Mn原子的配位数为6
C.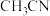 中C原子的杂化类型为
中C原子的杂化类型为 、
、
(2)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_____(填标号)。
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是_____ (填标号);第三电离能的变化图是_____ (填标号)。

(4)锰与镓同周期, 催化
催化 分解:
分解: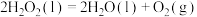
 ,其反应机理如图:
,其反应机理如图:

已知反应Ⅱ为: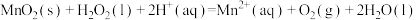
 ,写出反应Ⅰ的热化学方程式
,写出反应Ⅰ的热化学方程式_____ (焓变用 和
和 表示):。
表示):。
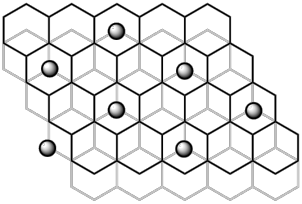
(5)单层石墨被称为石墨烯。最近有研究发现Li原子可以以可逆的方式渗入两层石墨烯的层间并规则分布,这是一种潜在的蓄电池材料。如图中所示为一种可能的结构,锂原子以黑球表示,请在图中画出这种材料的一个晶胞(以Li原子顶点)_____ ,并指出该材料中锂原子与碳原子的数量之比
_____ 。
(1)①下列说法不正确的是
A.因为二氧化硅的相对分子质量比二氧化碳大,所以沸点:
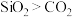
B.稳定性:
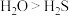 ,水分子更稳定的原因是水分子间存在氢键
,水分子更稳定的原因是水分子间存在氢键C.
 与CO为等电子体,结构相似
与CO为等电子体,结构相似②复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式为[
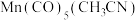 ],下列说法正确的是
],下列说法正确的是A.
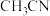 与Mn原子配位时,提供孤电子对的是C原子
与Mn原子配位时,提供孤电子对的是C原子B.Mn原子的配位数为6
C.
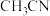 中C原子的杂化类型为
中C原子的杂化类型为 、
、
(2)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_____(填标号)。
A. | B. | C. | D. |
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(4)锰与镓同周期,
 催化
催化 分解:
分解: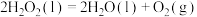
 ,其反应机理如图:
,其反应机理如图:
已知反应Ⅱ为:
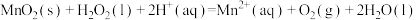
 ,写出反应Ⅰ的热化学方程式
,写出反应Ⅰ的热化学方程式 和
和 表示):。
表示):。(5)单层石墨被称为石墨烯。最近有研究发现Li原子可以以可逆的方式渗入两层石墨烯的层间并规则分布,这是一种潜在的蓄电池材料。如图中所示为一种可能的结构,锂原子以黑球表示,请在图中画出这种材料的一个晶胞(以Li原子顶点)
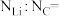

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】钛的化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:
(1)基态Ti原子的未成对电子数是______ ,基态Ti原子4s轨道上的一个电子激发到 4p轨道上形成激发态,写出该激发态价层电子排布式______ 。
(2)钛卤化物的熔点和沸点如下表所示,TiCl4、TiBr4、TiI4 熔沸点依次升高的原因是______ ;TiF4熔点反常的原因是______ 。
Ti可形成配合物[Ti(urea)6](ClO4)3, urea表示尿素,其结构如图所示:

(3)配合物中Ti化合价为______ 。
(4)尿素中C原子的杂化轨道类型为______ 。
(5) ClO 的立体构型为
的立体构型为______ 。
(6)如图为具有较高催化活性材料金红石的晶胞结构,其化学式为______ 。

(1)基态Ti原子的未成对电子数是
(2)钛卤化物的熔点和沸点如下表所示,TiCl4、TiBr4、TiI4 熔沸点依次升高的原因是
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | 377 | -24 | 38 | 150 |
沸点/℃ | —— | 136 | 230 | 377 |

(3)配合物中Ti化合价为
(4)尿素中C原子的杂化轨道类型为
(5) ClO
 的立体构型为
的立体构型为(6)如图为具有较高催化活性材料金红石的晶胞结构,其化学式为

您最近一年使用:0次



