已知可逆反应a A(g)+b B(?)⇌c C(g)△H>0(B物质的状态未确定).关于该反应的描述正确的是
| A.加压若平衡正向移动,则a>c |
| B.加入一定量的B,平衡一定正向移动 |
| C.缩小容器的体积,各物质的浓度一定增大 |
| D.升高温度,平衡一定正向移动,混合气体的平均摩尔质量的变化不能确定 |
更新时间:2016-12-09 16:54:57
|
【知识点】 化学平衡的移动及其影响因素
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】已知:
 ,一定条件下CO与H2O(g)反应的
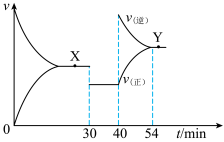
,一定条件下CO与H2O(g)反应的 图像如下。30 min、40 min时分别只改变一个条件。下列说法错误的是
图像如下。30 min、40 min时分别只改变一个条件。下列说法错误的是

 ,一定条件下CO与H2O(g)反应的
,一定条件下CO与H2O(g)反应的 图像如下。30 min、40 min时分别只改变一个条件。下列说法错误的是
图像如下。30 min、40 min时分别只改变一个条件。下列说法错误的是
A.平衡常数: | B.40 min时,增加CO2或H2的浓度 |
| C.30 min时,降低反应体系的温度 | D.CO转化率: |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】化学与生活、社会、科技和环境密切相关。下列说法不正确的是
| A.地下管道用导线连接锌块可以减缓管道的腐蚀 |
| B.打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释 |
| C.明矾常用作净水剂,是因为它能够消毒杀菌 |
| D.电器着火可用干粉灭火器灭火 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
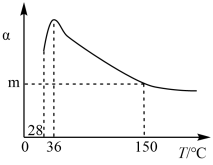
下列说法不正确的是

| 名称 | 熔点/℃ | 沸点/℃ | 燃烧热ΔH/kJ·mol-1 |
| 正戊烷 | -130 | 36 | -3506.1 |
| 异戊烷 | -159.4 | 27.8 | -3504.1 |
| A.25℃,101kPa时,正戊烷燃烧热的热化学反应方程式为:CH3CH2CH2CH2CH3(1)+8O2(g)=5CO2(g)+6H2O(g) △H=-3506.1kJ/mol |
| B.36~150℃时,随温度升高,正戊烷异构化反应的平衡常数减小 |
| C.150℃时,体系压强从100kPa升高到500kPa,正戊烷的平衡转化率基本不变 |
| D.28~36℃时,随温度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动 |
您最近一年使用:0次



