以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法有不同的冶炼方法。火法炼铜:将辉铜矿(Cu2S)在空气中高温焙烧即可得到铜和一种还原性的气体。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐。某工厂运用该原理生产铜和绿矾(FeSO4•7H2O)的工艺如下:
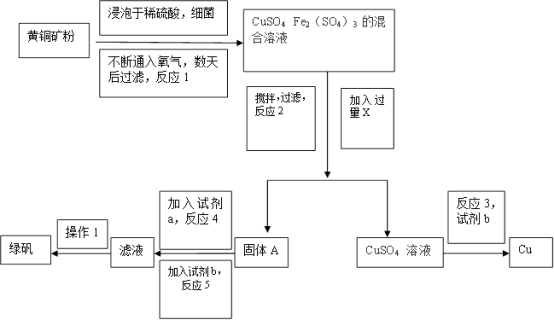
回答下列问题:
(1)火法炼铜发生的化学方程式:_________________________ ;
(2)湿发炼铜工艺流程中,为了提高酸浸时的进取率,本流程可采取的措施是________ ,试剂X为__________ ,其作用是_____________ 。
(3)试剂a为______________ ,试剂b为______________ ;
(4)配平反应1的化学方程式:____ CuFeS2+___ H2SO4+____ O2=____ CuSO4+____ Fe2(SO4)3+____ H2O
(5)已知:常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。加入过量的试剂X调节pH=4时,可使溶液中的Fe3+转化为Fe(OH)3沉淀,则溶液中的c(Fe3+)=___________ 。若要此时不出现Cu(OH)2沉淀,则溶液中的Cu2+浓度最大不超过_________________ 。

回答下列问题:
(1)火法炼铜发生的化学方程式:
(2)湿发炼铜工艺流程中,为了提高酸浸时的进取率,本流程可采取的措施是
(3)试剂a为
(4)配平反应1的化学方程式:
(5)已知:常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。加入过量的试剂X调节pH=4时,可使溶液中的Fe3+转化为Fe(OH)3沉淀,则溶液中的c(Fe3+)=
更新时间:2016-12-09 16:57:40
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】无水FeCl2为黄绿色晶体,在空气中易被氧化、易吸水,不溶于氯仿等有机溶剂。回答下列问题:
I.FeCl2的制备:
制备反应原理为2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
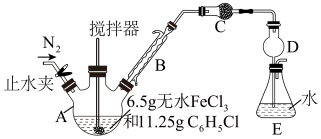
(1)仪器A的名称是___________ 。
(2)装置C中的试剂是______________________ (填化学式)。
II. 性质探究:将
性质探究:将 晶体配成溶液后进行如下实验。
晶体配成溶液后进行如下实验。
已知: 与
与 可在溶液中大量共存;
可在溶液中大量共存; 易被氧化为
易被氧化为 。
。
(3)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的 的浓度小;
的浓度小;
假设2:氯水氧化性强,___________ 。
取实验i中浅红色溶液,___________ (填实验操作),溶液浅红色消失,从而排除假设1;向 水中滴加
水中滴加 溶液,滴加
溶液,滴加 饱和氯水,加入
饱和氯水,加入___________ ,产生白色沉淀,说明假设2正确。
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是______________________ (用离子方程式表示,已知 中C元素为
中C元素为 价)。
价)。
I.FeCl2的制备:
制备反应原理为2FeCl3+C6H5Cl
 2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
(1)仪器A的名称是
(2)装置C中的试剂是
II.
 性质探究:将
性质探究:将 晶体配成溶液后进行如下实验。
晶体配成溶液后进行如下实验。序号 | 装置 | 试剂b | 试剂a | 实验现象 |
实验i |
|  溶液、 溶液、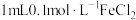 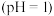 溶液 溶液 |
| 溶液立即变为浅红色 |
实验ii |
| 溶液变为红色,一段时间后,溶液褪为无色,且溶液中产生无色气泡,试管上方呈红棕色 |
 与
与 可在溶液中大量共存;
可在溶液中大量共存; 易被氧化为
易被氧化为 。
。(3)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的
 的浓度小;
的浓度小;假设2:氯水氧化性强,
取实验i中浅红色溶液,
 水中滴加
水中滴加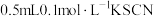 溶液,滴加
溶液,滴加 饱和氯水,加入
饱和氯水,加入(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是
 中C元素为
中C元素为 价)。
价)。
您最近一年使用:0次
【推荐2】黄钠铁矾[NaFe3(SO4)2(OH)6]是一种高效净水剂,Ni(OH)2可作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备黄钠铁矾和Ni(OH)2,工艺流程如图所示。

已知:①次磷酸钠(NaH2PO2)具有还原性;②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)“研磨”的目的是_______ ;
(2)为了提高“酸浸”的速率,最好使用“浓硫酸”代替“稀硫酸”,该做法_______ 正确(填“是”或“否”);
(3)“滤渣I”的主要成分为_______ ;
(4)“氧化”过程中发生反应的离子方程式为:_______ ;为了证明加入的NaClO3已足量,可取“氧化”后的溶液,向其中加入_______ 来检验(填标号)。
a.KSCN溶液 b.K3[Fe(CN)6]溶液 c.酸性KMnO4溶液
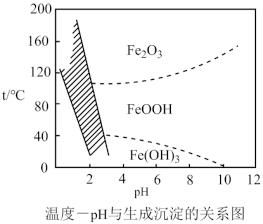
(5)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2,沉铁的最佳温度范围为_______ ;若反应在低于40℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是_______ 。
(6)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式_______ 。

已知:①次磷酸钠(NaH2PO2)具有还原性;②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)“研磨”的目的是
(2)为了提高“酸浸”的速率,最好使用“浓硫酸”代替“稀硫酸”,该做法
(3)“滤渣I”的主要成分为
(4)“氧化”过程中发生反应的离子方程式为:
a.KSCN溶液 b.K3[Fe(CN)6]溶液 c.酸性KMnO4溶液
(5)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2,沉铁的最佳温度范围为

(6)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】将金属纳米颗粒与铁氧体一起来制成复合物的研究逐渐成为热点。Fe/Fe3O4复合物材料在很多领域都具有应用。一种制取Fe/Fe3O4复合物的实验装置如图所示,实验过程如下:
步骤1:向三颈烧瓶中通入氮气,将10mLFeCl2溶液以2mL·min-1的速度滴入20mLKOH溶液中,控制温度为100℃,回流3h。
步骤2:待三颈烧瓶冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,40℃干燥,300℃焙烧,得Fe/Fe3O4复合物粗品。

(1)步骤1中反应生成了Fe和Fe3O4,该反应的离子方程式为___________ 。
(2)步骤2中用热水洗涤沉淀时,检验沉淀是否洗净的方法是___________ 。
(3)步骤2中用乙醇洗涤的目的是___________ 。
(4)步骤2中干燥、焙烧时,可能有部分Fe或Fe3O4被氧化为Fe2O3,为测定所得Fe/Fe3O4复合物粗品中Fe3O4的含量,现进行如下实验:准确称量0.4000g粗品,将粗品中的Fe分离出去,向剩余固体中加入足量稀H2SO4,待固体完全溶解后,将溶液转移至锥形瓶中,滴加2滴二苯胺磺酸钠溶液作指示剂,用0.01000mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL。
已知:Ⅰ.二苯胺磺酸钠溶液遇Fe2+显紫色,遇Fe3+不显色;
Ⅱ.Cr2O 可发生转化:Gr2O
可发生转化:Gr2O
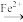 Cr3+。
Cr3+。
①滴定终点的现象是___________ 。
②计算粗品中Fe3O4的质量分数,并写出计算过程___________ 。
步骤1:向三颈烧瓶中通入氮气,将10mLFeCl2溶液以2mL·min-1的速度滴入20mLKOH溶液中,控制温度为100℃,回流3h。
步骤2:待三颈烧瓶冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,40℃干燥,300℃焙烧,得Fe/Fe3O4复合物粗品。

(1)步骤1中反应生成了Fe和Fe3O4,该反应的离子方程式为
(2)步骤2中用热水洗涤沉淀时,检验沉淀是否洗净的方法是
(3)步骤2中用乙醇洗涤的目的是
(4)步骤2中干燥、焙烧时,可能有部分Fe或Fe3O4被氧化为Fe2O3,为测定所得Fe/Fe3O4复合物粗品中Fe3O4的含量,现进行如下实验:准确称量0.4000g粗品,将粗品中的Fe分离出去,向剩余固体中加入足量稀H2SO4,待固体完全溶解后,将溶液转移至锥形瓶中,滴加2滴二苯胺磺酸钠溶液作指示剂,用0.01000mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL。
已知:Ⅰ.二苯胺磺酸钠溶液遇Fe2+显紫色,遇Fe3+不显色;
Ⅱ.Cr2O
 可发生转化:Gr2O
可发生转化:Gr2O
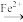 Cr3+。
Cr3+。①滴定终点的现象是
②计算粗品中Fe3O4的质量分数,并写出计算过程
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】钒铬还原渣是钠化提钒过程的固体废弃物,其主要成分为VO2·xH2O、Cr(OH)3及少量的SiO2.一种初步分离钒铬还原渣中钒铬并获得Na2Cr2O7的工艺流程如下:

已知:①“酸浸”后VO2·xH2O转化为VO2+;②Cr(OH)3的Ksp近似为1×10-30;③ 有关物质的溶解度(g/100 g H2O)如下表所示:
回答下列问题:
(1)“氧化”生成VO ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(2)若“含Cr3+净化液”中c(Cr3+)=0.1 mol/L,则“水解沉钒”调pH的范围是2.5~___________ 。
(3)“溶液1”中含CrO ,加入H2O2后发生反应的离子方程式为
,加入H2O2后发生反应的离子方程式为___________ ,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)经“多步操作”得两种晶体,则“多步操作”包括蒸发浓缩、___________ 、冷却结晶、过滤、洗涤等步骤。
(5)研究温度对Na2S2O8与H2O2的氧化—水解沉钒率的影响,得到如图所示结果。

钒铬还原渣酸浸液初始温度在90 ℃左右,降低温度能耗增加。由图可知,分别采用H2O2、Na2S2O8进行“氧化”时,应选择的适宜温度分别是___________ 、___________ ,与Na2S2O8相比,采用H2O2氧化的主要不足之处有___________ (写出两点)。

已知:①“酸浸”后VO2·xH2O转化为VO2+;②Cr(OH)3的Ksp近似为1×10-30;③ 有关物质的溶解度(g/100 g H2O)如下表所示:
| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
| Na2Cr2O7 | 183.6 | 215.1 | 269.2 | 376.4 | 415.0 |
| Na2SO4 | 19.5 | 48.8 | 45.3 | 43.7 | 42.5 |
回答下列问题:
(1)“氧化”生成VO
 ,发生反应的离子方程式为
,发生反应的离子方程式为(2)若“含Cr3+净化液”中c(Cr3+)=0.1 mol/L,则“水解沉钒”调pH的范围是2.5~
(3)“溶液1”中含CrO
 ,加入H2O2后发生反应的离子方程式为
,加入H2O2后发生反应的离子方程式为(4)经“多步操作”得两种晶体,则“多步操作”包括蒸发浓缩、
(5)研究温度对Na2S2O8与H2O2的氧化—水解沉钒率的影响,得到如图所示结果。

钒铬还原渣酸浸液初始温度在90 ℃左右,降低温度能耗增加。由图可知,分别采用H2O2、Na2S2O8进行“氧化”时,应选择的适宜温度分别是
您最近一年使用:0次
【推荐2】降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
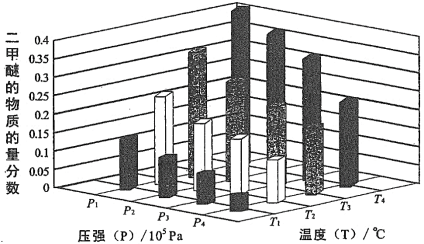
某温度下,将2.0 mol CO2(g) 和6.0 mol H2(g)充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质分数变化情况如图所示,则P1_______ P2(填“>”“<”或“=”,下同)。若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1________ K3,T1、P1时H2的平衡转化率为______________ 。
②在恒容密闭容器里按体积比为1∶3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是______ (填序号)。
A.反应物的浓度增大 B.混合气体的密度减小
C.正反应速率小于逆反应速率 D.氢气的转化率减小
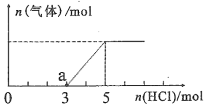
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量、产生的气体与加入盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:当加入HCl 的物质的量为1 mol时,溶液中所含溶质的化学式__________ ,a点溶液中各离子浓度由大到小的关系式为____________________________________ 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp = 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4 mol·L-1,则生成沉淀加入CaCl2溶液的最小浓度为___________ mol·L-1。
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g) + 6H2(g)
 CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1某温度下,将2.0 mol CO2(g) 和6.0 mol H2(g)充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质分数变化情况如图所示,则P1

②在恒容密闭容器里按体积比为1∶3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是
A.反应物的浓度增大 B.混合气体的密度减小
C.正反应速率小于逆反应速率 D.氢气的转化率减小
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量、产生的气体与加入盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:当加入HCl 的物质的量为1 mol时,溶液中所含溶质的化学式

(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp = 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4 mol·L-1,则生成沉淀加入CaCl2溶液的最小浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________ 。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH________ 7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为__________________________ 。(溶液混合时体积变化忽略,下同)
(3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(4)25℃时,amol/L氨水和0.01mol/L盐酸等体积混合充分反应后,c(NH4+)= c(Cl-)求一水合氨的电离常数K=_____________
(1)写出酸H2A的电离方程式
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH
(3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为
(4)25℃时,amol/L氨水和0.01mol/L盐酸等体积混合充分反应后,c(NH4+)= c(Cl-)求一水合氨的电离常数K=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室可用如图装置制备无水FeCl3。已知FeCl3易升华,易吸收水分而潮解。请回答下列问题:_______ 。
(2)装置A盛放浓盐酸的仪器名称是_______ ,其上口与烧瓶用导管相连的作用是_______ 。
(3)A装置中发生反应的离子方程式为_______ 。当加入一定量的浓盐酸与足量MnO2反应,实际生成的Cl2体积小于理论值的原因是_______ 。
(4)装置B的作用是_______ ,G中发生反应的离子方程式为_______ 。
(5)F中所装试剂为_______ ,目的是_______ 。

(2)装置A盛放浓盐酸的仪器名称是
(3)A装置中发生反应的离子方程式为
(4)装置B的作用是
(5)F中所装试剂为
您最近一年使用:0次
【推荐2】高铁酸钾(K2FeO4)是一种高效多功能的新型非氯消毒剂,易溶于水、微溶于浓碱溶液,不溶于乙醇,在0~5℃的强碱性溶液中较稳定,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
Ⅰ.湿法制备高铁酸钾。主要的生产流程如图所示:
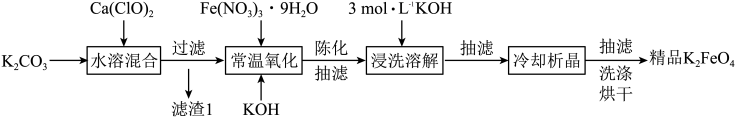
回答以下问题:
(1)滤渣1的主要成分为___________ (写化学式)。
(2)写出氧化过程的离子方程式___________ 。
(3)氧化时需控温20 ~ 25℃,温度不能高于25℃原因是___________ 。
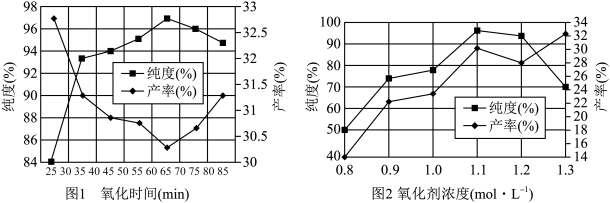
(4)实验测得氧化时间、氧化剂浓度与K2FeO4产率、纯度的实验数据分别如图1、图2所示。为了获取更纯的高铁酸钾,反应时间和氧化剂浓度应控制在___________ min,___________ mol·L−1。
Ⅱ.某兴趣小组在实验室模拟湿法制备K2FeO4,装置如图所示:
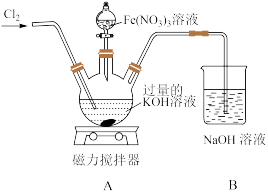
(5)向装置A中通入的Cl2不能过量,原因是___________ 。
(6)制备的高铁酸钾粗产品中含有KOH、KCl、Fe(OH)3等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和NaOH溶液、饱和KOH溶液、冷的稀KOH溶液、冰水)。
①取一定量的高铁酸钾粗产品溶于___________ ;
②过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;
③搅拌、静置、过滤,用___________ 洗涤2~3次,在真空干燥箱中干燥。
Ⅰ.湿法制备高铁酸钾。主要的生产流程如图所示:

回答以下问题:
(1)滤渣1的主要成分为
(2)写出氧化过程的离子方程式
(3)氧化时需控温20 ~ 25℃,温度不能高于25℃原因是
(4)实验测得氧化时间、氧化剂浓度与K2FeO4产率、纯度的实验数据分别如图1、图2所示。为了获取更纯的高铁酸钾,反应时间和氧化剂浓度应控制在

Ⅱ.某兴趣小组在实验室模拟湿法制备K2FeO4,装置如图所示:

(5)向装置A中通入的Cl2不能过量,原因是
(6)制备的高铁酸钾粗产品中含有KOH、KCl、Fe(OH)3等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和NaOH溶液、饱和KOH溶液、冷的稀KOH溶液、冰水)。
①取一定量的高铁酸钾粗产品溶于
②过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;
③搅拌、静置、过滤,用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】测定50mL0.50mol•L-1盐酸和50mL0.55mol•L-1NaOH溶液反应的反应热的实验装置如图所示。回答下列问题:
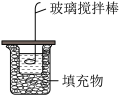
(1)图中缺少的一种仪器是____ 。
(2)实验时玻璃搅拌器的运动方向是____ (填标号)。
a.上下 b.左右 c.顺时针 d.逆时针
(3)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成的溶液的比热容c=4.18J/(g•℃)。实验记录数据如表:
则中和反应生成1molH2O(l)的△H=____ kJ•mol-1(保留1位小数)。若计算结果与理论数据(57.3kJ•mol-1)相比较,有误差,则可能导致该误差的原因是___ (填标号)。
a.实验装置保温、隔热效果差
b.用量筒量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸的起始温度后直接去测定NaOH溶液的温度
(4)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol•L-1稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为____ 。
(5)下列说法正确的是____ (填标号)。
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1molH2O时所测得的中和反应的反应热(△H)无影响

(1)图中缺少的一种仪器是
(2)实验时玻璃搅拌器的运动方向是
a.上下 b.左右 c.顺时针 d.逆时针
(3)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成的溶液的比热容c=4.18J/(g•℃)。实验记录数据如表:
| 实验序号 | 起始温度t1/℃ | 终止温度t1/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
a.实验装置保温、隔热效果差
b.用量筒量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸的起始温度后直接去测定NaOH溶液的温度
(4)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol•L-1稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为
(5)下列说法正确的是
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1molH2O时所测得的中和反应的反应热(△H)无影响
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计了两种实验方案:
方案一:
方案二: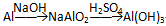
(1)从节约药品的角度思考,你认为哪一种方案好?_____________ ,方案一和方案二共同存在的问题是___________________
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。
方案一:

方案二:
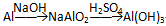
(1)从节约药品的角度思考,你认为哪一种方案好?
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
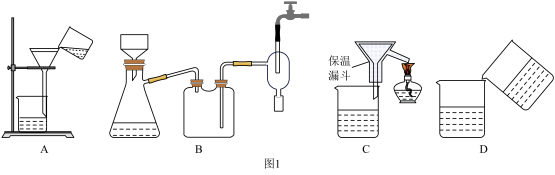
【推荐2】如图是工业上以制作印刷电路的废液 含
含 、
、 、
、 、
、 生产CuCl的流程:
生产CuCl的流程:
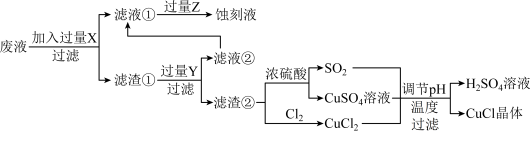
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为______ 。
(2)滤液②需要加过量Z,检验Z过量的方法是______ 。
(3)写出生成CuCl的离子方程式:______ 。
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置 图
图 中的
中的______  填选项字母
填选项字母 ,过滤后,洗涤CuCl的试剂宜选用
,过滤后,洗涤CuCl的试剂宜选用______  填“无水乙醇”或“稀硫酸”
填“无水乙醇”或“稀硫酸”
 加入饱和NaCl溶液中会部分溶解生成
加入饱和NaCl溶液中会部分溶解生成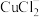 ,在一定温度下建立两个平衡:
,在一定温度下建立两个平衡:
I.CuCl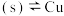
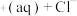
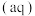
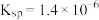
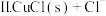
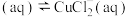
 。
。
(5)分析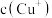 、
、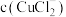 和
和 、K的数学关系,在图2中画出
、K的数学关系,在图2中画出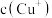 、
、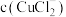 的关系曲线
的关系曲线________ (要求至少标出一个坐标点)
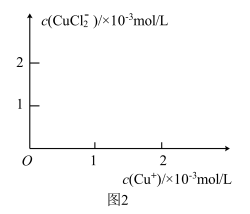
(6)氯化亚铜的定量分析:
①称取样品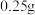 于250mL锥形瓶中,加入10mL过量的
于250mL锥形瓶中,加入10mL过量的 溶液,不断摇动:
溶液,不断摇动:
②待样品溶解后,加入20mL蒸馏水和2滴指示剂;
③立即用 硫酸铈标准溶液滴定至绿色为终点;
硫酸铈标准溶液滴定至绿色为终点;
④重复三次,消耗硫酸铈溶液的平均体积为 。
。
上述相应化学反应为 、
、 ,则样品中CuCl的纯度为
,则样品中CuCl的纯度为______  保留三位有效数字
保留三位有效数字 。
。
 含
含 、
、 、
、 、
、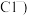 生产CuCl的流程:
生产CuCl的流程:
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为
(2)滤液②需要加过量Z,检验Z过量的方法是
(3)写出生成CuCl的离子方程式:
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置
 图
图 中的
中的 填选项字母
填选项字母 ,过滤后,洗涤CuCl的试剂宜选用
,过滤后,洗涤CuCl的试剂宜选用 填“无水乙醇”或“稀硫酸”
填“无水乙醇”或“稀硫酸”

 加入饱和NaCl溶液中会部分溶解生成
加入饱和NaCl溶液中会部分溶解生成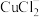 ,在一定温度下建立两个平衡:
,在一定温度下建立两个平衡:I.CuCl
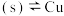
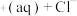
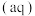
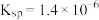
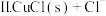
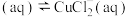
 。
。(5)分析
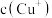 、
、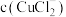 和
和 、K的数学关系,在图2中画出
、K的数学关系,在图2中画出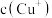 、
、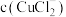 的关系曲线
的关系曲线
(6)氯化亚铜的定量分析:
①称取样品
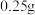 于250mL锥形瓶中,加入10mL过量的
于250mL锥形瓶中,加入10mL过量的 溶液,不断摇动:
溶液,不断摇动:②待样品溶解后,加入20mL蒸馏水和2滴指示剂;
③立即用
 硫酸铈标准溶液滴定至绿色为终点;
硫酸铈标准溶液滴定至绿色为终点;④重复三次,消耗硫酸铈溶液的平均体积为
 。
。上述相应化学反应为
 、
、 ,则样品中CuCl的纯度为
,则样品中CuCl的纯度为 保留三位有效数字
保留三位有效数字 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】葡萄糖酸亚铁【(C6H11O7)2Fe】是常用的补铁剂,易溶于水,几乎不溶于乙醇。葡萄糖酸亚铁的制备方法之一是由新制备的碳酸亚铁(白色固体,微溶于水)与葡萄糖酸反应而制得,其流程如下:
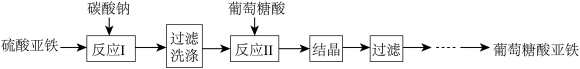
(1)用下图装置制备FeCO3

①仪器b的名称为_________ 。仪器a中橡胶管的作用是_______ 。
②反应开始时,先打开活塞K1和K3,关闭K2,目的是_______ 。一段时间后,关闭_______ ,打开______ ,目的是_______ 。
③将制得的FeCO3过滤、洗涤。检验沉淀已经洗涤干净的试剂为______ (若多种试剂,按试剂使用由先到后的顺序填写)。
④用NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,反应的离子方程式为________ 。
(2)反应II中加入过量葡萄糖酸使溶液显弱酸性,原因是________ 。
(3)葡萄糖酸亚铁结晶时需加入乙醇,目的是____________ 。

(1)用下图装置制备FeCO3

①仪器b的名称为
②反应开始时,先打开活塞K1和K3,关闭K2,目的是
③将制得的FeCO3过滤、洗涤。检验沉淀已经洗涤干净的试剂为
④用NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,反应的离子方程式为
(2)反应II中加入过量葡萄糖酸使溶液显弱酸性,原因是
(3)葡萄糖酸亚铁结晶时需加入乙醇,目的是
您最近一年使用:0次

 饱和氯水
饱和氯水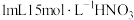 溶液
溶液

