N、P同属于元素周期表的第VA族元素。
(1)基态磷原子的价电子排布图是____________
(2)NCl3的VSEPR模型名称是__________ ,中心原子杂化轨道类型是__________________ 。
(3)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为原子总数相同、价电子总数相同的粒子即等电子体具有相似的化学键特征,它们的许多性质是接近的。写出N2O的一种有第二周期非金属元素组成的等电子体分子_______________________ 。
(4)沸点比较:PH3___________ NH3(填“>”、“=”、“<”),理由是____________ 。
(5)已知键能:H-H键能为436kJ·mol-1,N-H键能为391kJ·mol-1,N≡N键能为945.6kJ•mol-1。则N2+3H2 2NH3,生成2molNH3时,共放热
2NH3,生成2molNH3时,共放热_________ kJ
(6)NH3极易溶于水,原因是_______________
(1)基态磷原子的价电子排布图是
(2)NCl3的VSEPR模型名称是
(3)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为原子总数相同、价电子总数相同的粒子即等电子体具有相似的化学键特征,它们的许多性质是接近的。写出N2O的一种有第二周期非金属元素组成的等电子体分子
(4)沸点比较:PH3
(5)已知键能:H-H键能为436kJ·mol-1,N-H键能为391kJ·mol-1,N≡N键能为945.6kJ•mol-1。则N2+3H2
 2NH3,生成2molNH3时,共放热
2NH3,生成2molNH3时,共放热(6)NH3极易溶于水,原因是
更新时间:2016-12-09 17:03:19
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】原子结构与元素周期表存在着内在联系。根据已学知识,请你回答下列问题:
(1)指出31号元素镓(Ga)在元素周期表中的位置:___________ (写明第几周期第几族)。
(2)第3周期元素的基态原子与基态Cu原子未成对电子数相同,且电负性最大的元素是___________ 。
(3)在P区中,第2周期VA族元素原子电子的轨道表示式为:___________ 。
(4)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:___________ 。
(5)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:___________ 。
(6)写出3p轨道上有2个未成对电子的元素符号:___________ 。
(7)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为:___________ 。
(1)指出31号元素镓(Ga)在元素周期表中的位置:
(2)第3周期元素的基态原子与基态Cu原子未成对电子数相同,且电负性最大的元素是
(3)在P区中,第2周期VA族元素原子电子的轨道表示式为:
(4)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:
(5)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:
(6)写出3p轨道上有2个未成对电子的元素符号:
(7)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】砷化铝(AlAs)常用作光谱分析试剂和制备电子组件的原料,是一种新型半导体材料。回答下列问题:
(1)基态As原子的核外价电子排布图为_______ ;第一电离能I1(As)_______ I1(Se) (填“大于”或“小于”),其原因是_______ 。
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为_______ ;分子中As、S原子的杂化轨道类型分别为_______ 、_______ 。
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是_______ 、_______ 。
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为_______ ;该晶体密度为ρ g·cm-3,设NA为阿伏加德罗常数的值,晶胞参数为_______ pm。

(1)基态As原子的核外价电子排布图为
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】有A、B、C、D、E、F六种前四周期元素,原子序数A<B<C<D<E<F。A原子只有一个电子层且只含1个电子;B、C两元素的基态原子具有相同能级,且I1(B)>I1(C),其中基态B原子的2p轨道上有3个未成对电子;D原子s电子数比p电子数少4;E原子的3p轨道上得到1个电子后不能再容纳外来电子;F为周期表前四周期中电负性最小的元素。
(1)写出下列元素的元素符号:
C___________ F_____________
(2)写出E元素原子的价电子轨道表示式___________________
(3)B、C两元素原子的电负性大小: B_______ C(填“<”或“>”)
(4)A2C与A2D的熔沸点:A2C_______ A2D (填“<”或“>”)
(5)A、C两元素按原子个数比为1:1结合成的化合物化学式为_____________
(6)BA3的中心原子杂化方式为______ 杂化,该化合物的空间构型为_____________ .
(1)写出下列元素的元素符号:
C
(2)写出E元素原子的价电子轨道表示式
(3)B、C两元素原子的电负性大小: B
(4)A2C与A2D的熔沸点:A2C
(5)A、C两元素按原子个数比为1:1结合成的化合物化学式为
(6)BA3的中心原子杂化方式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】中国科学家参与的国际阿伏加德罗组织以高纯单晶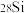 为样品高精度地测定了NA。
为样品高精度地测定了NA。
Ⅰ.高纯单晶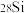 的制备流程如下
的制备流程如下
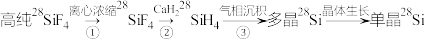
(1)写出基态Si原子的电子排布式_______ 。
(2) 分子的空间构型是
分子的空间构型是_______ 。
(3)写出反应②的化学方程式_______ 。
(4)③中发生分解反应,判断 分解温度
分解温度_______ (填“大于”或“小于”) 的分解温度,理由是
的分解温度,理由是_______ 。
Ⅱ. NA的测定
(5)单晶硅的晶胞结构如图所示,X射线衍射测定其边长为acm。
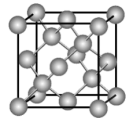
还需要测定的物理量有:硅的相对原子质量A、宏观硅球的质量mg和体积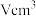 以及缺陷修正值δ(晶胞内实际原子数=理论原子数
以及缺陷修正值δ(晶胞内实际原子数=理论原子数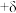 )。用上述物理量列出NA的计算表达式
)。用上述物理量列出NA的计算表达式_______ 。
 为样品高精度地测定了NA。
为样品高精度地测定了NA。Ⅰ.高纯单晶
 的制备流程如下
的制备流程如下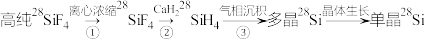
(1)写出基态Si原子的电子排布式
(2)
 分子的空间构型是
分子的空间构型是(3)写出反应②的化学方程式
(4)③中发生分解反应,判断
 分解温度
分解温度 的分解温度,理由是
的分解温度,理由是Ⅱ. NA的测定
(5)单晶硅的晶胞结构如图所示,X射线衍射测定其边长为acm。

还需要测定的物理量有:硅的相对原子质量A、宏观硅球的质量mg和体积
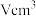 以及缺陷修正值δ(晶胞内实际原子数=理论原子数
以及缺陷修正值δ(晶胞内实际原子数=理论原子数 )。用上述物理量列出NA的计算表达式
)。用上述物理量列出NA的计算表达式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】芯片是国家科技的心脏。在硅及其化合物上进行蚀刻是芯片制造中非常重要的环节。三氟化氮(NF3)、四氟化碳(CF4)是常见的蚀刻剂。
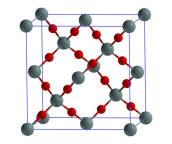
(1)高纯三氟化氮对二氧化硅具有优异的蚀刻速率和选择性。
①二氧化硅的晶胞结构如图所示,二氧化硅晶体中硅原子周围最近的硅原子有_______ 个。
②工业上常采用F2直接氟化尿素[CO(NH2)2]的方法生产NF3。得到的NF3中常含有少量CF4。常温下,三种物质在水中的溶解性大小顺序为:CF4<NF3<NH3,原因是_______ 。
(2)四氟化碳的一种蚀刻机理是:CF4在等离子体的条件下产生活性自由基(▪F),该自由基易与硅及其化合物中的硅原子结合生成SiF4气体从而达到蚀刻目的。用CF4(g)进行蚀刻时常与氧气混合,当混合气体的流速分别为80mL·min-1和100mL·min-1时,蚀刻速率随混合气体中O2和CF4体积之比[V(O2)/V(CF4)]的变化如图所示。
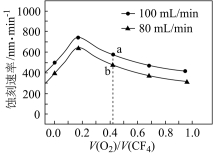
①a点蚀刻速率比b点快的原因是_______ 。
②蚀刻速率随V(O2)/V(CF4)先升高后降低的原因是_______ 。
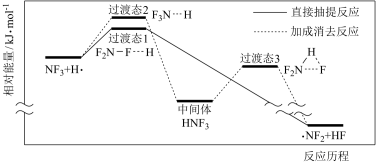
(3)NF3是一种强温室气体,消除大气中的 NF3对于环境保护具有重要意义。国内某科研团队研究了利用氢自由基(·H)的脱氟反应实现NF3的降解。降解生成·NF2和HF的两种反应历程如图所示。其中直接抽提反应是降解的主要历程,原因是_______ 。
(1)高纯三氟化氮对二氧化硅具有优异的蚀刻速率和选择性。
①二氧化硅的晶胞结构如图所示,二氧化硅晶体中硅原子周围最近的硅原子有

②工业上常采用F2直接氟化尿素[CO(NH2)2]的方法生产NF3。得到的NF3中常含有少量CF4。常温下,三种物质在水中的溶解性大小顺序为:CF4<NF3<NH3,原因是
(2)四氟化碳的一种蚀刻机理是:CF4在等离子体的条件下产生活性自由基(▪F),该自由基易与硅及其化合物中的硅原子结合生成SiF4气体从而达到蚀刻目的。用CF4(g)进行蚀刻时常与氧气混合,当混合气体的流速分别为80mL·min-1和100mL·min-1时,蚀刻速率随混合气体中O2和CF4体积之比[V(O2)/V(CF4)]的变化如图所示。

①a点蚀刻速率比b点快的原因是
②蚀刻速率随V(O2)/V(CF4)先升高后降低的原因是
(3)NF3是一种强温室气体,消除大气中的 NF3对于环境保护具有重要意义。国内某科研团队研究了利用氢自由基(·H)的脱氟反应实现NF3的降解。降解生成·NF2和HF的两种反应历程如图所示。其中直接抽提反应是降解的主要历程,原因是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】含硼、氮、磷、铜、锌的化合物有许多重要用途。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____ ;基态Cu+的核外电子排布式为___ 。
(2)化合物(CH3)3N能溶于水的原因是______ 。
(3)亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为____ 。
(4)Zn2+可与CN-、二苯硫腙( )等形成稳定配合物。
)等形成稳定配合物。
①CN- 的结构式为_____ 。
②每个二苯硫腙分子中,采取sp2杂化的原子有__ 个。
(5)卤化锌的熔点如表所示:
ZnF2的熔点远高于其它三种卤化锌,其原因为_____ 。
(6)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:
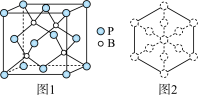
①磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑____ 。
②已知磷化硼晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,则B—P键长为___ pm(列出计算式即可)。
(1)基态B原子电子占据最高能级的电子云轮廓图为
(2)化合物(CH3)3N能溶于水的原因是
(3)亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为
(4)Zn2+可与CN-、二苯硫腙(
 )等形成稳定配合物。
)等形成稳定配合物。①CN- 的结构式为
②每个二苯硫腙分子中,采取sp2杂化的原子有
(5)卤化锌的熔点如表所示:
| ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
| 熔点/℃ | 872 | 275 | 394 | 446 |
(6)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:

①磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑
②已知磷化硼晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,则B—P键长为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】现有四种短周期元素A、B、C、D。已知:①C、D位于同一周期,A、B位于同一主族;②四种元素可以组成化合物 、
、 、
、 、
、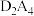 等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④
等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④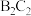 与
与 或
或 反应均能生成气体
反应均能生成气体 ,B的单质与
,B的单质与 反应可生成气体
反应可生成气体 ,气体
,气体 与气体
与气体 混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
(1)写出下列元素的符号:A_______ 、B_______ 、C_______ 、D_______ 。
(2)在化合物 、
、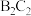 、
、 和
和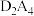 中,既含有离子键又含有非极性共价键的化合物的电子式为
中,既含有离子键又含有非极性共价键的化合物的电子式为_______ ,按原子轨道重叠方式,其非极性键的类型是_______ σ键;化合物分子中键角为180°的是_______ (填化学式),其结构式是_______ 。
(3) 分子的空间结构是
分子的空间结构是_______ 形,其键角_______ (填“>”“<”或“=”)180°;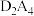 是平面形分子,其分子中含有
是平面形分子,其分子中含有_______ 个σ键,_______ 个π键。
 、
、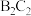 、
、 、
、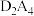 等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④
等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④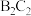 与
与 或
或 反应均能生成气体
反应均能生成气体 ,B的单质与
,B的单质与 反应可生成气体
反应可生成气体 ,气体
,气体 与气体
与气体 混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:(1)写出下列元素的符号:A
(2)在化合物
 、
、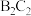 、
、 和
和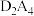 中,既含有离子键又含有非极性共价键的化合物的电子式为
中,既含有离子键又含有非极性共价键的化合物的电子式为(3)
 分子的空间结构是
分子的空间结构是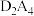 是平面形分子,其分子中含有
是平面形分子,其分子中含有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】JohnB.Goodenough等三位科学家因在发展锂离子电池方面做出的贡献而获得了诺贝尔化学奖。回答下列问题:
(1)锰酸锂(LiMn2O4)电池具有原料成本低合成工艺简单等优点。原子中运动的电子有两种相反的身旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为___________ 。基态Mn原子核外价层电子的运动状态有___________ 种。
(2)锂离子电池的电解液一般为溶有LiPF6的碳酸酯类有机溶剂,LiPF6遇水反应生成PF3和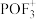 ,
,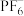 中心原子的价层电子对数为
中心原子的价层电子对数为___________ ,POF3的空间构型为___________ 。
(3)已知第三电离能数据:I3(Mn)=3246kJ·mol-1,I3(Fe)=2957kJ·mol-1.锰的第三电离能大于铁的第三电离能,其主要原因是___________ 。
(4)铋化锂被认为是很有潜力的正极材料,晶胞结构如图所示。
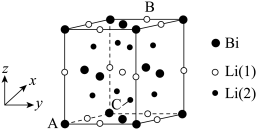
①晶胞可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处,晶体的化学式为___________ 。
②图中原子坐标参数:A为(0,0,0),B为(1,0.5,1),则C的坐标为___________ ,Bi与Li(1)和Li(2)之间的最短距离的比为___________ 。
(1)锰酸锂(LiMn2O4)电池具有原料成本低合成工艺简单等优点。原子中运动的电子有两种相反的身旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为(2)锂离子电池的电解液一般为溶有LiPF6的碳酸酯类有机溶剂,LiPF6遇水反应生成PF3和
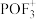 ,
,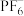 中心原子的价层电子对数为
中心原子的价层电子对数为(3)已知第三电离能数据:I3(Mn)=3246kJ·mol-1,I3(Fe)=2957kJ·mol-1.锰的第三电离能大于铁的第三电离能,其主要原因是
(4)铋化锂被认为是很有潜力的正极材料,晶胞结构如图所示。

①晶胞可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处,晶体的化学式为
②图中原子坐标参数:A为(0,0,0),B为(1,0.5,1),则C的坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】电极活性物质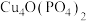 的制备,可通过下列反应制备:
的制备,可通过下列反应制备: 。
。
(1)上述反应涉及的元素中不属于元素周期表p区元素的是___________ ,写出基态 的电子排布式
的电子排布式___________ 。
(2)P、S元素第一电离能大小关系为P___________ S(填“>”、“<”或“=”),原因是___________ 。
(3)O的原子核外有___________ 种不同能量的电子,其氢化物沸点高于同族元素H2S的原因是___________ 。
(4)CuSO4溶液中逐滴加入氨水,先产生蓝色沉淀,后又溶解得到深蓝色溶液 ,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是
,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是___________ 。
A.该物质正离子的中心是Cu原子 B.该配合物的配体数等于配位数
C.外界离子的中心原子的杂化方式为sp3 D.乙醇的作用是将配合物转化为
写出沉淀溶解生成深蓝色溶液的离子方程式___________ 。
(5)①在硫酸铜溶液中加入过量KCN,生成配合物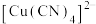 ,则1 mol该配合物含π键的数目为
,则1 mol该配合物含π键的数目为___________ 。
②画出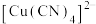 的结构:
的结构:___________ (用“→”或“—”将配位键表示出来)。
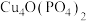 的制备,可通过下列反应制备:
的制备,可通过下列反应制备: 。
。(1)上述反应涉及的元素中不属于元素周期表p区元素的是
 的电子排布式
的电子排布式(2)P、S元素第一电离能大小关系为P
(3)O的原子核外有
(4)CuSO4溶液中逐滴加入氨水,先产生蓝色沉淀,后又溶解得到深蓝色溶液
 ,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是
,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是A.该物质正离子的中心是Cu原子 B.该配合物的配体数等于配位数
C.外界离子的中心原子的杂化方式为sp3 D.乙醇的作用是将配合物转化为

写出沉淀溶解生成深蓝色溶液的离子方程式
(5)①在硫酸铜溶液中加入过量KCN,生成配合物
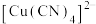 ,则1 mol该配合物含π键的数目为
,则1 mol该配合物含π键的数目为②画出
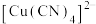 的结构:
的结构:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】半导体芯片的发明促进了人类信息技术的发展,单晶硅。砷化镓(GaAs)、碳化硅等是制作半导体芯片的关键材料,也是我国优先发展的新材料。请回答以下问题:
(1)上述材料所涉及的四种元素中电负性最小的元素是___________ (填元素符号),基态砷原子价层电子的轨道表达式为___________ ,和As位于同一周期,且未成对电子数也相同的元素还有___________ 种。
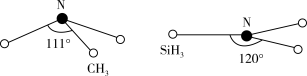
(2)SiCl4是生产高纯硅的前驱体,沸点57.6°C,可混溶于苯、氯仿等有机溶剂,则SiCl4晶体类型为___________ 。,熔化时克服的作用力是___________ 其中Si采取的杂化类型为___________ 化合物N(CH3)3和N(SiH3)3的结构如上图所示,更易形成配合物的是___________ ,判断理由是___________ 。
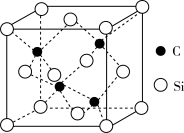
(3)β-SiC的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为pg∙cm-3,晶胞中4个C构成的空间构型为___________ ,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为___________ 。(用含a、b、p、NA的代数式表示,NA、表示阿伏加德罗常数的值)。
(1)上述材料所涉及的四种元素中电负性最小的元素是
(2)SiCl4是生产高纯硅的前驱体,沸点57.6°C,可混溶于苯、氯仿等有机溶剂,则SiCl4晶体类型为

(3)β-SiC的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为pg∙cm-3,晶胞中4个C构成的空间构型为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
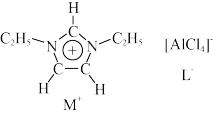
【推荐2】离子液体是一种由离子构成的很有研究价值的溶剂。某离子液体由如图所示正离子 和负离子
和负离子 构成,已知
构成,已知 中的五元环为平面形结构,该离子有较强的稳定性。
中的五元环为平面形结构,该离子有较强的稳定性。
(1)基态N原子中共有_______ 种运动状态不同的电子,其中占据最高能级的电子云轮廓图为_______ 形。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为_______ 。
(2) 中的各种元素的电负性由小到大的顺序为
中的各种元素的电负性由小到大的顺序为_______ , 中碳原子的杂化方式为
中碳原子的杂化方式为_______ 。
(3)负离子 的空间构型为
的空间构型为_______ 形,基态氯原子的价层电子轨道表示式为_______ 。
(4)分子中的大 键可用符号
键可用符号 表示,其中m代表形成大
表示,其中m代表形成大 键的原子数,n代表形成大
键的原子数,n代表形成大 键的电子数。如苯(
键的电子数。如苯( )中的大
)中的大 键可表示为
键可表示为 ,则
,则 中的大
中的大 键可表示为
键可表示为_______ 。
(5)碳原子与氮原子还可形成六元环状化合物吡啶(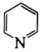 ),其分子中也含有与苯类似的
),其分子中也含有与苯类似的 大
大 键,则吡啶中N原子的孤电子对占据的轨道为
键,则吡啶中N原子的孤电子对占据的轨道为_______ (填标号)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D. 杂化轨道
杂化轨道
吡啶在水中的溶解度远大于苯,主要原因是①_______ ,②_______ 。
 和负离子
和负离子 构成,已知
构成,已知 中的五元环为平面形结构,该离子有较强的稳定性。
中的五元环为平面形结构,该离子有较强的稳定性。
(1)基态N原子中共有
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(2)
 中的各种元素的电负性由小到大的顺序为
中的各种元素的电负性由小到大的顺序为 中碳原子的杂化方式为
中碳原子的杂化方式为(3)负离子
 的空间构型为
的空间构型为(4)分子中的大
 键可用符号
键可用符号 表示,其中m代表形成大
表示,其中m代表形成大 键的原子数,n代表形成大
键的原子数,n代表形成大 键的电子数。如苯(
键的电子数。如苯( )中的大
)中的大 键可表示为
键可表示为 ,则
,则 中的大
中的大 键可表示为
键可表示为(5)碳原子与氮原子还可形成六元环状化合物吡啶(
 ),其分子中也含有与苯类似的
),其分子中也含有与苯类似的 大
大 键,则吡啶中N原子的孤电子对占据的轨道为
键,则吡啶中N原子的孤电子对占据的轨道为A.2s轨道 B.2p轨道 C.sp杂化轨道 D.
 杂化轨道
杂化轨道吡啶在水中的溶解度远大于苯,主要原因是①
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】I.氮(N)、磷(P)、砷(As)等第VA族元素的单质和化合物在科研与生产中有许多重要用途。回答下列问题:
(1)基态砷原子的价电子排布式为_________ ,电负性:As_________ S(填“>”“=”或“<”)。
(2) 中N原子的杂化方式是
中N原子的杂化方式是_________ 杂化。
(3) 、聚乙二醇、
、聚乙二醇、 、
、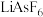 和
和 等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。
等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。
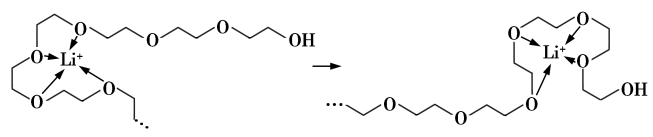
从化学键角度看,Li+迁移过程发生_________ (填“物理”或“化学”)变化。
II.铂钴合金在磁控、仪表等领域有重要用途。回答下列问题:
(4)Pt与Cl、吡啶(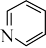 )能形成如图所示两种分子。
)能形成如图所示两种分子。
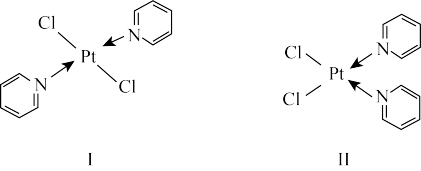
①1mol吡啶中含有σ键的数目为_________ 。
②相同条件下,化合物Ⅱ在水中溶解度比化合物Ⅰ更大的原因为_________ 。
(5)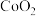 是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
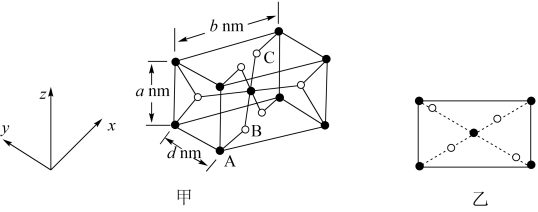
①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0)。则C原子的坐标参数为_________ 。
②若阿伏加德罗常数的值为NA,则晶体密度为_________ g·cm−3(列出计算表达式)。
(1)基态砷原子的价电子排布式为
(2)
 中N原子的杂化方式是
中N原子的杂化方式是(3)
 、聚乙二醇、
、聚乙二醇、 、
、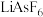 和
和 等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。
等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。
从化学键角度看,Li+迁移过程发生
II.铂钴合金在磁控、仪表等领域有重要用途。回答下列问题:
(4)Pt与Cl、吡啶(
 )能形成如图所示两种分子。
)能形成如图所示两种分子。
①1mol吡啶中含有σ键的数目为
②相同条件下,化合物Ⅱ在水中溶解度比化合物Ⅰ更大的原因为
(5)
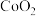 是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0)。则C原子的坐标参数为
②若阿伏加德罗常数的值为NA,则晶体密度为
您最近一年使用:0次



