(Ⅰ)50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________ 。

(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”),所放出的热量________ (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会______ (填“偏大”、“偏小”或“无影响”).
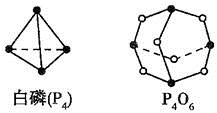
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能: :
: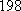 kJ·mol-1,
kJ·mol-1, :
: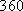 kJ·mol-1,
kJ·mol-1,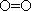 :
: kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为__________________ 。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式___________________ 。
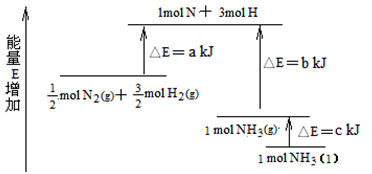
(7)化学反应N2+3H2 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是______________ 。
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出

(2)在测定中和热的实验中,计算反应热时需要的数据有
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能:
 :
: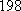 kJ·mol-1,
kJ·mol-1, :
: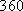 kJ·mol-1,
kJ·mol-1,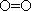 :
: kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式
(7)化学反应N2+3H2
 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
更新时间:2017-02-23 21:26:50
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定实验。
Ⅰ.配制0.50mol/LNaOH溶液
(1)若实验中需要用225mLNaOH溶液,至少需称量NaOH固体___________ g。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
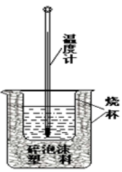
(2)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和___________ 。碎泡沫塑料的作用是___________ 。
(3)写出该反应的热化学方程式(中和热ΔH为-57.3kJ/mol):___________
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=___________ (取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___________ 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
Ⅰ.配制0.50mol/LNaOH溶液
(1)若实验中需要用225mLNaOH溶液,至少需称量NaOH固体
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(2)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和
(3)写出该反应的热化学方程式(中和热ΔH为-57.3kJ/mol):
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
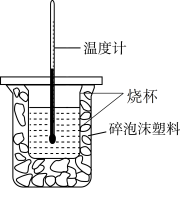
【推荐2】50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。实验数据如下表:
近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。
请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________ 。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值___________ (填“偏大” “偏小”或“无影响”)。则中和热ΔH=___________ (取小数点后一位)。
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |

近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。
请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)大烧杯上如不盖硬纸板,则求得的中和热数值
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
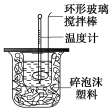
【推荐3】利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是_________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__________
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒上下轻轻地抽动
(3)实验数据如下表:
①根据表中数据计算出来温度差的平均值为______ ℃;
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_______ ( 取小数点后一位)。
③上述实验数值结果与中和热为57.3 kJ/mol有偏差,产生偏差的原因可能是____ 。
a.实验装置保温、隔热效果差 b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 c.量取NaOH溶液的体积时仰视读数 d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中

①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒上下轻轻地抽动
(3)实验数据如下表:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=
③上述实验数值结果与中和热为57.3 kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差 b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 c.量取NaOH溶液的体积时仰视读数 d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
您最近一年使用:0次
【推荐1】CO2可用于合成多种化工原料。用 CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
(1)反应A的平衡常数表达式是_________ 。
(2)已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH2
H2O(g)=H2O(l) ΔH3
ΔH1不易直接测得,为了通过ΔH2和ΔH3计算得到ΔH1,还需测定如下反应的反应热:_______ 。
(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。
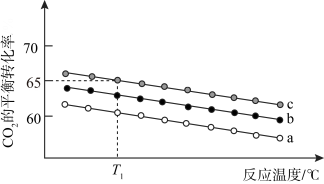
①反应 A 的ΔH1________ 0(填“>”或“<”)。
②曲线 c 对应的投料是_________ 。
③T1℃时,曲线c 对应的化学平衡常数_________ 1(填“>”、“<”或“=”)。
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。
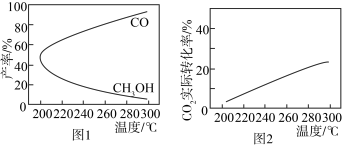
由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_______ 。
(1)反应A的平衡常数表达式是
(2)已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH2
H2O(g)=H2O(l) ΔH3
ΔH1不易直接测得,为了通过ΔH2和ΔH3计算得到ΔH1,还需测定如下反应的反应热:
(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。

①反应 A 的ΔH1
②曲线 c 对应的投料是
③T1℃时,曲线c 对应的化学平衡常数
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。

由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】请回答下列问题:
(1)已知: 时,
时,
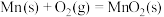

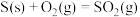
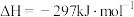


 与
与 反应生成无水
反应生成无水 的热化学方程式是
的热化学方程式是______________ ,
请画出该反应的能量变化示意图:______________
(2)海洋中有丰富的食品、矿产、能源、药物、和水产资源等(如图所示):
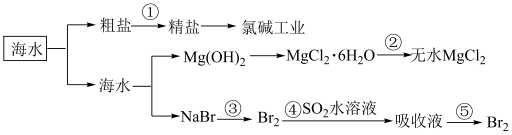
①淡化海水的方法有______________ (写一种合理方法即可)
②第③步、第⑤步均通入 氧化
氧化 ,反复多次,实验目的是为了
,反复多次,实验目的是为了______________
③由海水提溴过程中的反应可得出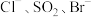 还原性由强到弱的顺序是
还原性由强到弱的顺序是______________
(3)微生物脱盐电池是一种高效、经济的能源装置.利用微生物处理有机废水,可获得电能,同时实现海水淡化.现以 溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含
溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含 的溶液为例).
的溶液为例).
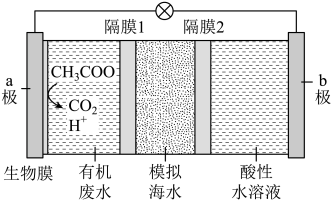
①a极为该电池的______________ ,发生的电极反应式为______________
②为了实现海水的淡化,模拟海水中的氯离子需要移向______________ 极(填“a”或“b”),隔膜2为______________ 交换膜(填“阳离子”或“阴离子”)
③当电路中转移 电子时,模拟海水理论上除盐
电子时,模拟海水理论上除盐______________ g
(1)已知:
 时,
时,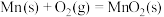

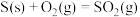
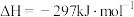


 与
与 反应生成无水
反应生成无水 的热化学方程式是
的热化学方程式是请画出该反应的能量变化示意图:

(2)海洋中有丰富的食品、矿产、能源、药物、和水产资源等(如图所示):

①淡化海水的方法有
②第③步、第⑤步均通入
 氧化
氧化 ,反复多次,实验目的是为了
,反复多次,实验目的是为了③由海水提溴过程中的反应可得出
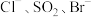 还原性由强到弱的顺序是
还原性由强到弱的顺序是(3)微生物脱盐电池是一种高效、经济的能源装置.利用微生物处理有机废水,可获得电能,同时实现海水淡化.现以
 溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含
溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含 的溶液为例).
的溶液为例).
①a极为该电池的
②为了实现海水的淡化,模拟海水中的氯离子需要移向
③当电路中转移
 电子时,模拟海水理论上除盐
电子时,模拟海水理论上除盐
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1) 肼(N2H4)是火箭推进器中常用的高能燃料,已知0.4mol液态肼和足量H2O2反应,生成N2和水蒸气,放出256.65kJ的热量,请写出该反应的热化学方程式:__________________________ 。
(2) 工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)
已知在25℃时: C(石墨)+ O2(g)=CO(g) △H1=-111kJ·mol-1
O2(g)=CO(g) △H1=-111kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H2=-242kJ·mol-1
O2(g)=H2O(g) △H2=-242kJ·mol-1
C(石墨)+O2(g)=CO2(g) △H3=-394kJ·mol-1
试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热△H=________ kJ·mol-1
(3) 高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+Fe(OH)3+4KOH,该电池放电时正极反应式为____________ 。
(4) 用该电池电解 100mL1mol·L-1的AgNO3溶液,写出电解反应方程式:____________________ 。当电路中通过0.01mol电子时,被电解溶液的pH为________ (溶液体积变化忽略不计)。
(2) 工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)
已知在25℃时: C(石墨)+
 O2(g)=CO(g) △H1=-111kJ·mol-1
O2(g)=CO(g) △H1=-111kJ·mol-1H2(g)+
 O2(g)=H2O(g) △H2=-242kJ·mol-1
O2(g)=H2O(g) △H2=-242kJ·mol-1C(石墨)+O2(g)=CO2(g) △H3=-394kJ·mol-1
试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热△H=
(3) 高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+Fe(OH)3+4KOH,该电池放电时正极反应式为
(4) 用该电池电解 100mL1mol·L-1的AgNO3溶液,写出电解反应方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_______________________________________________________________
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。

①实验时所需要的玻璃仪器除烧杯、量筒外还需要:_________ 。
②该装置中有一处错误是:______________________ ,
(3)用相同浓度和体积的氨水(NH3· H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会________ (填“偏大”、“偏小”或“无影响”)。
Ⅱ.(1)已知充分燃烧一定质量的丁烷(C4H10)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示丁烷燃烧热的热化学方程式为______________________
(2)已知下列热化学方程式:
C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
请写出C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学方程式____________________
(3)已知几种共价键的键能数据如下表:
写出合成氨反应的热化学方程式: ____________________________________ 。
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。

①实验时所需要的玻璃仪器除烧杯、量筒外还需要:
②该装置中有一处错误是:
(3)用相同浓度和体积的氨水(NH3· H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
Ⅱ.(1)已知充分燃烧一定质量的丁烷(C4H10)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示丁烷燃烧热的热化学方程式为
(2)已知下列热化学方程式:
C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
请写出C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学方程式
(3)已知几种共价键的键能数据如下表:
| 共价键 | N≡N | H—H | N—H |
| 键能 (kJ/mol) | 946 | 436 | 390.8 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)下图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
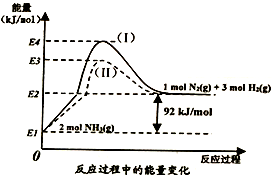
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为__________________________ 。
②过程(I)和过程(Ⅱ)的反应热__________ (填“相同”或“不同”),原因是_______________ 。
③一定温度下,在容积为1L的密闭容器中充入1 mol N2(g)、3molH2(g),达到平衡时,混合气体的总量为2.8 mol,则该条件下反应 N2(g)+3H2(g) 2NH3(g)的平衡常数为
2NH3(g)的平衡常数为__________ ,H2的平衡转化率为__________________________ 。
(2)用NH3可以消除氮氧化物的污染,已知:
反应I:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H1= a kJ/mol
2N2(g)+6H2O(g) △H1= a kJ/mol
反应Ⅱ:N2(g)+O2(g) 2NO(g) △H2= b kJ/mol
2NO(g) △H2= b kJ/mol
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H3= c kJ/mol
5N2(g)+6H2O(g) △H3= c kJ/mol
则:反应Ⅱ中的b=______ kJ/mol(用含a、c的代数式表示),反应Ⅲ中的△S________ 0(填“>”“<”或“=”)。
(3)在恒容的密闭容器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图:
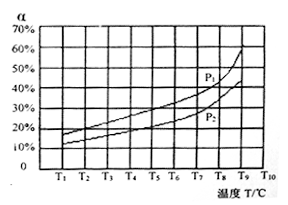
①分析得P1_________ P2 (填“>”“<”或“=”)。
②下列叙述中,不能判断反应Ⅲ已经达到平衡状态的标志是__________ (填序号)。
a. N2的浓度不再改变 b.断裂6molN-H键的同时,有6molH-O键形成
C.容器中压强不再变化 d.混合气体的密度保持不变
(1)下图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:

①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为
②过程(I)和过程(Ⅱ)的反应热
③一定温度下,在容积为1L的密闭容器中充入1 mol N2(g)、3molH2(g),达到平衡时,混合气体的总量为2.8 mol,则该条件下反应 N2(g)+3H2(g)
 2NH3(g)的平衡常数为
2NH3(g)的平衡常数为(2)用NH3可以消除氮氧化物的污染,已知:
反应I:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H1= a kJ/mol
2N2(g)+6H2O(g) △H1= a kJ/mol反应Ⅱ:N2(g)+O2(g)
 2NO(g) △H2= b kJ/mol
2NO(g) △H2= b kJ/mol反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H3= c kJ/mol
5N2(g)+6H2O(g) △H3= c kJ/mol则:反应Ⅱ中的b=
(3)在恒容的密闭容器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图:

①分析得P1
②下列叙述中,不能判断反应Ⅲ已经达到平衡状态的标志是
a. N2的浓度不再改变 b.断裂6molN-H键的同时,有6molH-O键形成
C.容器中压强不再变化 d.混合气体的密度保持不变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】已知存在下列热化学方程式:
①氢气燃烧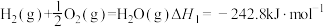
②太阳光分解水制氢气2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6kJ·mol−1
③液态水转化为水蒸气H2O(l)=H2O(g) ΔH3=_____kJ·mol−1
回答下列问题:
(1)从能量转化角度分析,反应①为_____ 反应(填“吸热”或“放热”)。
(2)若在反应②中使用催化剂,ΔH2_____ (填“增大”“减小”或“不变”)。
(3)写出反应③的热化学方程式_____ 。
(4)有机物M经过太阳光光照可转化成N,转化过程如下。
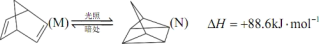
则M的化学式为_____ ,M、N相比,较稳定的是_____ (填“M”或“N”)。
(5)已知CH3OH(l)的燃烧热为238.6kJmol1,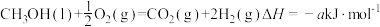 ,则a
,则a_____ 238.6(填“>”“<”或“=”)。
(6)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:_____ 。
(7)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,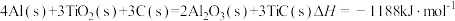 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为_____ 。
(8)已知:
①
②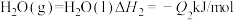
③ (
(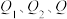 均大于0)
均大于0)
若要使32g液态甲醇完全燃烧,则最后恢复到室温,放出的热量为_____ kJ。
①氢气燃烧
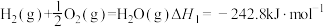
②太阳光分解水制氢气2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6kJ·mol−1
③液态水转化为水蒸气H2O(l)=H2O(g) ΔH3=_____kJ·mol−1
回答下列问题:
(1)从能量转化角度分析,反应①为
(2)若在反应②中使用催化剂,ΔH2
(3)写出反应③的热化学方程式
(4)有机物M经过太阳光光照可转化成N,转化过程如下。

则M的化学式为
(5)已知CH3OH(l)的燃烧热为238.6kJmol1,
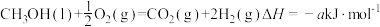 ,则a
,则a(6)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:
(7)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
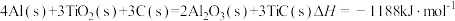 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为(8)已知:
①

②
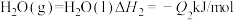
③
 (
(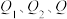 均大于0)
均大于0)若要使32g液态甲醇完全燃烧,则最后恢复到室温,放出的热量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】近年随着现代工业的发展,二氧化氮的排放量大增,二氧化氮对臭氧空洞的形成起着重要作用,同时还是光化学烟雾和酸雨的成因之一。如何实现二氧化氮的转化利用成为了科学家研究的课题。回答下列问题:
(1) 催化
催化 生成
生成 的过程可分为三步:
的过程可分为三步:
第一步: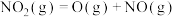 :
:
第三步: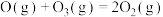 。
。
则第二步的反应方程式为_______ 。
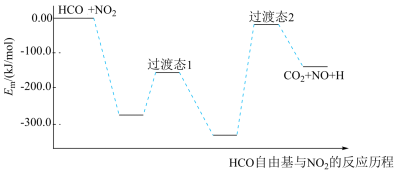
(2)科学家测得HCO自由基还原二氧化氮的反应机理如图所示,两种过渡态物质相比,_______ (填“过渡态1”或“过渡态2”)较稳定,该反应分_______ 步进行,决定该反应速率的是第_______ 步。
(3)科学家尝试采用焦炭还原法消除二氧化氮污染,反应原理为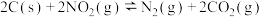 ,在2L恒容密闭容器中加入足量的碳和2mol
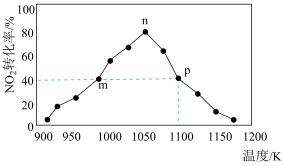
,在2L恒容密闭容器中加入足量的碳和2mol  气体,相同时间内测得二氧化氮的转化率随温度变化如图所示,图中m、n、p三点平衡常数由大到小的顺序为
气体,相同时间内测得二氧化氮的转化率随温度变化如图所示,图中m、n、p三点平衡常数由大到小的顺序为_______ ,p点化学反应平衡常数为_______ (计算结果保留两位小数)。
(4)工业上采用CO还原 生成两种大气成分消除污染,若完全还原2mol
生成两种大气成分消除污染,若完全还原2mol  时该反应的正反应活化能为
时该反应的正反应活化能为 ,逆反应活化能为
,逆反应活化能为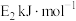 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:_______ 。下列关于该反应的说法正确的是_______ (填选项字母)。
A.恒温恒压下,体系内混合气体密度不随时间变化时,反应达到平衡状态
B.恒温恒容下,平衡后,充入惰性气体, 的平衡转化率增大
的平衡转化率增大
C.恒温恒压下,再按照原比例加入相同量的反应物, 的平衡转化率增大
的平衡转化率增大
D.及时分离出 ,逆反应速率减小,正反应速率增大,平衡正向移动
,逆反应速率减小,正反应速率增大,平衡正向移动
(1)
 催化
催化 生成
生成 的过程可分为三步:
的过程可分为三步:第一步:
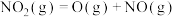 :
:第三步:
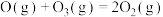 。
。则第二步的反应方程式为
(2)科学家测得HCO自由基还原二氧化氮的反应机理如图所示,两种过渡态物质相比,

(3)科学家尝试采用焦炭还原法消除二氧化氮污染,反应原理为
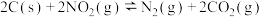 ,在2L恒容密闭容器中加入足量的碳和2mol
,在2L恒容密闭容器中加入足量的碳和2mol  气体,相同时间内测得二氧化氮的转化率随温度变化如图所示,图中m、n、p三点平衡常数由大到小的顺序为
气体,相同时间内测得二氧化氮的转化率随温度变化如图所示,图中m、n、p三点平衡常数由大到小的顺序为
(4)工业上采用CO还原
 生成两种大气成分消除污染,若完全还原2mol
生成两种大气成分消除污染,若完全还原2mol  时该反应的正反应活化能为
时该反应的正反应活化能为 ,逆反应活化能为
,逆反应活化能为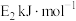 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:A.恒温恒压下,体系内混合气体密度不随时间变化时,反应达到平衡状态
B.恒温恒容下,平衡后,充入惰性气体,
 的平衡转化率增大
的平衡转化率增大C.恒温恒压下,再按照原比例加入相同量的反应物,
 的平衡转化率增大
的平衡转化率增大D.及时分离出
 ,逆反应速率减小,正反应速率增大,平衡正向移动
,逆反应速率减小,正反应速率增大,平衡正向移动
您最近一年使用:0次
【推荐2】为实现“碳达峰”及“碳中和”,二氧化碳甲烷化技术是 循环再利用最有效的技术之一
循环再利用最有效的技术之一
(1)二氧化碳甲烷化时发生的反应为: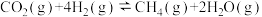
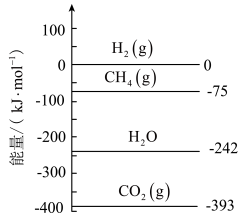
①298K时,已知相关物质的相对能量如图,则该反应的
___________  。
。
②能判断该过程反应已达化学平衡状态的标志是___________ (填标号)。
A. 体积分数保持不变
体积分数保持不变
B.容器中混合气体的质量保持不变
C.混合气体的平均相对分子质量保持不变
D. 的生成速率与
的生成速率与 的生成速率相等
的生成速率相等
③有利于提高体系中 平衡转化率的措施是
平衡转化率的措施是___________ (填标号)。
A.使用高效催化剂 B.增加 投入量
投入量
C.延长反应时间 D.及时分离
(2)催化剂的选择是 甲烷化的核心,金属Ni或
甲烷化的核心,金属Ni或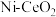 均可作为催化剂。反应相同时间,测得
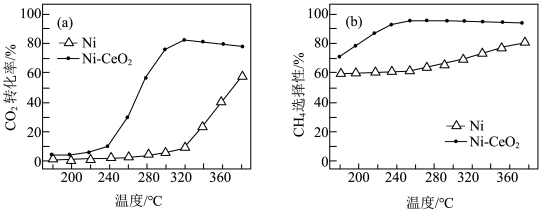
均可作为催化剂。反应相同时间,测得 转化率和
转化率和 选择性随温度的变化如图所示。高于320℃,以
选择性随温度的变化如图所示。高于320℃,以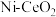 为催化剂,
为催化剂, 转化率略有下降,而以Ni为催化剂,
转化率略有下降,而以Ni为催化剂, 转化率却仍在上升,其原因是
转化率却仍在上升,其原因是___________ 。( 的选择性公式:
的选择性公式: 的选择性
的选择性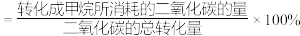 )
)
(3) 甲烷化发生反应
甲烷化发生反应 ,由于该反应存在副反应,反应的
,由于该反应存在副反应,反应的 不能100%转化为
不能100%转化为 ,生成的
,生成的 须依据
须依据 的选择性公式进行计算。某温度,在体积为2L的恒容密闭容器中加入1mol
的选择性公式进行计算。某温度,在体积为2L的恒容密闭容器中加入1mol 和4mol
和4mol ,10min后达到平衡,
,10min后达到平衡, 的平衡转化率和
的平衡转化率和 的选择性分别为80%、90%,则
的选择性分别为80%、90%,则 的反应速率为
的反应速率为___________ 。
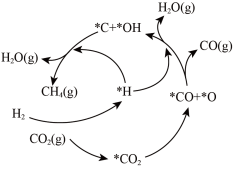
(4) 催化
催化 加
加 生成
生成 的反应历程如图所示(吸附在催化剂表面的物种用*标注),则发生的副反应的方程式为
的反应历程如图所示(吸附在催化剂表面的物种用*标注),则发生的副反应的方程式为___________ 。
(5) 的晶胞结构如图所示:
的晶胞结构如图所示:
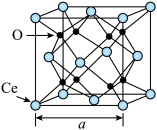
①Ce的配位数为___________ 。
②若高温下该晶胞中1个氧原子变为空位,需___________ 个面心上的Ce由+4价变为+3价(顶点上的Ce化合价不变)。
 循环再利用最有效的技术之一
循环再利用最有效的技术之一(1)二氧化碳甲烷化时发生的反应为:
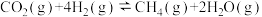
①298K时,已知相关物质的相对能量如图,则该反应的

 。
。
②能判断该过程反应已达化学平衡状态的标志是
A.
 体积分数保持不变
体积分数保持不变B.容器中混合气体的质量保持不变
C.混合气体的平均相对分子质量保持不变
D.
 的生成速率与
的生成速率与 的生成速率相等
的生成速率相等③有利于提高体系中
 平衡转化率的措施是
平衡转化率的措施是A.使用高效催化剂 B.增加
 投入量
投入量C.延长反应时间 D.及时分离

(2)催化剂的选择是
 甲烷化的核心,金属Ni或
甲烷化的核心,金属Ni或 均可作为催化剂。反应相同时间,测得
均可作为催化剂。反应相同时间,测得 转化率和
转化率和 选择性随温度的变化如图所示。高于320℃,以
选择性随温度的变化如图所示。高于320℃,以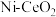 为催化剂,
为催化剂, 转化率略有下降,而以Ni为催化剂,
转化率略有下降,而以Ni为催化剂, 转化率却仍在上升,其原因是
转化率却仍在上升,其原因是 的选择性公式:
的选择性公式: 的选择性
的选择性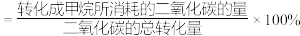 )
)
(3)
 甲烷化发生反应
甲烷化发生反应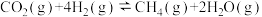 ,由于该反应存在副反应,反应的
,由于该反应存在副反应,反应的 不能100%转化为
不能100%转化为 ,生成的
,生成的 须依据
须依据 的选择性公式进行计算。某温度,在体积为2L的恒容密闭容器中加入1mol
的选择性公式进行计算。某温度,在体积为2L的恒容密闭容器中加入1mol 和4mol
和4mol ,10min后达到平衡,
,10min后达到平衡, 的平衡转化率和
的平衡转化率和 的选择性分别为80%、90%,则
的选择性分别为80%、90%,则 的反应速率为
的反应速率为(4)
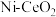 催化
催化 加
加 生成
生成 的反应历程如图所示(吸附在催化剂表面的物种用*标注),则发生的副反应的方程式为
的反应历程如图所示(吸附在催化剂表面的物种用*标注),则发生的副反应的方程式为
(5)
 的晶胞结构如图所示:
的晶胞结构如图所示:
①Ce的配位数为
②若高温下该晶胞中1个氧原子变为空位,需
您最近一年使用:0次
【推荐3】随着现代工业的发展和人们生活水平的提高,大气中氮氧化物污染越来越多,如何处理氮氧化物污染,变废为宝成为当前研究的主要课题。请回答下列问题:
(1)已知:在25℃、101kPa下,由最稳定的单质生成1mol物质的反应焓变,叫作该物质的标准摩尔生成焓,规定稳定单质的标准摩尔生成焓为0.下表为常见几种物质的标准摩尔生成焓的数值。
则反应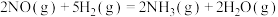

___________ kJ·mol-1,该反应在___________ (填“低温”“高温”或“任何温度”)下能够自发进行。
(2)工业上常用甲烷消除氮氧化物的污染,生成物为常见的大气成分,在两种不同温度下(T1,T2均大于100℃),向2L固定体积的密闭容器中分别加入0.8molCH4、1.4molNO2和催化剂,测得甲烷物质的量随反应时间的变化如图所示:___________ T2 (填“>”“<”或“=”),该反应的正反应为___________ (填“吸热”或“放热”)反应。
②温度为T2时,0~20min内用NO2表示的平均反应速率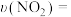
___________ mol·L-1·min-1。
③T2时,该反应的正反应化学平衡常数数值为___________ 。
(3)为了减少汽车尾气的污染,科学家设计在排气管中安装一种高效催化剂,反应原理为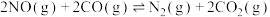 。
。
①在恒温、恒容密闭容器中进行上述反应,下列能表明反应达到平衡状态的是___________ (填标号)。
A.
B.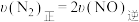
C.混合气体的密度不随时间变化
D.混合气体的平均摩尔质量不随时间变化
②若将上述反应设计为原电池,则通入CO的电极名称为___________ ;NO电极在酸性条件下的电极反应式为___________ 。
(1)已知:在25℃、101kPa下,由最稳定的单质生成1mol物质的反应焓变,叫作该物质的标准摩尔生成焓,规定稳定单质的标准摩尔生成焓为0.下表为常见几种物质的标准摩尔生成焓的数值。
| 物质 |  |  |  |  |  |
| 标准摩尔生成焓/(kJ·mol-1) | 91.3 | -241.8 | 0 | -46.0 | 50.6 |
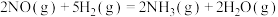

(2)工业上常用甲烷消除氮氧化物的污染,生成物为常见的大气成分,在两种不同温度下(T1,T2均大于100℃),向2L固定体积的密闭容器中分别加入0.8molCH4、1.4molNO2和催化剂,测得甲烷物质的量随反应时间的变化如图所示:
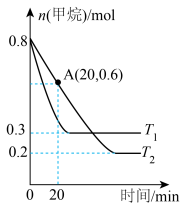
②温度为T2时,0~20min内用NO2表示的平均反应速率
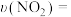
③T2时,该反应的正反应化学平衡常数数值为
(3)为了减少汽车尾气的污染,科学家设计在排气管中安装一种高效催化剂,反应原理为
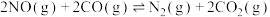 。
。①在恒温、恒容密闭容器中进行上述反应,下列能表明反应达到平衡状态的是
A.

B.
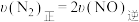
C.混合气体的密度不随时间变化
D.混合气体的平均摩尔质量不随时间变化
②若将上述反应设计为原电池,则通入CO的电极名称为
您最近一年使用:0次



