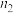(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
①反应速率最大的(即0 min~1 min、1 min~2 min、2 min~3 min、3 min~4 min、4 min~
5 min)时间段为____________ ,原因是_____________________ 。②反应速率最小的时间段为____________ ,原因是________________________ 。
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入以下物质以减缓反应速率:
A.蒸馏水 B.更加细小的锌粒 C.NaCl溶液
你认为他的做法可行的是______ (填相应字母);做法不可行的理由是______ 。
| 时间 (min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
①反应速率最大的(即0 min~1 min、1 min~2 min、2 min~3 min、3 min~4 min、4 min~
5 min)时间段为
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入以下物质以减缓反应速率:
A.蒸馏水 B.更加细小的锌粒 C.NaCl溶液
你认为他的做法可行的是
更新时间:2017-05-08 19:50:44
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】用纯净的锌粒与100mL2mol/L稀盐酸反应制取氢气,请回答:
(1)实验过程如下图所示,图中

(2)为了加快上述反应的速率,欲向溶液中加入少量下列物质,你认为可行的是
A蒸馏水 B氯化铜固体 C氯化钠溶液 D浓盐酸
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】对于反应3X(g)+Y(g)⇌2Z(g)在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”)
(1)升高温度:_______ ;
(2)增大压强:_______ ;
(3)增大容器容积:_______ ;
(4)加入X:_______ ;
(5)加入Y:_______ ;
(6)压缩体积:_______ 。
(1)升高温度:
(2)增大压强:
(3)增大容器容积:
(4)加入X:
(5)加入Y:
(6)压缩体积:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是先将TiO2转化为TiCl4,再进一步还原得到钛。以下是碳氯化法制备TiCl4:TiO2(s)+2Cl2(g)+2C(s)⇌TiCl4(g)+2CO(g) △H=-51kJ/mol(放热反应)。
(1)对于该反应:增大压强,平衡_______ 移动(填“正向”、“不”或“逆向”);温度升高,平衡转化率_______ (填“变大”、“变小”或“不变”)。
(2)恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是_______。
(3)在200℃达到平衡时,TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因可能是________________________ 。
(4)在某温度下,该恒容体系已经达到平衡,若向其中加入少量炭,TiCl4的体积分数将__________ ;若加入少量氯气,TiCl4的体积分数将__________ 。
A.减少 B.不变 C.增大
(1)对于该反应:增大压强,平衡
(2)恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是_______。
| A.混合气体的压强保持不变 | B.2v正(Cl2)=v逆(TiCl4) |
| C.混合气体的密度保持不变 | D.Cl2和CO物质的量相等 |
(4)在某温度下,该恒容体系已经达到平衡,若向其中加入少量炭,TiCl4的体积分数将
A.减少 B.不变 C.增大
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】(1)把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示。
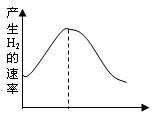
在反应过程中导致速率变化的因素有__________
①H+的浓度②镁条的表面积③溶液的温度④Cl—的浓度
(2)影响速率的有关因素有:物质本身的性质、浓度、温度、催化剂等方面,依据影响速率的有关因素分析下列问题:
①Mg和Fe均可以与O2反应, Mg在空气中可以点燃, Fe在空气中不能点燃,是由于_________ 的影响;
②Fe在空气中加热不能燃烧,但在纯氧中可以,是由于_________ 的影响;

在反应过程中导致速率变化的因素有
①H+的浓度②镁条的表面积③溶液的温度④Cl—的浓度
(2)影响速率的有关因素有:物质本身的性质、浓度、温度、催化剂等方面,依据影响速率的有关因素分析下列问题:
①Mg和Fe均可以与O2反应, Mg在空气中可以点燃, Fe在空气中不能点燃,是由于
②Fe在空气中加热不能燃烧,但在纯氧中可以,是由于
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有___________ 。
(2)硫酸铜溶液可以加快氢气生成速率的原因是___________ 。
(3)现有 、
、 、
、 、
、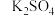 4种溶液,可与实验中
4种溶液,可与实验中 溶液起相似作用的是
溶液起相似作用的是___________ 。
(4)要加快上述实验中气体产生的速率,还可采取的措施有___________ (答两种)。
(1)上述实验中发生反应的化学方程式有
(2)硫酸铜溶液可以加快氢气生成速率的原因是
(3)现有
 、
、 、
、 、
、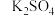 4种溶液,可与实验中
4种溶液,可与实验中 溶液起相似作用的是
溶液起相似作用的是(4)要加快上述实验中气体产生的速率,还可采取的措施有
您最近一年使用:0次

 的总量
的总量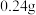
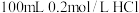 溶液
溶液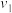

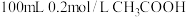 溶液
溶液