有四种物质的量浓度相等且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液。据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解 的盐是
| A.BX | B.AY | C.AX | D.BY |
11-12高三上·山东潍坊·阶段练习 查看更多[12]
陕西省渭南市华州区咸林中学2023-2024学年高二上学期第二次月考化学试卷(已下线)BBWYhjhx1108.pdf天津市天津中学2022-2023学年高二上学期期中测试化学试题北京市首都师范大学附属中学2021-2022学年高二上学期10月月考化学试题福建省莆田第十五中学2018-2019学年高二下学期期中测试化学试题山西省沁源县第一中学2020-2021学年高二下学期开学考试化学试题宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题(已下线)2012届山东省潍坊市寿光现代中学高三12月月考化学试卷(已下线)2014年高考化学一轮复习课后规范训练8-3练习卷宁夏石嘴山市第三中学2016-2017学年高二下学期期中考试化学试题河南省林州市第一中学2016-2017学年高二5月调研考试化学试题2016-2017学年福建省泉州市南安第一中学高二下学期第一次阶段考试(3月)化学试卷
更新时间:2017-05-05 18:35:51
|
【知识点】 盐类水解规律理解及应用解读
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】以下为探究铝片(未打磨)与 溶液的反应。
溶液的反应。
下列说法正确的是
 溶液的反应。
溶液的反应。| 实验 | 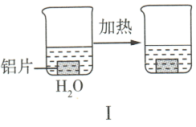 | 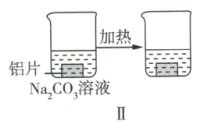 |
| 现象 | 无明显现象 | ①加热前,铝片表面产生细小气泡; ②加热后,溶液中出现白色浑浊,产生大量气泡(经检验为  和 和 ) ) |
A. 溶液中存在水解平衡 溶液中存在水解平衡 |
B.推测出现白色浑浊的原因为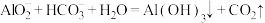 |
C.对比Ⅰ、Ⅱ,说明 溶液能破坏铝表面的氧化膜 溶液能破坏铝表面的氧化膜 |
D.加热和 逸出对 逸出对 水解平衡移动方向的影响是相反的 水解平衡移动方向的影响是相反的 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个 |
| B.在电解精炼铜的过程中,当转移NA个电子时阳极溶解32g |
| C.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA |
| D.只含0.1molNa2CO3的溶液中,所含阴离子总数大于0.1NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】部分弱电解质的电离平衡常数如下表,以下选项错误的是
| 化学式 | NH3·H2O | CH3COOH | HCN | H2CO3 |
| Ki(25℃) | 1.8×l0-5 | 1.8×l0-5 | 4.9×l0-10 | Ki1= 4.3×l0-7 Ki2= 5.6×l0-11 |
| A.等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大 |
| B.0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4溶液显中性 |
| C.CN-+H2O+CO2=HCN+ HCO3- |
| D.中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者 |
您最近一年使用:0次



