三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
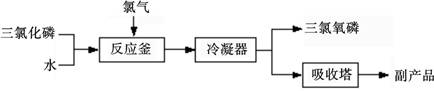
(1)请写出氯化水解法生产三氯氧磷的化学方程式____ 。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)的废水,已知H3PO3是一种易溶于水的二元弱酸。
①用化学方程式表示废水中含有H3PO4的原因:____
②写出H3PO3与过量NaOH溶液反应的离子方程式:____ 。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是____ 。
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=____ mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
(3)通过实验可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定时如选用NH4Fe(SO4)2作指示剂,则滴定终点时的现象是____ 。
②下列滴定操作会使所测Cl元素含量偏大的是____
A.滴定前未向锥形瓶中加入硝基苯
B.滴定前仰视,滴定后俯视
C.滴定管在滴液前有气泡,滴定后无气泡
D.滴定前向锥形瓶中加入少量水

(1)请写出氯化水解法生产三氯氧磷的化学方程式
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)的废水,已知H3PO3是一种易溶于水的二元弱酸。
①用化学方程式表示废水中含有H3PO4的原因:
②写出H3PO3与过量NaOH溶液反应的离子方程式:
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=
(3)通过实验可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定时如选用NH4Fe(SO4)2作指示剂,则滴定终点时的现象是
②下列滴定操作会使所测Cl元素含量偏大的是
A.滴定前未向锥形瓶中加入硝基苯
B.滴定前仰视,滴定后俯视
C.滴定管在滴液前有气泡,滴定后无气泡
D.滴定前向锥形瓶中加入少量水
2017·四川遂宁·一模 查看更多[2]
更新时间:2017-11-30 11:14:19
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室测定水体中氯离子含量,实验过程如下:向水样中加入 溶液作指示剂,用
溶液作指示剂,用 溶液滴定至终点。已知:
溶液滴定至终点。已知: 为不溶于水的砖红色沉淀;常温下
为不溶于水的砖红色沉淀;常温下 ,
, 。回答下列问题:
。回答下列问题:
(1)滴定时,应使用___________ (填“酸式”或“碱式”)滴定管。
(2)滴定达到终点的判断标志是___________ 。
(3)实验过程中测得数据如下表:
计算水样中氯离子的含量为___________ 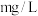 (保留2位小数)。
(保留2位小数)。
(4)滴定结束后,溶液中的残余 ,则此时溶液中
,则此时溶液中
___________  。
。
(5)下列情况会造成实验测定结果偏低的是___________。(填字母)
 溶液作指示剂,用
溶液作指示剂,用 溶液滴定至终点。已知:
溶液滴定至终点。已知: 为不溶于水的砖红色沉淀;常温下
为不溶于水的砖红色沉淀;常温下 ,
, 。回答下列问题:
。回答下列问题:(1)滴定时,应使用
(2)滴定达到终点的判断标志是
(3)实验过程中测得数据如下表:
| 编号 | 1 | 2 | 3 |
 (水样) (水样) | 10.00 | 10.00 | 10.00 |
 | 3.75 | 4.01 | 3.99 |
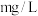 (保留2位小数)。
(保留2位小数)。(4)滴定结束后,溶液中的残余
 ,则此时溶液中
,则此时溶液中
 。
。(5)下列情况会造成实验测定结果偏低的是___________。(填字母)
| A.锥形瓶洗涤后未干燥 |
| B.滴定前,未使用标准液润洗滴定管 |
| C.滴定管滴定前仰视读数,滴定后俯视读数 |
| D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】NCM是三元锂电池最重要的前驱体材料,一种以镍钴杂料(主要成分为 、
、 、
、 ,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
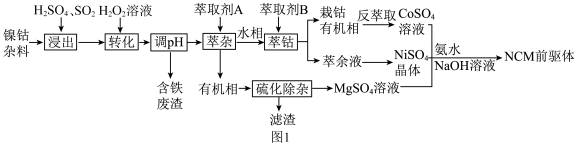
回答下列问题:
(1)基态钴原子核外未成对电子数与基态锰原子核外未成对电子数之比为___________ 。
(2)为提高“浸出”效率,可采取的措施有___________ (写出一条即可);“浸出”过程中 的作用是
的作用是___________ (用离子方程式表示)。
(3)常温下,若“转化”后的溶液中 浓度为
浓度为 ,在“调
,在“调 ”过程中,当
”过程中,当 调节到2.2时,开始出现
调节到2.2时,开始出现 沉淀,若要使
沉淀,若要使 完全沉淀,则调节溶液
完全沉淀,则调节溶液 最小为
最小为___________ [已知:当c(Fe3+)≤1×10-5mol/L时,认为 沉淀完全]
沉淀完全]
(4)有机萃取剂P204和P507对金属离子的萃取率与pH的关系如图2、图3所示。
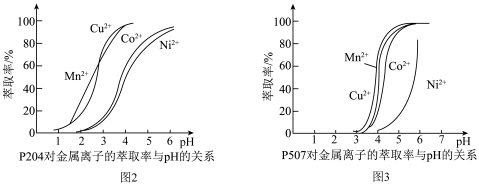
①萃取剂A是___________ (填“P204”或“P507”,下同),萃取剂B是___________ 。
②进行“萃钴”操作前,需对水相调pH至___________ (填标号),以达到最佳萃取 的效果。
的效果。
a.2.5 b.3.5 c.4.5 d.5.5
③萃取剂萃取 的原理为2HR(有机相)
的原理为2HR(有机相)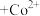 (水相)
(水相)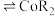 (有机相)
(有机相) (水相),则反萃取操作中可向载钴有机相中加入
(水相),则反萃取操作中可向载钴有机相中加入___________ (填试剂名称)得到含 的溶液;一定条件下,萃取平衡时,溶液中
的溶液;一定条件下,萃取平衡时,溶液中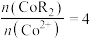 ,则
,则 的萃取率为
的萃取率为___________ 。
(5)一种NiAs晶体结构如图4所示。
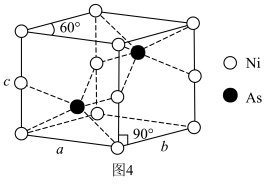
通过X射线光谱测算出该晶胞参数为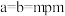 ,
,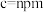 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为___________ (填含m、n和 的表达式)
的表达式) 。
。
 、
、 、
、 ,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
回答下列问题:
(1)基态钴原子核外未成对电子数与基态锰原子核外未成对电子数之比为
(2)为提高“浸出”效率,可采取的措施有
 的作用是
的作用是(3)常温下,若“转化”后的溶液中
 浓度为
浓度为 ,在“调
,在“调 ”过程中,当
”过程中,当 调节到2.2时,开始出现
调节到2.2时,开始出现 沉淀,若要使
沉淀,若要使 完全沉淀,则调节溶液
完全沉淀,则调节溶液 最小为
最小为 沉淀完全]
沉淀完全](4)有机萃取剂P204和P507对金属离子的萃取率与pH的关系如图2、图3所示。

①萃取剂A是
②进行“萃钴”操作前,需对水相调pH至
 的效果。
的效果。a.2.5 b.3.5 c.4.5 d.5.5
③萃取剂萃取
 的原理为2HR(有机相)
的原理为2HR(有机相)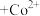 (水相)
(水相)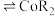 (有机相)
(有机相) (水相),则反萃取操作中可向载钴有机相中加入
(水相),则反萃取操作中可向载钴有机相中加入 的溶液;一定条件下,萃取平衡时,溶液中
的溶液;一定条件下,萃取平衡时,溶液中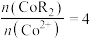 ,则
,则 的萃取率为
的萃取率为(5)一种NiAs晶体结构如图4所示。

通过X射线光谱测算出该晶胞参数为
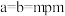 ,
,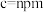 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为 的表达式)
的表达式) 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
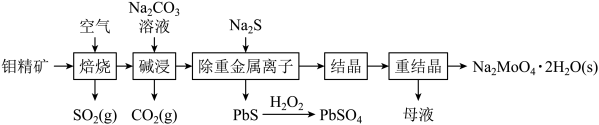
(1)Na2MoO4·2H2O中钼元素的化合价为______ ;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______ (答出一条即可);
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2 MoO3+SO2(未配平),该反应中氧化产物是
MoO3+SO2(未配平),该反应中氧化产物是______ (填化学式);当生成1molSO2时,该反应转移的电子的物质的量为_______ mol;
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________ ;
(5)过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时, 的去除率为97.5%,已知:碱浸液中c(
的去除率为97.5%,已知:碱浸液中c(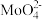 )=0.40mol/L,c(
)=0.40mol/L,c( )=0.040mol/L,Ksp(BaSO4)=1.0×10-10,则Ksp(BaMoO4)=
)=0.040mol/L,Ksp(BaSO4)=1.0×10-10,则Ksp(BaMoO4)=_______ [加入Ba(OH)2固体引起的溶液体积变化可忽略]。

(1)Na2MoO4·2H2O中钼元素的化合价为
(2)焙烧时为了使钼精矿充分反应,可采取的措施是
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2
 MoO3+SO2(未配平),该反应中氧化产物是
MoO3+SO2(未配平),该反应中氧化产物是(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为
(5)过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去
 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时, 的去除率为97.5%,已知:碱浸液中c(
的去除率为97.5%,已知:碱浸液中c(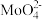 )=0.40mol/L,c(
)=0.40mol/L,c( )=0.040mol/L,Ksp(BaSO4)=1.0×10-10,则Ksp(BaMoO4)=
)=0.040mol/L,Ksp(BaSO4)=1.0×10-10,则Ksp(BaMoO4)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某校化学小组学生利用右图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。

(1)装置B中发生反应的化学方程式是____________________________________ 。
(2)虚线框图C的气体收集装置是下图中的________________________ (选填字母编号)。

(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:

试剂a的化学式是____________ ,试剂b的化学式是____________ ;加入新制氯水后溶液红色加深的原因是(用离子方程式表示)__________________________________ 。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:__________________________________________________________________ ;
为了对所提出的假设2进行验证,实验方案是______________________ 。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为______________ 。

(1)装置B中发生反应的化学方程式是
(2)虚线框图C的气体收集装置是下图中的

(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:

试剂a的化学式是
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:
为了对所提出的假设2进行验证,实验方案是
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定(滴定时的反应方程式:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
操作b涉及的主要反应的离子方程式为_____ ;滴定时,Na2S2O3溶液应放在_____ (填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00mL,其终点颜色变化为________ ;加碘食盐样品中的碘元素含量是________ mg/kg(以含w的代数式表示)。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________ 。由学生乙的实验结果推知,学生甲的实验结果将_______ (填“偏大”、“偏小”或“无影响”)。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定(滴定时的反应方程式:I2+2S2O
 =2I-+S4O
=2I-+S4O )。
)。操作b涉及的主要反应的离子方程式为
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| ② | 滴入淀粉-KI溶液,振荡 | 溶液无变化 |
| ③ | 放置片刻,再滴加稀H2SO4,振荡 | 溶液变蓝色 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】现有一份 和
和 固体混合物,某化学兴趣小组设计如图所示实验装置(夹持仪器省略),测定固体混合物中
固体混合物,某化学兴趣小组设计如图所示实验装置(夹持仪器省略),测定固体混合物中 的质量分数。实验步骤如下:
的质量分数。实验步骤如下:
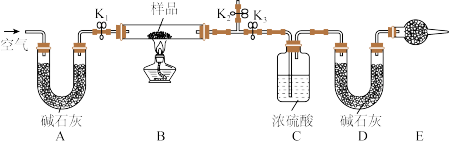
①组装好实验装置,并___________;
②加药品,称取mg样品放入硬质玻璃管中;称量装有碱石灰的U形管D的质量为 ;
;
③打开活塞 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟;
,缓缓鼓入空气数分钟;
④关闭活塞 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体;
,点燃酒精灯加热至不再产生气体;
⑤打开活塞 ,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为
,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为 。
。
请回答下列问题:
(1)补充实验步骤①的操作为___________ 。
(2)装置E中实验仪器的名称为___________ 。
(3)装置B中发生反应的化学方程式为___________ 。
(4)实验步骤③和⑤中“缓缓鼓入空气数分钟”的目的分别是___________ 。
(5)若缺少实验步骤③会导致测定结果___________ (填“偏大”“偏小”或“无影响”)。
(6)样品中 的质量分数为
的质量分数为___________ ×100%(用含m、 、
、 的式子表示)。
的式子表示)。
(7)除了该方法外,还可以用沉淀法测定 的质量分数。在选择沉淀剂时,甲同学选了过量的
的质量分数。在选择沉淀剂时,甲同学选了过量的 ,乙同学选了过量的
,乙同学选了过量的 ,从误差较小的角度选择,你认为
,从误差较小的角度选择,你认为___________ 同学更好,理由是___________ 。
 和
和 固体混合物,某化学兴趣小组设计如图所示实验装置(夹持仪器省略),测定固体混合物中
固体混合物,某化学兴趣小组设计如图所示实验装置(夹持仪器省略),测定固体混合物中 的质量分数。实验步骤如下:
的质量分数。实验步骤如下:
①组装好实验装置,并___________;
②加药品,称取mg样品放入硬质玻璃管中;称量装有碱石灰的U形管D的质量为
 ;
;③打开活塞
 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟;
,缓缓鼓入空气数分钟;④关闭活塞
 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体;
,点燃酒精灯加热至不再产生气体;⑤打开活塞
 ,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为
,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为 。
。请回答下列问题:
(1)补充实验步骤①的操作为
(2)装置E中实验仪器的名称为
(3)装置B中发生反应的化学方程式为
(4)实验步骤③和⑤中“缓缓鼓入空气数分钟”的目的分别是
(5)若缺少实验步骤③会导致测定结果
(6)样品中
 的质量分数为
的质量分数为 、
、 的式子表示)。
的式子表示)。(7)除了该方法外,还可以用沉淀法测定
 的质量分数。在选择沉淀剂时,甲同学选了过量的
的质量分数。在选择沉淀剂时,甲同学选了过量的 ,乙同学选了过量的
,乙同学选了过量的 ,从误差较小的角度选择,你认为
,从误差较小的角度选择,你认为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量。

1.实验前需进行的操作是:_______ ,稀盐酸中加入少量FeCl3溶液的作用是:_________ 。
2.用恒压分液漏斗的优点有:
①___________ ;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先_______ ,再平视刻度线读数。
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
3.推算该样品中过氧化镁的质量分数_______ (用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.5 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
4.该实验在滴定前需加入少量______ 作指示剂;判断到达滴定终点的现象是_____ ;推算该样品中过氧化镁的质量分数为____ (保留三位小数)。

1.实验前需进行的操作是:
2.用恒压分液漏斗的优点有:
①
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
3.推算该样品中过氧化镁的质量分数
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.5 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
4.该实验在滴定前需加入少量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:
①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液进行处理可获得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是___________________ 。
(2)写出第②步中发生反应的离子方程式____________ 。
(3)第③步中从滤液中获得KMnO4晶体的方法是______ 、_______ 、过滤、洗涤、干燥。
(4)取上述制得的KMnO4产品2.0000g,溶于水配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾并放于暗处5min左右,然后加入适量水和数滴淀粉溶液作指示剂,用0.2500mol/L标准Na2S2O3溶液进行滴定(发生反应I2+2S2O32-=2I-+S4O62-,杂质不参加反应),滴定至终点消耗Na2S2O3溶液20.00mL。
①滴定终点的现象是_____________ 。
②计算KMnO4产品的纯度。(写出计算过程)_____________
①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液进行处理可获得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是
(2)写出第②步中发生反应的离子方程式
(3)第③步中从滤液中获得KMnO4晶体的方法是
(4)取上述制得的KMnO4产品2.0000g,溶于水配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾并放于暗处5min左右,然后加入适量水和数滴淀粉溶液作指示剂,用0.2500mol/L标准Na2S2O3溶液进行滴定(发生反应I2+2S2O32-=2I-+S4O62-,杂质不参加反应),滴定至终点消耗Na2S2O3溶液20.00mL。
①滴定终点的现象是
②计算KMnO4产品的纯度。(写出计算过程)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为___________________________ ;得到滤渣1的主要成分为__________________________ .
(2)第②步加H2O2的作用是_______________ ;调溶液pH的目的是使______________ 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是____________ 。
(4)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol· L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω=_____________________

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为
(2)第②步加H2O2的作用是
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是
(4)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol· L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω=
您最近一年使用:0次



