按要求填空
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是_______ ,第一电离能最小的元素的原子轨道表达式_____________ 。
(2)第四周期元素中,4p轨道半充满的元素是_____________ (填元素符号)价电子层中s电子数与d电子数相同的元素是________ 填元素名称)。
(3)中国古代四大发明之一——黑火药,它的爆炸反应方程式为:
2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除K、S外,上述方程式中出现的元素形成氢化物的稳定性从大到小依次为____________ 。
②写出K的基态电子排布式___________________________
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是
(2)第四周期元素中,4p轨道半充满的元素是
(3)中国古代四大发明之一——黑火药,它的爆炸反应方程式为:
2KNO3+3C+S
 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)①除K、S外,上述方程式中出现的元素形成氢化物的稳定性从大到小依次为
②写出K的基态电子排布式
10-11高二下·福建·阶段练习 查看更多[2]
更新时间:2016-12-09 01:39:36
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】铜及其合金是人类最早使用的金属材料。
(1)铜原子的价电子排布式是___________ 。
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为___________ 。

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+的结构式是为___________ 。
且[Cu(NH3)4]2+中存在的化学键类型有___________ (填序号)。
A、配位键 B、金属键 C、极性共价键 D、非极性共价键 E、离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在丙烯醇分子中共有___________ σ键和___________ π键。
(1)铜原子的价电子排布式是
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+的结构式是为
且[Cu(NH3)4]2+中存在的化学键类型有
A、配位键 B、金属键 C、极性共价键 D、非极性共价键 E、离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在丙烯醇分子中共有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且A原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满。回答下列问题:
(1)基态E原子价电子的轨道表达式_______ 。
(2)DA2分子的VSEPR模型是_______ 。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
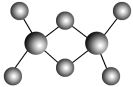
①C2Cl6属于_______ 晶体(填晶体类型),其中C原子的杂化轨道类型为_______ 杂化。
②[C(OH)4]-中存在的化学键有_______ 。
a.离子键 b.共价键 c.σ键 d.π键 e.配位键 f.氢键
(4)B、C的氟化物晶格能分别是2957 kJ/mol 、5492 kJ/mol,二者相差很大的原因_______ 。
(1)基态E原子价电子的轨道表达式
(2)DA2分子的VSEPR模型是
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。

①C2Cl6属于
②[C(OH)4]-中存在的化学键有
a.离子键 b.共价键 c.σ键 d.π键 e.配位键 f.氢键
(4)B、C的氟化物晶格能分别是2957 kJ/mol 、5492 kJ/mol,二者相差很大的原因
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】2019年4月23日,中国人民军成立70周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀.
(1)镍铬钢抗腐蚀性能强,基态C r 原子价层电子的电子排布式为_______________ 。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图甲所示)。基态Si原子电子占据最高能级的电子云轮廓图为_______ 形:H、C、O、Si 四种元素中的电负性最高的是______ 。
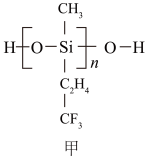
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①钛卤化物的熔点如下表所示:
解释表中卤化物之间熔点差异的原因是________________________ 。
②OF2的空间构型为___________ ,其中O原子杂化方式为__________ 杂化。
③氯元素可以形成多种含氧酸,其酸性由弱到强的顺序为:HClO <HClO2<HClO3<HClO4。试解释其酸性强弱的原因是_______________ 。
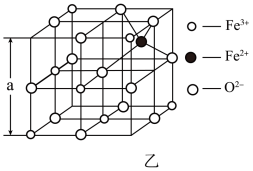
(4)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏大着极的资源,含有硅、氧、锰、锌等。如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体。
①晶体中的氧离子是否构成了面心立方最密堆积?________ (填“是”或“否”);
②已知:Fe3O4晶体的密度为5. 18g•cm -3, 根据该图计算a________ nrn (写出计算式即可,阿伏加 德罗常数的值为N A)
(1)镍铬钢抗腐蚀性能强,基态C r 原子价层电子的电子排布式为
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图甲所示)。基态Si原子电子占据最高能级的电子云轮廓图为
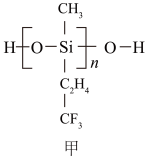
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①钛卤化物的熔点如下表所示:
| TiF4 | TiCl4 | TiBr4 | TiI4 | |
| 熔点/℃ | 377 | -24 | 38 | 150 |
解释表中卤化物之间熔点差异的原因是
②OF2的空间构型为
③氯元素可以形成多种含氧酸,其酸性由弱到强的顺序为:HClO <HClO2<HClO3<HClO4。试解释其酸性强弱的原因是
(4)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏大着极的资源,含有硅、氧、锰、锌等。如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体。
①晶体中的氧离子是否构成了面心立方最密堆积?
②已知:Fe3O4晶体的密度为5. 18g•cm -3, 根据该图计算a

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】现有 、
、 、
、 、
、 、
、 、
、 六种元素,均为前4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
六种元素,均为前4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1)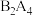 的电子式为
的电子式为___________ (用元素符号表示,下同)。
(2) 元素的原子核外共有
元素的原子核外共有___________ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈___________ 形。
(3)某同学推断 元素基态原子的轨道表示式为:
元素基态原子的轨道表示式为: 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了___________ (填序号)。
a.泡利不相容原理 b.洪特规则
(4) 、
、 、
、 三种元素的简单离子半径由大到小的顺序是
三种元素的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(5)其中五种元素形成的一种 型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如下图所示)。阳离子中存在的化学键类型有
型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如下图所示)。阳离子中存在的化学键类型有___________ (填序号)。

a.共价键 b.配位键 c.离子键 d.金属键
该化合物加热时阳离子首先失去的组分是____ (填化学式),判断理由是___ 。
 、
、 、
、 、
、 、
、 、
、 六种元素,均为前4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
六种元素,均为前4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
 元素基态原子的核外 元素基态原子的核外 电子数比 电子数比 电子数少1 电子数少1 |
 元素基态原子的核外 元素基态原子的核外 轨道中有两个未成对电子 轨道中有两个未成对电子 |
 元素的气态基态原子的第一至第四电离能分别是: 元素的气态基态原子的第一至第四电离能分别是: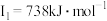  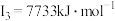 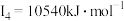 |
 元素的主族序数比周期数大3 元素的主族序数比周期数大3 |
 元素位于元素周期表中的第11列 元素位于元素周期表中的第11列 |
(1)
 的电子式为
的电子式为(2)
 元素的原子核外共有
元素的原子核外共有(3)某同学推断
 元素基态原子的轨道表示式为:
元素基态原子的轨道表示式为: 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了a.泡利不相容原理 b.洪特规则
(4)
 、
、 、
、 三种元素的简单离子半径由大到小的顺序是
三种元素的简单离子半径由大到小的顺序是(5)其中五种元素形成的一种
 型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如下图所示)。阳离子中存在的化学键类型有
型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如下图所示)。阳离子中存在的化学键类型有
a.共价键 b.配位键 c.离子键 d.金属键
该化合物加热时阳离子首先失去的组分是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】元素及其化合物在生活及生产中有很多重要用途。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)基态碳原子价电子的电子轨道表达式为____ ,第一电离能Ga____ As(填“>”、 “<”、“=”)。
(2)BN和GaAs都是原子晶体,它们的硬度和熔点BN>GaAs,原因是________________ 。
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。 (CN)2分子中氮原子的轨道杂化类型为_____ ,σ 键与 π 键数目之比为_______ ; (SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S),其原因是_________ 。
(4)①卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为_____________ ;②一定条件下(SCN)2可氧化为CO32—和SO32—等离子,其中SO32—的立体构型为_________ 。
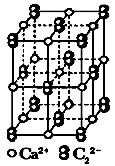
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),CaC2 晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。写出与C22﹣互为等电子体的微粒符号________ 、_______ ;此晶体中 1 个 C22﹣周围距离最近的Ca2+为______ 个;若该晶胞的边长为a、a、b(nm),则该晶体的密度为______ g·cm-3(写出表达式)。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)基态碳原子价电子的电子轨道表达式为
(2)BN和GaAs都是原子晶体,它们的硬度和熔点BN>GaAs,原因是
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。 (CN)2分子中氮原子的轨道杂化类型为
(4)①卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),CaC2 晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。写出与C22﹣互为等电子体的微粒符号

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)B基态原子中能量最高的电子,其电子云在空间有_____ 个方向,原子轨道呈___ 形
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了____ 。
(3)G位于______ 族______ 区,价电子排布式为______ 。
(4)检验F元素的实验方法是_________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1个 |
| C元素原子的第一至第四电离能分别是:I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了(3)G位于
(4)检验F元素的实验方法是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】(1)亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
①K4[Fe(CN)6]中的作用力除C、N原子间的共价键外,还有___________ 和_______________ 。
②黄血盐中N原子的杂化方式为____________ ;C、N、O的电负性由大到小的排序为_______________ 。
(2)新型储氢材料是开发利用氢能的研究方向,Ti(BH4)3是一种储氢材料,可由LiBH4和TiCl4反应制得。
①基态Cl原子有_____ 种空间运动状态的电子,属于____ 区(填“s”或“p”或“d”或“f”)
②LiBH4由Li+和 构成,与
构成,与 互为等电子体的分子为
互为等电子体的分子为__________ ,Li、Be、B元素的第一电离能由大到小排列顺序为________ 。
③LiH中,离子半径:Li+_________ H-(填“>”、“=”或“<”)。
④某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是_________ (填元素符号)。
①K4[Fe(CN)6]中的作用力除C、N原子间的共价键外,还有
②黄血盐中N原子的杂化方式为
(2)新型储氢材料是开发利用氢能的研究方向,Ti(BH4)3是一种储氢材料,可由LiBH4和TiCl4反应制得。
①基态Cl原子有
②LiBH4由Li+和
 构成,与
构成,与 互为等电子体的分子为
互为等电子体的分子为③LiH中,离子半径:Li+
④某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 |
| 580 | 1820 | 2750 | 11600 |
M是
您最近一年使用:0次
【推荐2】材料在科技、医疗、生产等领域应用十分广泛。
(1)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合做录音磁带磁粉原料的为___________ (填字母)。
A.V2O5 B.CrO2 C. ZnO
(2)基态Cu原子有___________ 种不同能量的电子;焰色试验时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式:___________ 。
(3)近年来我国科学家发现了一系列铁系超导材料,其中一类为Fe—Nd—C—N组成的化合物。
①Nd的价层电子排布式为4f 46s2,则Nd2+的价层电子排布式为___________ 。
②1个CH2=CH2分子中,存在___________ 个σ键、___________ 个π键。
③铝和硼同主族,铝逐级电离能(kJ∙mol-1)依次为578、1817、2745、11575、14830、18376,请解释第二电离能增幅较大的原因:___________ 。
(1)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合做录音磁带磁粉原料的为
A.V2O5 B.CrO2 C. ZnO
(2)基态Cu原子有
(3)近年来我国科学家发现了一系列铁系超导材料,其中一类为Fe—Nd—C—N组成的化合物。
①Nd的价层电子排布式为4f 46s2,则Nd2+的价层电子排布式为
②1个CH2=CH2分子中,存在
③铝和硼同主族,铝逐级电离能(kJ∙mol-1)依次为578、1817、2745、11575、14830、18376,请解释第二电离能增幅较大的原因:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】Cr、Mn、Fe都属于黑色金属,回答下列问题。
(1)基态Cr原子的价层电子排布式是_______ ,基态Mn原子核外有_______ 种不同能量的电子,Fe元素在周期表中的位置为_______ 。
(2)纳米Fe因其表面活性常用作有机催化剂,如图所示:

①化合物M的熔沸点明显低于化合物N,其主要原因是_______ 。
②化合物N中C原子的杂化类型为_______ ,元素C、N、O的第一电离能由小到大的顺序为_______ 。
(3)一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn, =S)。在该晶胞中,硫原子的堆积方式为
=S)。在该晶胞中,硫原子的堆积方式为_______ 。

(4)已知上述晶胞中最近两个硫原子之间的距离为a nm,晶体密度为ρ g·cm-3,则阿伏加德罗常数的值NA=_______ (写出表达式即可)。
(1)基态Cr原子的价层电子排布式是
(2)纳米Fe因其表面活性常用作有机催化剂,如图所示:

①化合物M的熔沸点明显低于化合物N,其主要原因是
②化合物N中C原子的杂化类型为
(3)一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn,
 =S)。在该晶胞中,硫原子的堆积方式为
=S)。在该晶胞中,硫原子的堆积方式为
(4)已知上述晶胞中最近两个硫原子之间的距离为a nm,晶体密度为ρ g·cm-3,则阿伏加德罗常数的值NA=
您最近一年使用:0次



