元素及其化合物在生活及生产中有很多重要用途。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)基态碳原子价电子的电子轨道表达式为____ ,第一电离能Ga____ As(填“>”、 “<”、“=”)。
(2)BN和GaAs都是原子晶体,它们的硬度和熔点BN>GaAs,原因是________________ 。
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。 (CN)2分子中氮原子的轨道杂化类型为_____ ,σ 键与 π 键数目之比为_______ ; (SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S),其原因是_________ 。
(4)①卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为_____________ ;②一定条件下(SCN)2可氧化为CO32—和SO32—等离子,其中SO32—的立体构型为_________ 。
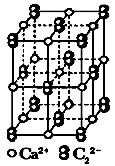
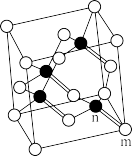
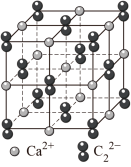
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),CaC2 晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。写出与C22﹣互为等电子体的微粒符号________ 、_______ ;此晶体中 1 个 C22﹣周围距离最近的Ca2+为______ 个;若该晶胞的边长为a、a、b(nm),则该晶体的密度为______ g·cm-3(写出表达式)。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)基态碳原子价电子的电子轨道表达式为
(2)BN和GaAs都是原子晶体,它们的硬度和熔点BN>GaAs,原因是
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。 (CN)2分子中氮原子的轨道杂化类型为
(4)①卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),CaC2 晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。写出与C22﹣互为等电子体的微粒符号

更新时间:2017-11-04 21:00:30
|
相似题推荐
【推荐1】第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途。
(1)砷元素的基态原子价电子排布图为_____________ ;
(2)氮元素的单质除了N2外,还有N4,则N4中的N原子的轨道杂化方式为____________ ;
(3)对氨基苯甲醛与邻氨基苯甲醛相比,沸点较高的是_________ (填空“前者”或“后者”),原因是________ ;
(4)王水溶解黄金的反应如下:Au+HNO3+4HCl=H[AuCl4]+NO+2H2O,产物中的H[AuCl4]是配合物,它的配位体是____________ ,Au元素提供_________ ;
(5)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是变通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图,晶胞参数α=565pm。(黑球:Ga, 白球:As)
(1)砷元素的基态原子价电子排布图为
(2)氮元素的单质除了N2外,还有N4,则N4中的N原子的轨道杂化方式为
(3)对氨基苯甲醛与邻氨基苯甲醛相比,沸点较高的是
(4)王水溶解黄金的反应如下:Au+HNO3+4HCl=H[AuCl4]+NO+2H2O,产物中的H[AuCl4]是配合物,它的配位体是
(5)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是变通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图,晶胞参数α=565pm。(黑球:Ga, 白球:As)
砷化镓的化学式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
真题
【推荐2】本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
(1) 中
中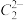 与
与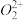 互为等电子体,
互为等电子体,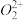 的电子式可表示为
的电子式可表示为_______ ;1mol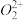 中含有的
中含有的 键数目为
键数目为___________ 。
(2)将乙炔通入 溶液生成
溶液生成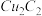 红棕色沉淀。
红棕色沉淀。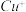 基态核外电子排布式为
基态核外电子排布式为_________________________ 。
(3)乙炔与氢氰酸反应可得丙烯腈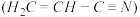 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是________________ ;分子中处于同一直线上的原子数目最多为__________________ 。
(4)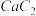 晶体的晶胞结构与
晶体的晶胞结构与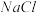 晶体相似(如图所示),但
晶体相似(如图所示),但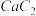 晶体中含有的中哑铃形
晶体中含有的中哑铃形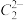 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。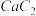 晶体中1个
晶体中1个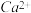 周围距离最近的
周围距离最近的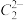 数目为
数目为______________ 。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是_________________ 。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于_______ 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_____________ 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________ 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是____________________ 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_________ 、_________ 。
A.乙炔是有机合成工业的一种原料。工业上曾用
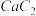 与水反应生成乙炔。
与水反应生成乙炔。(1)
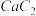 中
中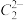 与
与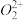 互为等电子体,
互为等电子体,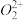 的电子式可表示为
的电子式可表示为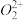 中含有的
中含有的 键数目为
键数目为(2)将乙炔通入
 溶液生成
溶液生成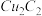 红棕色沉淀。
红棕色沉淀。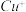 基态核外电子排布式为
基态核外电子排布式为(3)乙炔与氢氰酸反应可得丙烯腈
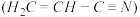 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是(4)
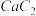 晶体的晶胞结构与
晶体的晶胞结构与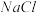 晶体相似(如图所示),但
晶体相似(如图所示),但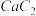 晶体中含有的中哑铃形
晶体中含有的中哑铃形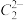 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。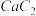 晶体中1个
晶体中1个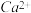 周围距离最近的
周围距离最近的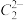 数目为
数目为
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在
 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。(l)上述实验中过滤的目的是
(2) 滤液在分液漏斗中洗涤静置后,有机层处于
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 | 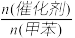 | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铝和硅在地壳中含量丰富,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)①基态Si原子的价电子排布式为___________ 。
②Si所在周期中的非金属元素(稀有气体除外),其第一电离能由小到大的顺序为___________ 。
③写出一种与SiCl4互为等电子体的离子的化学式___________ 。
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①二聚物中Al原子的杂化轨道类型为___________ 。
②从键的形成角度分析1键和2键的区别:___________ 。
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH CH3CH2OH
CH3CH2OH
①AlH 的VSEPR模型名称是
的VSEPR模型名称是___________ 。
②CH3COOH分子中π键和σ键的数目之比为___________ ,分子中键角α___________ (填“>”、“=”或“<”)键角β。
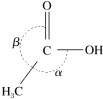
(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:
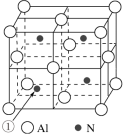
①晶胞中Al的配位数是___________ ,若该晶胞的边长为a nm,则该晶体的密度为___________ g·cm-3.(用NA表示阿伏加德罗常数的值)
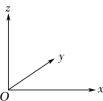
②晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,该数组称为该原子的原子坐标,如晶胞中N原子①的原子坐标为( ,
, ,
, ),试写出晶胞中Al原子的原子坐标
),试写出晶胞中Al原子的原子坐标___________ (任填一个位置)
(1)①基态Si原子的价电子排布式为
②Si所在周期中的非金属元素(稀有气体除外),其第一电离能由小到大的顺序为
③写出一种与SiCl4互为等电子体的离子的化学式
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①二聚物中Al原子的杂化轨道类型为
②从键的形成角度分析1键和2键的区别:
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH
 CH3CH2OH
CH3CH2OH①AlH
 的VSEPR模型名称是
的VSEPR模型名称是②CH3COOH分子中π键和σ键的数目之比为

(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:


①晶胞中Al的配位数是
②晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,该数组称为该原子的原子坐标,如晶胞中N原子①的原子坐标为(
 ,
, ,
, ),试写出晶胞中Al原子的原子坐标
),试写出晶胞中Al原子的原子坐标
您最近一年使用:0次
【推荐1】铜是人类最早使用的金属之一。回答下列问题:
(1)基态铜原子的价层电子排布图为___________ 。
(2)向 溶液中加入足量氨水得到深蓝色
溶液中加入足量氨水得到深蓝色 溶液,再向其中加入盐酸羟胺(
溶液,再向其中加入盐酸羟胺(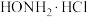 )至溶液变为无色,再通入
)至溶液变为无色,再通入 后析出
后析出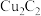 红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是
红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是___________ (填元素符号); 的空间结构名称为
的空间结构名称为___________ ; 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为___________ ; 在水中的溶解度较小的原因是
在水中的溶解度较小的原因是___________ ; 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为___________ 。
(3)上述 、
、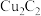 的晶体类型都属于下列中的___________(填标号)。
的晶体类型都属于下列中的___________(填标号)。
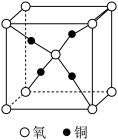
(4)铜和氧形成的一种离子化合物的晶体结构如图所示。若其晶胞边长为a pm,阿伏加德罗常数值为 ,则该晶体密度为
,则该晶体密度为___________  。
。
(1)基态铜原子的价层电子排布图为
(2)向
 溶液中加入足量氨水得到深蓝色
溶液中加入足量氨水得到深蓝色 溶液,再向其中加入盐酸羟胺(
溶液,再向其中加入盐酸羟胺(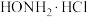 )至溶液变为无色,再通入
)至溶液变为无色,再通入 后析出
后析出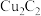 红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是
红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是 的空间结构名称为
的空间结构名称为 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为 在水中的溶解度较小的原因是
在水中的溶解度较小的原因是 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为(3)上述
 、
、 的晶体类型都属于下列中的___________(填标号)。
的晶体类型都属于下列中的___________(填标号)。| A.分子晶体 | B.共价晶体 | C.金属晶体 | D.离子晶体 |
 ,则该晶体密度为
,则该晶体密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】镍及其化合物用途广泛,可用作催化剂、合金、电器元件等。回答下列问题:
(1)基态Ni原子价电子排布图为_______ 。
(2)某镍配合物由1个Ni2+与2个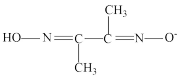 形成。
形成。
①形成该镍配合物的元素中,第二周期元素的第一电离能最大的为_______ (用元素符号表示) ,配合物中N采用的杂化类型为_______ 。
②已知该配合物中只有一种元素的原子与Ni2+配位,则与镍配位的原子为_______ (填“C”、“N"”或“O"),原因为_______ 。
(3)Ni(CO)4是常温下呈液态的镍的重要配合物,易溶于CCl4、苯等有机溶剂,则Ni(CO)4的空间构型为_______ ,Ni(CO)4中含有的σ键与π键的数目之比为_______ 。
(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示。
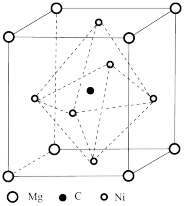
①该新型超导材料的化学式为_______ 。
②若晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体的密度为_______ g·cm-3。
(1)基态Ni原子价电子排布图为
(2)某镍配合物由1个Ni2+与2个
 形成。
形成。①形成该镍配合物的元素中,第二周期元素的第一电离能最大的为
②已知该配合物中只有一种元素的原子与Ni2+配位,则与镍配位的原子为
(3)Ni(CO)4是常温下呈液态的镍的重要配合物,易溶于CCl4、苯等有机溶剂,则Ni(CO)4的空间构型为
(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示。

①该新型超导材料的化学式为
②若晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】三醋酸锰[(CH3COO)3Mn]是一种很好的有机反应氧化剂,在有机工业上有广泛的用途。常用以下方法制备:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2 + 3O2↑+ 40CH3COOH。
请回答下列问题:
(1)三醋酸锰[(CH3COO)3Mn]中阳离子的最外层轨道表示式为_______ 。
(2)CH3COOH的电离方程式是_______ 。
(3) 的空间结构是
的空间结构是_______ ,1 mol醋酸酐[(CH3CO)2O]中所含σ键数与π键数之比为_______ 。
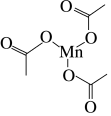
(4)过渡元素锰能形成很多重要的配合物。三醋酸锰就是一种配合物,其结构如图所示。_______ 。
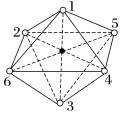
(5)Mn2+能形成配离子为八面体的配合物MnClm·nNH3,在该配合物的配离子中,Mn2+位于八面体的中心,其结构如下图所示(其中数字处的小圆圈表示NH3分子或Cl-):_______ 。
(6)锰与硒形成的某种化合物具有优异的光电性能,其晶胞结构如下图所示。_______ 。
②若该晶体的晶胞边长为a pm(1 pm=10-10cm),阿伏加德罗常数的值为NA,则该晶体的密度为_______  (列出表达式即可)。
(列出表达式即可)。
请回答下列问题:
(1)三醋酸锰[(CH3COO)3Mn]中阳离子的最外层轨道表示式为
(2)CH3COOH的电离方程式是
(3)
 的空间结构是
的空间结构是(4)过渡元素锰能形成很多重要的配合物。三醋酸锰就是一种配合物,其结构如图所示。
(5)Mn2+能形成配离子为八面体的配合物MnClm·nNH3,在该配合物的配离子中,Mn2+位于八面体的中心,其结构如下图所示(其中数字处的小圆圈表示NH3分子或Cl-):
(6)锰与硒形成的某种化合物具有优异的光电性能,其晶胞结构如下图所示。

②若该晶体的晶胞边长为a pm(1 pm=10-10cm),阿伏加德罗常数的值为NA,则该晶体的密度为
 (列出表达式即可)。
(列出表达式即可)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为___________ 。
(2)LiGaH4是一种温和的还原剂,其可由GaCl3和过量的LiH反应制得:GaCl3 + 4LiH=LiGaH4+3LiCl。
①已知GaCl3的熔点为77.9°C, LiCl的熔点为605°C, 两者熔点差异较大的原因为___________ 。
②[GaH4]-的立体构型为___________ 。
(3)一种含镓的药物合成方法如图所示:
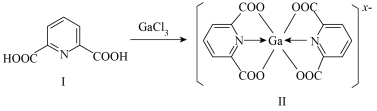
①化合物I中环上C原子的杂化方式为___________ ,1mol化合物I中含有的σ键的物质的量为___________ 。化合物I中所含元素的电负性由大到小的顺序为___________ (用元素符号表示)。
②化合物Ⅱ中Ga的配位数为___________ ,x=___________ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为___________ (填选项字母)。
A.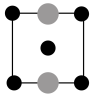 B.
B.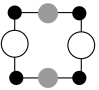 C.
C.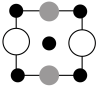
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=3.0×10−10 m,c=3. 86×10−10m,则其密度为___________ g· cm−3(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)LiGaH4是一种温和的还原剂,其可由GaCl3和过量的LiH反应制得:GaCl3 + 4LiH=LiGaH4+3LiCl。
①已知GaCl3的熔点为77.9°C, LiCl的熔点为605°C, 两者熔点差异较大的原因为
②[GaH4]-的立体构型为
(3)一种含镓的药物合成方法如图所示:

①化合物I中环上C原子的杂化方式为
②化合物Ⅱ中Ga的配位数为
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B. C.
C.
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=3.0×10−10 m,c=3. 86×10−10m,则其密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】锂、铁、铬、卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题。
(1)Fe在元素周期表中的位置为_______ ,位于_______ 区,有_______ 个不同运动状态的价电子,最高能层中电子所占据的原子轨道呈_______ 形。
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
(3)固态氟化氢中存在 形式,画出
形式,画出 的链状结构
的链状结构_______ 。
(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为_______ 、_______ (填字母)。
A.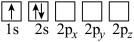 B.
B.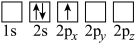
C. D.
D.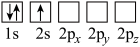
(5)①对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
② 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
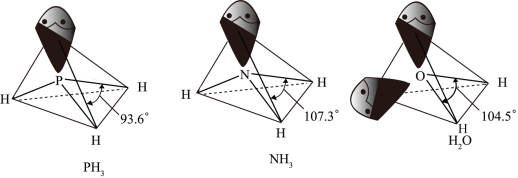
 中P的杂化类型是
中P的杂化类型是_______ , 的键角小于
的键角小于 的分析原因:
的分析原因:_______ 。
(1)Fe在元素周期表中的位置为
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
| A.第一电离能:C<N<O<F |
| B.原子半径:C>N>O>F |
| C.最简单气态氢化物的热稳定性:N<O<F |
| D.元素的最高正价:C<N<O |
 形式,画出
形式,画出 的链状结构
的链状结构(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(5)①对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
②
 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的分析原因:
的分析原因:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】根据所学知识回答下列问题
(1)下列所示的几种物质中,互为同素异形体的为___________ ,其中属于共价晶体的是___________ , 间的作用力是
间的作用力是___________ 。 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图甲所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图甲所示,二聚体中Al的轨道杂化类型为___________ 。 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
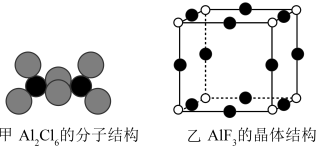
的192℃,由此可以判断铝氟之间的化学键为___________ 键。 结构属于立方晶系,晶胞如图乙所示,
结构属于立方晶系,晶胞如图乙所示, 的配位数为
的配位数为___________ 。若晶胞参数为a pm,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)下列所示的几种物质中,互为同素异形体的为
 间的作用力是
间的作用力是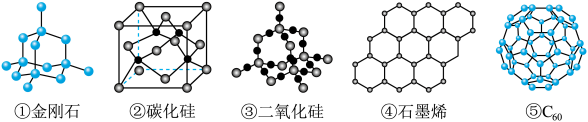
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图甲所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图甲所示,二聚体中Al的轨道杂化类型为 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为 结构属于立方晶系,晶胞如图乙所示,
结构属于立方晶系,晶胞如图乙所示, 的配位数为
的配位数为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】硼氮氢化合物在有机合成、储氢材料等方面备受关注。
氨硼烷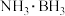 的球棍模型如图所示。
的球棍模型如图所示。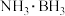 的一种制备方法如下:
的一种制备方法如下:
ⅰ.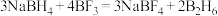 (乙硼烷)
(乙硼烷)
②任何卤化物水解,必先同水分子配位
(1) 中硼元素的化合价为
中硼元素的化合价为___________ 。
(2) 不能水解,但
不能水解,但 能水解。原因是
能水解。原因是___________ 。
(3)在水中的溶解性:THF>环戊烷,原因是___________ 。
(4)此法生成的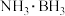 会继续与
会继续与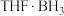 反应生成副产物
反应生成副产物 。过程如下:
。过程如下:___________ 能量(填“吸收”或“放出”)。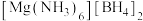 的晶胞形状为立方体,边长为
的晶胞形状为立方体,边长为 ,如下图所示。
,如下图所示。 距离最近且等距的
距离最近且等距的 有
有___________ 个。
②已知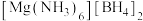 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,此晶体的密度为
,此晶体的密度为___________  。(
。( )
)
氨硼烷
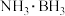 的球棍模型如图所示。
的球棍模型如图所示。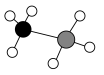
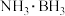 的一种制备方法如下:
的一种制备方法如下:ⅰ.
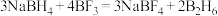 (乙硼烷)
(乙硼烷)ⅱ.
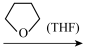
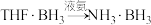
②任何卤化物水解,必先同水分子配位
(1)
 中硼元素的化合价为
中硼元素的化合价为(2)
 不能水解,但
不能水解,但 能水解。原因是
能水解。原因是(3)在水中的溶解性:THF>环戊烷,原因是
(4)此法生成的
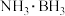 会继续与
会继续与 反应生成副产物
反应生成副产物 。过程如下:
。过程如下: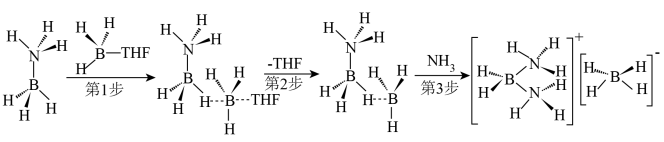
②用DMA(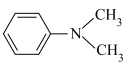 )代替THF可以得到纯净的氨硼烷。由此推测
)代替THF可以得到纯净的氨硼烷。由此推测 、THF和DMA分别与B原子的结合能力由大到小的顺序为
、THF和DMA分别与B原子的结合能力由大到小的顺序为
 的晶胞形状为立方体,边长为
的晶胞形状为立方体,边长为 ,如下图所示。
,如下图所示。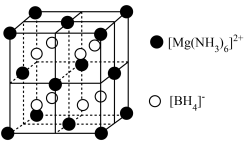
 距离最近且等距的
距离最近且等距的 有
有②已知
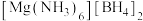 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,此晶体的密度为
,此晶体的密度为 。(
。( )
)
您最近一年使用:0次
【推荐2】氮化镓(GaN)具有优异的光电性能。一种利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4、SiO2]制备CaN的工艺流程如图:
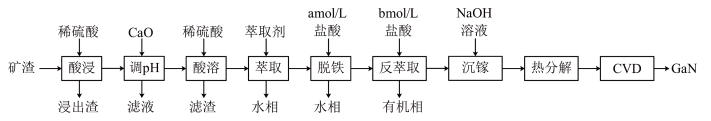
已知:
①常温下,Ksp[Zn(OH)2]=10-16.6,Ksp[Ga(OH)3)=10-35.1,Ksp[Fe(OH)3]=10-385。
②Ga3+、Fe3+在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见表。
回答下列问题:
(1)“酸浸”时Ga2(Fe2O4)3发生反应的离子方程式为_______ 。
(2)“酸溶"所得滤渣的主要成分是_______ (填化学式)。
(3)“酸浸”所得浸出液中Ga3+、Zn2+浓度分别为0.21 g/L、65g/L。常温下,为尽可能多地提取Ga3+并确保不混入Zn(OH)2,“调pH”时需用CaO将pH增大至接近_______ (假设调pH时溶液体积不变)。
(4)“脱铁”和“反萃取”时,所用盐酸的浓度a=_______ ,b=_______ (选填上表中盐酸的浓度)。
(5)“沉镓"时,若加入NaOH的量过多,会导致Ga*的沉淀率降低,原因是_______ (用离子方程式表示)。
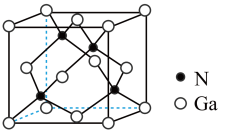
(6)①GaN晶体的一种立方晶胞如图所示,其晶体类型为_______ ,该晶体中与 Ca原子距离最近且相等的N原子个数为_______ 。
②该晶体密度为ρg/cm3,GaN的式量为Mr,则晶胞边长为_______ nm。 (列出计算式,NA为阿伏加德罗常数的值)

已知:
①常温下,Ksp[Zn(OH)2]=10-16.6,Ksp[Ga(OH)3)=10-35.1,Ksp[Fe(OH)3]=10-385。
②Ga3+、Fe3+在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见表。
| 盐酸浓度/mol/L | 反萃取率/% | |
| Ga3+ | Fe3+ | |
| 2 | 86.9 | 9.4 |
| 4 | 69.1 | 52.1 |
| 6 | 17.5 | 71.3 |
(1)“酸浸”时Ga2(Fe2O4)3发生反应的离子方程式为
(2)“酸溶"所得滤渣的主要成分是
(3)“酸浸”所得浸出液中Ga3+、Zn2+浓度分别为0.21 g/L、65g/L。常温下,为尽可能多地提取Ga3+并确保不混入Zn(OH)2,“调pH”时需用CaO将pH增大至接近
(4)“脱铁”和“反萃取”时,所用盐酸的浓度a=
(5)“沉镓"时,若加入NaOH的量过多,会导致Ga*的沉淀率降低,原因是
(6)①GaN晶体的一种立方晶胞如图所示,其晶体类型为
②该晶体密度为ρg/cm3,GaN的式量为Mr,则晶胞边长为

您最近一年使用:0次
【推荐3】硅是无机非金属材料的主角,硅材料在生活中占有重要地位,硅的氧化物和硅酸盐约占地壳质量的90%以上。请回答下列问题:
(1)基态硅原子核外电子云有___________ 种不同的伸展方向,有___________ 种形状的电子云,核外存在___________ 对自旋相反的电子。
(2)硅原子2p能级的三个轨道之间具有不同的___________。
(3)某元素位于第四周期第Ⅷ族,其基态原子的未成对电子数与基态硅原子的未成对电子数相同,则其基态原子的价层电子排布式为___________ 。
(4)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne)3s23p1、③[Ne]3s13p14s1,有关这些微粒的叙述,正确的是___________。
(5)Si(NH2)4分子的空间结构(以Si为中心)名称为___________ ,分子中氮原子的杂化轨道类型是___________ ,Si(NH2)4受热分解生成Si3N4和NH3,其受热不稳定的原因是___________ 。
(6)晶体硅的结构跟金刚石相似,图1中原子坐标参数A为(0,0,0),B为( ,0,
,0, ),C(
),C( ,
, ,0),在立方晶胞中,与晶胞体对角线垂直的面,在晶体学中称为(1,1,1)晶面,如图2所示。
,0),在立方晶胞中,与晶胞体对角线垂直的面,在晶体学中称为(1,1,1)晶面,如图2所示。

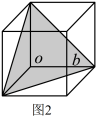
l mol晶体硅中所含有硅硅单键的数目是___________ ,图 1中原子坐标参数D为___________ ,图2立方晶胞中可以称为(1,1,1) 晶面的面共有___________ 个。
(1)基态硅原子核外电子云有
(2)硅原子2p能级的三个轨道之间具有不同的___________。
| A.能量 | B.形状 | C.空间伸展方向 | D.可容纳电子数 |
(3)某元素位于第四周期第Ⅷ族,其基态原子的未成对电子数与基态硅原子的未成对电子数相同,则其基态原子的价层电子排布式为
(4)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne)3s23p1、③[Ne]3s13p14s1,有关这些微粒的叙述,正确的是___________。
| A.微粒半径:③>①>② | B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
(5)Si(NH2)4分子的空间结构(以Si为中心)名称为
(6)晶体硅的结构跟金刚石相似,图1中原子坐标参数A为(0,0,0),B为(
 ,0,
,0, ),C(
),C( ,
, ,0),在立方晶胞中,与晶胞体对角线垂直的面,在晶体学中称为(1,1,1)晶面,如图2所示。
,0),在立方晶胞中,与晶胞体对角线垂直的面,在晶体学中称为(1,1,1)晶面,如图2所示。

l mol晶体硅中所含有硅硅单键的数目是
您最近一年使用:0次



