Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
1.(1)基态Fe2+的核外电子排布式为[Ar]______ ,有__ 个未成对电子。
2.(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是_____ 。
3.(3)已知Al 的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因________ 。
4.(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是____ ;SiO2中Si原子采取____ 杂化。
5.(5)一种铜的溴化物晶胞结构如图所示:该晶胞中铜的配位数是___ ,与溴紧邻的溴原子数目是________ ,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为________ ;已知晶胞参数为apm,其密度为_______ g/cm3 (列出计算式即可)。
1.(1)基态Fe2+的核外电子排布式为[Ar]
2.(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是
3.(3)已知Al 的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因
4.(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是
5.(5)一种铜的溴化物晶胞结构如图所示:该晶胞中铜的配位数是
更新时间:2018-04-10 17:07:08
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
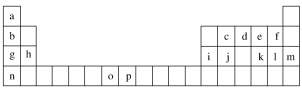
(1)元素p为26号元素,请写出其基态原子电子排布式_________________ 。
(2)d与a反应的产物的分子中中心原子的杂化形式为___________________ 。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________ 。
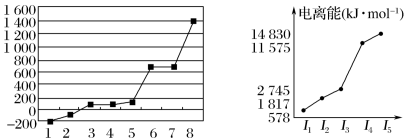
(4)o、p两元素的部分电离能数据列于表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子。对此,你的解释是______________________________ 。
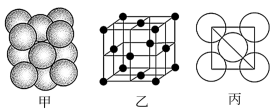
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示,则晶胞中i原子的配位数为_____________ 。
(6)元素a、c、e可形成一种相对分子质量为60的一元羧酸分子,其分子中共形成____ 个 键,
键,_____ 个 键。
键。
(7)第三周期8种元素按单质熔点高低的顺序如下图,其中电负性最大的是_____ (填下图中的序号)。
(8)短周期某主族元素M的电离能情况如下图所示,则M元素是述周期表的______ 元素(填元素符号)。
序号
试回答下列问题:

(1)元素p为26号元素,请写出其基态原子电子排布式
(2)d与a反应的产物的分子中中心原子的杂化形式为
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(4)o、p两元素的部分电离能数据列于表:
| 元素 | o | P | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子。对此,你的解释是
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示,则晶胞中i原子的配位数为

(6)元素a、c、e可形成一种相对分子质量为60的一元羧酸分子,其分子中共形成
 键,
键, 键。
键。(7)第三周期8种元素按单质熔点高低的顺序如下图,其中电负性最大的是
(8)短周期某主族元素M的电离能情况如下图所示,则M元素是述周期表的

序号
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】碘及其化合物在生产、生活中有着广泛的应用。回答下列问题:
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的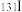 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是_______ 。
(2)碘单质在 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因_______ 。
(3)HI主要用于药物合成,通常用 和P反应生成
和P反应生成 ,
, 再水解制备HI.
再水解制备HI. 的空间结构是
的空间结构是_______ , 水解生成HI的化学方程式是
水解生成HI的化学方程式是_______ 。
(4) 是一种甲基化试剂,
是一种甲基化试剂, 可用作制冷剂,
可用作制冷剂, 和
和 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: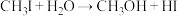 和
和 。
。 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因_______ 。
(5) 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
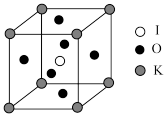
①与K原子紧邻的O原子有_______ 个。
② 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是_______ 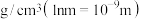 。
。
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的
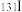 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是(2)碘单质在
 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因(3)HI主要用于药物合成,通常用
 和P反应生成
和P反应生成 ,
, 再水解制备HI.
再水解制备HI. 的空间结构是
的空间结构是 水解生成HI的化学方程式是
水解生成HI的化学方程式是(4)
 是一种甲基化试剂,
是一种甲基化试剂, 可用作制冷剂,
可用作制冷剂, 和
和 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: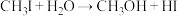 和
和 。
。 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因(5)
 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
①与K原子紧邻的O原子有
②
 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是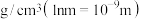 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】高氯酸三碳酰肼合镍{[Ni(CHZ)3](C104)2}是一种新型的起爆药。
(1)Ni2+某杰核外电子排布式为________ 。
(2)ClO4空间构型是_______ ;与ClO4互为等电子体的一种分子为_______ (填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为_____ ;C、N、0三种元素的电负性由大到小的顺序为______ 。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为_________ 。
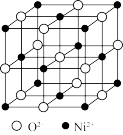
(1)Ni2+某杰核外电子排布式为
(2)ClO4空间构型是
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】2022年9月,著名期刊Applied Catalysis。 B, Environmental。报道了一种目前催化性能最好的光催化剂TiO2‖(Cu2O)x。回答下列问题:
(1)基态钛原子的电子排布式为___________ ,核外电子占据的轨道数为___________ 。
(2)Ti可形成配合物[Ti(urea)6](ClO4)3,urea表示尿素,其结构如图所示。

①配合物中Ti的化合价为___________ 。
②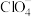 的空间结构为
的空间结构为___________ 。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身被还原成氧化亚铜,乙醛中C原子的杂化轨道类型为___________ ;1 mol乙醛分子中含有的π键的数目为___________ ,乙酸的沸点明显高于乙醛,其主要原因是___________ 。
(4)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,解释高温下Cu2O比CuO更稳定的原因:_________ 。
(5)Cu2O的晶胞结构如图所示,该结构中O原子的配位数是___________ ;晶胞结构为正方体,边长为a pm,则晶体的密度为___________ g·cm-3(用含NA、a的代数式表示)。

(1)基态钛原子的电子排布式为
(2)Ti可形成配合物[Ti(urea)6](ClO4)3,urea表示尿素,其结构如图所示。

①配合物中Ti的化合价为
②
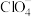 的空间结构为
的空间结构为(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身被还原成氧化亚铜,乙醛中C原子的杂化轨道类型为
(4)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,解释高温下Cu2O比CuO更稳定的原因:
(5)Cu2O的晶胞结构如图所示,该结构中O原子的配位数是

您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
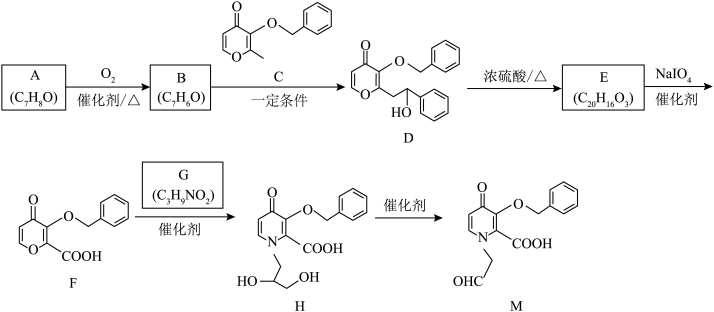
【推荐2】有机物M是合成治疗汉坦病毒药物的中间体。某实验室由芳香化合物A制备M的一种合成路线如下:
(1)A的化学名称为_______ ;B+C→D的反应类型为_______ ;E的结构简式为_______ 。
(2)F+G→H的化学方程式为_______ ;G中所含官能团的名称为_______ 。
(3)M中碳原子的杂化方式为_______ 。
(4)Q为F的同分异构体,同时满足下列条件的Q的结构有_______ 种(不考虑立体异构)。
③核磁共振氢谱中有6组吸收峰
①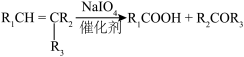 ;
;
②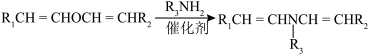 。
。
(1)A的化学名称为
(2)F+G→H的化学方程式为
(3)M中碳原子的杂化方式为
(4)Q为F的同分异构体,同时满足下列条件的Q的结构有
①含有 结构
结构
③核磁共振氢谱中有6组吸收峰
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】氮、砷、铜、钒、钛等元素在化学领域具有重要的地位。请回答问题:
(1)第二周期元素中,第一电离能在B和N之间元素有___________ (填元素符号)。
(2)雌黄的分子式为 ,其分子结构为
,其分子结构为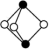 ,其中As原子的杂化轨道类型为
,其中As原子的杂化轨道类型为___________ 。
(3)原子核外电子发生跃迁时会吸收或释放不同的光,可以用___________ 摄取铜元素的原子光谱;基态Cu原子核外电子的空间运动状态有___________ 种。
(4)钒(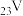 )是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。
)是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。
①写出钒原子外围电子轨道表示式:___________ 。
②V2O5常用作SO2转化为SO3的催化剂。SO2分子的空间结构为___________ 。SO3的三聚体环状结构如图所示,该结构中S-O键长大致分为两类,一类键长约140pm,另一类键长约160pm,较短的键为___________ (填图中字母),该分子中含有___________ 个 键。
键。___________ 。
(6)TiO2是金红石的主要成分,其晶胞结构如图所示,设Ti和O原子半径分别为 和
和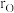 (单位:pm),晶胞的长宽高分别为a、b、c(单位:cm),则晶胞中原子的空间利用率为
(单位:pm),晶胞的长宽高分别为a、b、c(单位:cm),则晶胞中原子的空间利用率为___________ (列出计算表达式)。(空间利用率指构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比)
(1)第二周期元素中,第一电离能在B和N之间元素有
(2)雌黄的分子式为
 ,其分子结构为
,其分子结构为 ,其中As原子的杂化轨道类型为
,其中As原子的杂化轨道类型为(3)原子核外电子发生跃迁时会吸收或释放不同的光,可以用
(4)钒(
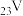 )是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。
)是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。①写出钒原子外围电子轨道表示式:
②V2O5常用作SO2转化为SO3的催化剂。SO2分子的空间结构为
 键。
键。
(6)TiO2是金红石的主要成分,其晶胞结构如图所示,设Ti和O原子半径分别为
 和
和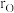 (单位:pm),晶胞的长宽高分别为a、b、c(单位:cm),则晶胞中原子的空间利用率为
(单位:pm),晶胞的长宽高分别为a、b、c(单位:cm),则晶胞中原子的空间利用率为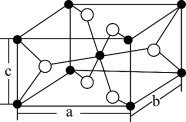
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
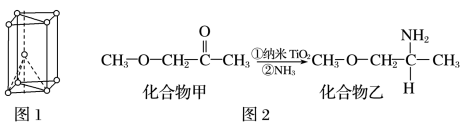
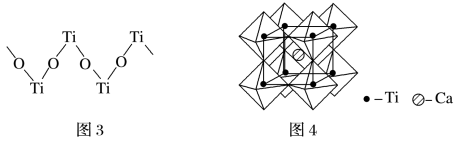
【推荐1】钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:______________ ,其原子核外共有_______ 种运动状态不相同的电子, 金属钛晶胞如图1所示,为________ 堆积(填堆积方式)。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,据此可知TiCl4形成的晶体类型为________ 。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2,化合物乙的沸点明显高于化合物甲,主要原因是______________ ,化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为______________ 。___________________ ,其化学式为_________________ 。
(5)钙钛矿晶体的结构如图4所示,钛离子位于立方晶胞的角顶,被_______ 个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被_________ 个氧离子包围, 钙钛矿晶体的化学式为______________ 。

(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,据此可知TiCl4形成的晶体类型为
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2,化合物乙的沸点明显高于化合物甲,主要原因是
(5)钙钛矿晶体的结构如图4所示,钛离子位于立方晶胞的角顶,被
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】回答下列问题:
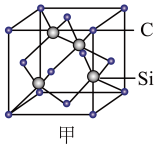
(1)金刚砂(SiC)的硬度为9.5,其晶胞结构如图甲所示,则金刚砂晶体类型为______ ;在SiC中,每个C原子周围最近的C原子数目为______ ;若晶胞的边长为apm,则金刚砂的密度表达式为______ 。______ 个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为______ 。若该硅晶体的密度为ρg•cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个硅原子之间的距离为______ (用代数式表示即可)。
(1)金刚砂(SiC)的硬度为9.5,其晶胞结构如图甲所示,则金刚砂晶体类型为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】X、Y、Z、W为原子序数依次增大的前四周期元素,基态X原子有3个未成对电子,基态Y原子中s电子数与p电子数相等,且轨道中有未成对电子,Z与X同族,W2+离子的核外M层全充满,回答下列问题:
(1)Z原子核外电子有_______ 种空间运动状态,W在周期表中的位置为_______ 。
(2)X与Y的第一电离能I1(X)_______ I1(Y)(填“>”、“=”或“<”),原因是_______ 。
(3)Z4是Z元素的常见单质,其易溶于CS2,难溶于水,可能原因是_______ 。
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为a nm,侧面棱长为c nm),其晶胞结构如图甲所示;晶胞中碳原子的投影位置如图乙所示。

①A原子的分数坐标为_______ 。
②已知该新型材料的摩尔质量为M g/mol,阿伏加德罗常数的值用NA表示,则密度为_______ g/cm3(用含a、c、M、NA的计算式表示)。
(1)Z原子核外电子有
(2)X与Y的第一电离能I1(X)
(3)Z4是Z元素的常见单质,其易溶于CS2,难溶于水,可能原因是
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为a nm,侧面棱长为c nm),其晶胞结构如图甲所示;晶胞中碳原子的投影位置如图乙所示。

①A原子的分数坐标为
②已知该新型材料的摩尔质量为M g/mol,阿伏加德罗常数的值用NA表示,则密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】在新型冠状病毒疫情中常用84消毒液进行消毒,有效成分为NaClO溶液,其主要是基于次氯酸(HClO)的氧化性。氯所在的卤族元素在生产生活中有广泛应用,回答以下问题:
(1)基态氯原子的核外价电子排布式为__________ ,HClO分子中中心原子的杂化轨道类型为__________ 。
(2)生产农药的原料PSCl3中,P、S、Cl的电负性由大到小的顺序为_________ 。
(3)①与Cl相邻的元素S、F,其化化物SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能,则S-F键的键能为__________ 。
②硫和氧形成的链状化合物结构如图(C),其化学式为__________ 。
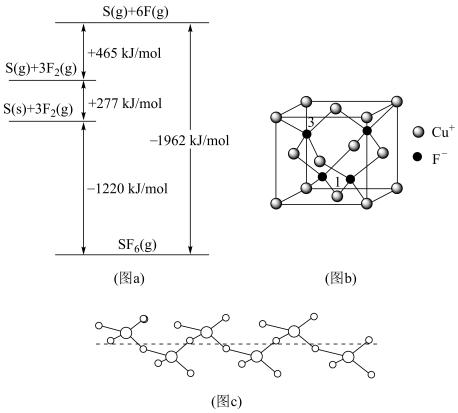
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF的熔点比CuCl的高,原因是_________ 。
②工业上将CuCl溶入KCN溶液中配制成镀铜液,镀铜液中配合物化学式为__________ ,写出一种与配体互为等电子体的阳离子的电子式__________ 。
③CuF晶胞如图(b),晶胞边长为a nm。则Cu+与F-最近的距离为________ 。用Mg·mol-1表示CuF的摩尔质量,NA表示阿伏加 德罗常数的值,则CuF晶体的密度为______ g·cm-3。
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图(b)中离子1的坐标为( ,
, ,0),则离子3的坐标为
,0),则离子3的坐标为__________ 。
(1)基态氯原子的核外价电子排布式为
(2)生产农药的原料PSCl3中,P、S、Cl的电负性由大到小的顺序为
(3)①与Cl相邻的元素S、F,其化化物SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能,则S-F键的键能为
②硫和氧形成的链状化合物结构如图(C),其化学式为

(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF的熔点比CuCl的高,原因是
②工业上将CuCl溶入KCN溶液中配制成镀铜液,镀铜液中配合物化学式为
③CuF晶胞如图(b),晶胞边长为a nm。则Cu+与F-最近的距离为
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图(b)中离子1的坐标为(
 ,
, ,0),则离子3的坐标为
,0),则离子3的坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是__ 。基态K+的电子排布式为__ 。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是__ ,中心原子的杂化方式为__ 。NaBH4中存在__ (填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为__ ,其中Be的配位数为__ 。
(4)第三周期元素氟化物的熔点如下表:
解释表中氟化物熔点变化的原因:___ 。
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加 德罗常数的值为NA,则CaF2的密度ρ=__ g·cm-3(列出计算表达式)。
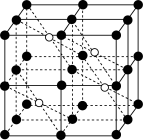
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为
(4)第三周期元素氟化物的熔点如下表:
| 化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
| 熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加 德罗常数的值为NA,则CaF2的密度ρ=

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】由S、Cl及Fe、Co、Ni 等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的电子排布式为____ ,P、S、C1的第一电离能由大到小顺序为______ 。
(2)SCl2分子中的中心原子杂化轨道类型是_______ ,该分子空间构型为________ 。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_______ 。Ni(CO)4中σ键与π键个数比为______ ,已知:Ni(CO)4熔点-19.3℃,沸点43℃,则Ni(CO)4为_______ 晶体。
(4)已知NiO的晶体结构如图所示。

①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的___ 体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO____ NiO( 填“ >”、“<”或“=”),理由是_______________ 。
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图),已知O2-的半径为am,每平方米面积上分散的NiO的质量为______ g。(用a、NA表示)
(1)钴元素基态原子的电子排布式为
(2)SCl2分子中的中心原子杂化轨道类型是
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为
(4)已知NiO的晶体结构如图所示。

①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图),已知O2-的半径为am,每平方米面积上分散的NiO的质量为
您最近一年使用:0次



