(1)Fe2+基态核外电子排布式为
(2)写出一种与CO2互为等电子体的阴离子:
(3)碳酸乙烯酯中碳原子杂化轨道类型为
 键数目为
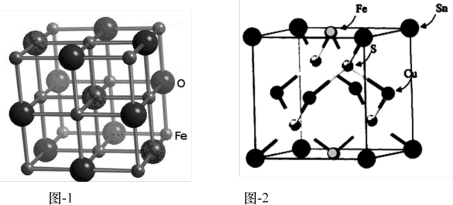
键数目为(4)FeO晶胞结构如图-1所示,晶体中与每个Fe2+紧邻的Fe2+有
相似题推荐
(1)氮原子中有
a.球形 b.哑铃形
(2)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),组成元素的电负性大小顺序是
(3)依据对角线规则,B的化学性质与第三周期
(4)第一电离能I1(N)
(5)氨硼烷水解制氢可以通过催化剂进行可控放氢,Fe-Ni合金作为氨硼烷水解的催化剂,表现出很好的催化活性,写出基态Ni原子的价层电子排布式
(1) 铜元素在元素周期表中的位置为
(2) 铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如图反应实现铜离子的富集回收。
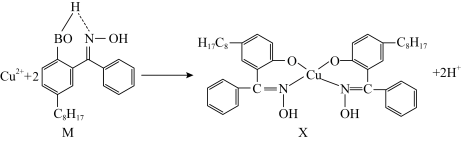
① M所含元素的电负性由大到小的顺序为
② X中采用sp3杂化的非金属原子有
(3) 在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是
(4) 向蓝色[Cu(H2O)4]2+硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。通过上述实验现象可知,与Cu2+的配位能力:H2O
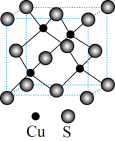
(5) CuS与ZnS的晶胞相似,结构如图所示。CuS晶胞中与硫原子距离最近且相等的硫原子有12个,若CuS晶胞的密度为ρ g·cm-3,用NA代表阿伏加 德罗常数的值,则晶胞边长为
二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。

回答下列问题:
(1)锌基态离子的价电子排布式为
(2)乙二醇中C、H、O的电负性大小关系是
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,[Zn(H2O)6]2+中所含化学键的类型为
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有
(2)C、O和Ti电负性由大到小的顺序为
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。
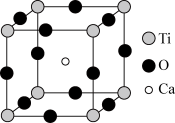
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为
(1)F在周期表中的位置是
(2)A元素与其他元素形成的含氧酸中,酸根呈三角锥结构的酸是
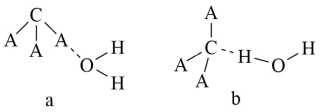
(3)CA3极易溶于水,试从下图中判断CA3溶于水后形成CA3·H2O的合理结构为
(4)元素B可形成H3BO3,已知H3BO3的电离方程式为H3BO3+2 H2O⇌[B(OH)4]一+H3O+
①基态B、D原子的第一电离能由小到大的顺序为
②[B(OH)4]一中B原子的杂化类型为
③写出一种与H3O+互为等电子体的分子的化学式:
④H3BO3晶体在热水中的溶解度大于冷水中的溶解度的原因为
(1)基态P原子的价电子排布式为
(2)磷的一种同素异形体是白磷(P4),其分子的空间构型为
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因
(4)常温下PCl5是一种白色晶体,其立方晶系晶胞结构模型如图所示,由A、B两种微粒构成。将其加热至148 ℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为

(5)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞,其中每个原子均满足8电子稳定结构,P原子的配位数为
(1)参照下图B、F元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出C、N、O 三种元素的相对位置。

(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为
(3)二卤化铅PbX2 的熔点如图(b)所示,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性

(4)NH3和F2 在Cu催化下可发生反应4NH3+3F2
 NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有
NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

晶体R 中含有的化学键包括
(6)水杨酸第一级电离形成离子
 ,相同温度下,水杨酸的Ka2
,相同温度下,水杨酸的Ka2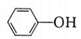 )的Ka(填“>”“ =”或“<”),其原因是
)的Ka(填“>”“ =”或“<”),其原因是(7)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为

 、对苯二甲酸(
、对苯二甲酸(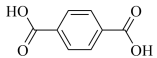 )、乙醇混合溶液,将析出一种晶体X(晶胞结构如图),甲酸根全部被交换到溶液中。X对热稳定,磁矩约为1.732BM[磁矩
)、乙醇混合溶液,将析出一种晶体X(晶胞结构如图),甲酸根全部被交换到溶液中。X对热稳定,磁矩约为1.732BM[磁矩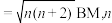 为中心离子未成对电子数]。
为中心离子未成对电子数]。
回答下列问题:
(1)由磁矩推算X中铜离子的未成对电子数为
(2)H、C、O、Cu的电负性从大到小的顺序是
 比HCOOH酸性更弱,原因是
比HCOOH酸性更弱,原因是(3)对苯二甲酸的熔点(427℃)高于对二硝基苯(
 ,相对分子质量为168,熔点为173℃)的主要原因是
,相对分子质量为168,熔点为173℃)的主要原因是(4)如图所示,Cu(Ⅱ)配合物A和B可发生配位构型的转变,该转变可带来颜色的变化,因此可用作热致变色材料,在温度传感器、变色涂料等领域应用广泛。


已知:当Cu(Ⅱ)配合物配位构型由八面体转变为平面四边形时,吸收光谱蓝移,配合物颜色由紫色变为橙色。想将配合物的颜色由紫色调整为橙色,需要进行的简单操作为
(5)X晶胞中含有
 的数目为
的数目为 ,所得晶体中Cu、N个数比约为1:
,所得晶体中Cu、N个数比约为1: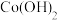 、
、 、
、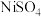 和
和 、
、 单质]制备
单质]制备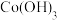 和高纯
和高纯 的流程如下。
的流程如下。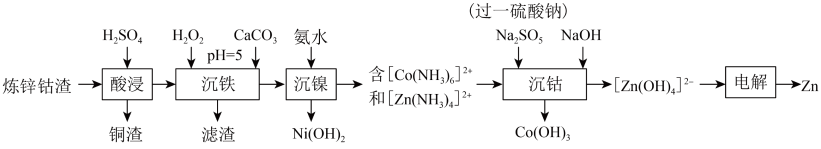
 时,
时,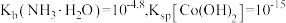
②锌的化合物与铝的化合物部分性质有相似性
请回答下列问题:
(1)写出“酸浸”过程中
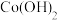 发生反应的离子方程式
发生反应的离子方程式(2)“沉铁”过程中
 实际用量远大于理论用量的主要原因
实际用量远大于理论用量的主要原因 的作用为
的作用为(3)“沉镍”过程
 对溶液中
对溶液中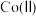 、
、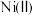 含量的影响如图。
含量的影响如图。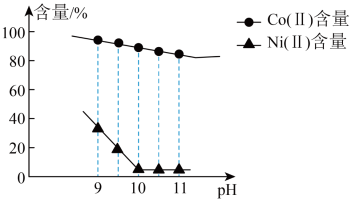
②该过程
 可能发生的反应如下:
可能发生的反应如下: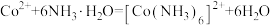
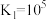


则

(4)“沉钴”过程生成
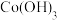 的离子方程式为
的离子方程式为(5)在电解过程中为了保持电解液成分稳定,应不断加入
(6)将含有未成对电子的物质置于外磁场中,会使磁场的强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
A. | B. | C. | D.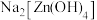 |

试回答下列问题:
(1)k的基态原子核外有
(2)c、d、e三元素形成的X、Y两种物质的分子结构和部分物理性质如下表,两者熔沸点差异的主要原因是
| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X |  | 0.2 | 45 | 100 |
| Y |  | 1.7 | 114 | 295 |
| 元素 | o | p | |
| 电离能/(kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
II铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(4)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是
 的立体构型是
的立体构型是(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为

(7)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为
 。
。
(1)甲烷在一定条件下可生成以下微粒:
A.碳正离子(
 ) B.碳负离子(
) B.碳负离子(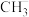 ) C.甲基(
) C.甲基(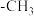 ) D.碳烯(
) D.碳烯(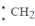 )
)①四种微粒中,键角为120°的是
②碳负离子(
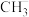 )的空间构型为
)的空间构型为(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)
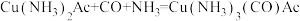 。请回答下列问题:
。请回答下列问题:①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为
②在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子轨道的杂化类型为
 键的数目为
键的数目为③Cu与O形成的某种化合物的晶胞结构如图所示,若阿伏加德罗常数的值为
 ,晶胞的边长为apm,则该晶体的密度为
,晶胞的边长为apm,则该晶体的密度为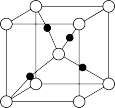
(1)Cr的外围电子排布图为
(2)SO2分子的空间构型为
(3)SCN的电子式为
(4)四种分子:①CH4、②SO3、③H2O、④NH3,键角由大到小的排列顺序是
(5)NH3分子可以与H+ 结合生成NH4+,这个过程发生改变的是
a. 微粒的空间构型 b. N原子的杂化类型 c. H-N-H的键角 d. 微粒的电子数
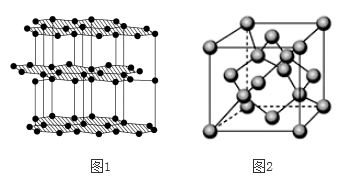
(6)由碳元素形成的某种单质的片状和层状结构如图1所示,由碳元素形成的某种晶体的晶胞结构如图2所示,试回答:
①在图1中,碳原子所形成的六元环数、C原子数、C-C键数之比为
②在图2中,已知阿伏伽德罗常数为NA,晶体密度为ρ g/cm3,则该晶体的棱长为