已知某些化学键的键能数据如下:
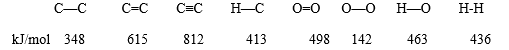
(1)通过比较C—C 和 C=C 的键能大小,简要说明为什么烯烃易发生加成反应而烷烃不能?______ 。
(2)利用键能数据可判断反应 2H2 + O2 → 2 H2O 为 放热反应, 计算每生成 1 mol H2O 所放出的热量为_____________ kJ。
(3)若某有机物的结构简式如下: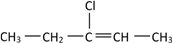 ,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:
,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:________________
(4)将硫酸铜白色固体溶于水得到蓝色的溶液,原因是生成了一种配合离子,其结构简式为:___________ (标明配位键),向该溶液中加入过量稀氨水得深蓝色溶液,其离子方程式为 _________ 。已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是_________________________________ 。
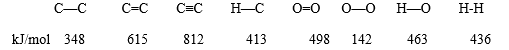
(1)通过比较C—C 和 C=C 的键能大小,简要说明为什么烯烃易发生加成反应而烷烃不能?
(2)利用键能数据可判断反应 2H2 + O2 → 2 H2O 为 放热反应, 计算每生成 1 mol H2O 所放出的热量为
(3)若某有机物的结构简式如下:
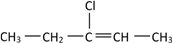 ,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:
,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:(4)将硫酸铜白色固体溶于水得到蓝色的溶液,原因是生成了一种配合离子,其结构简式为:
更新时间:2018-10-11 14:22:26
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.在1×105Pa, 25℃时,H-H键、N ≡N键和N- H键的键能分别为436 kJ·mol-1、945 kJ·mol-1和391 kJ·mol-1。
(1)①根据上述数据判断工业合成氨的反应是___________ (填“吸热”或“放热”)反应:
②25℃时,在催化剂存在下进行反应,消耗1 mol氮气和3 mol氢气,理论上放出或吸收的热量为Q1,实际生产中,加入0.5 mol氮气和1.5 mol氢气放出或吸收的热量为Q2, Q1与Q2比较,正确的是___________ 。
a. Q1> 2Q2 b. Q1<2Q2 C. Q1=2Q2 d.2Q1<Q2
Ⅱ. 某可逆反应在体积为5L的密闭容器中进行,0~3 min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。
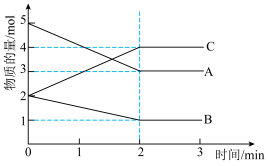
(2)该反应的化学方程式为___________ 。
(3)反应开始至2min时,B的平均反应速率为___________ 。
(4)能说明该反应已达到平衡状态的是___________ (填字母)。
a. v(A)=2v(B)
b.容器内混合气体的密度保持不变
c.2v正(A)=v逆(B)
d.容器内各物质浓度保持不变
(5)在密闭容器里,通入一定量的A、B、C,发生上述反应。达平衡后,当改变下列条件时,反应速率会减小的是___________ (填序号)。
①降低温度 ②加入正催化剂 ③减小容器容积
Ⅲ.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图:
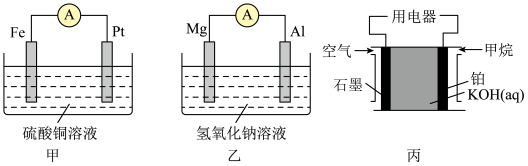
(6)乙装置中负极反应式为___________ 。
(7)丙装置中溶液碱性___________ (填“增强”或“减弱”)。
(8)假设开始时甲装置中两电极质量相等,导线中转移0.3 mol电子时,两电极质量相差___________ g。
(1)①根据上述数据判断工业合成氨的反应是
②25℃时,在催化剂存在下进行反应,消耗1 mol氮气和3 mol氢气,理论上放出或吸收的热量为Q1,实际生产中,加入0.5 mol氮气和1.5 mol氢气放出或吸收的热量为Q2, Q1与Q2比较,正确的是
a. Q1> 2Q2 b. Q1<2Q2 C. Q1=2Q2 d.2Q1<Q2
Ⅱ. 某可逆反应在体积为5L的密闭容器中进行,0~3 min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。

(2)该反应的化学方程式为
(3)反应开始至2min时,B的平均反应速率为
(4)能说明该反应已达到平衡状态的是
a. v(A)=2v(B)
b.容器内混合气体的密度保持不变
c.2v正(A)=v逆(B)
d.容器内各物质浓度保持不变
(5)在密闭容器里,通入一定量的A、B、C,发生上述反应。达平衡后,当改变下列条件时,反应速率会减小的是
①降低温度 ②加入正催化剂 ③减小容器容积
Ⅲ.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图:

(6)乙装置中负极反应式为
(7)丙装置中溶液碱性
(8)假设开始时甲装置中两电极质量相等,导线中转移0.3 mol电子时,两电极质量相差
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)已知2molH2完全燃烧生成液态水时放出572kJ热量,则2molH2完全燃烧生成水蒸气时放出热量_______ (填大于、等于或小于)572kJ。
(2)现已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ):
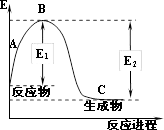
根据以上键能数据计算N—H键的键能为_______ kJ/mol。
(3)N4分子结构为正四面体,与白磷分子相似,如图所示。
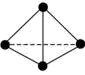
已知N-N键、N≡N键的键能分别为193kJ/mol、940kJ/mol,则1mol N4气体转化为N2时需___ (填“吸收”或“放出”)___ kJ能量。
(2)现已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ):

| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 436 | 946 |
根据以上键能数据计算N—H键的键能为
(3)N4分子结构为正四面体,与白磷分子相似,如图所示。

已知N-N键、N≡N键的键能分别为193kJ/mol、940kJ/mol,则1mol N4气体转化为N2时需
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I.下列是中学化学中熟悉的物质,请用序号完成下列问题
①O2②Na2O2③NH4Cl④HCl⑤NaOH⑥CaCl2⑦氦气
(1)这些物质中,只含共价键的是_______ 。只含离子键的是_______ 。既含共价键又含离子键的是_______ 。
(2)属于离子化合物的是_______ 。
II.已知拆开1 mol H﹣H键、1 mol I﹣I、1 mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘反应生成1 mol HI需要_______ (填“放出”或“吸收”)_______ kJ的热量。
①O2②Na2O2③NH4Cl④HCl⑤NaOH⑥CaCl2⑦氦气
(1)这些物质中,只含共价键的是
(2)属于离子化合物的是
II.已知拆开1 mol H﹣H键、1 mol I﹣I、1 mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘反应生成1 mol HI需要
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】龙涎香与麝香、灵猫香、海狸香并称四大动物香料,自古就是最为稀有和名贵的天然香料。天然龙涎香来自抹香鲸,由于鲸类濒临灭绝,来源极为稀少国际市价相当于黄金。降龙涎醚是龙涎香的真正发香成分,也是公认的天然龙涎香最佳代用品,目。前工业上由香紫苏醇经香紫苏内酯合成。香紫苏醇来源于芳香植物香紫苏(陕北南泥湾等地已大规模种植多年)。一种由香紫苏醇合成降龙涎醚的路线如下:

(1)香紫苏醇分子中有几个手性碳原子?指出侧链上和环内带有羟基的手性碳原子的构型(用R、S表示)_________ 。
(2)香紫苏醇经高锰酸钾氧化得到香紫苏内酯和另一副产物E的的混合物,该混合物经水解、酸化和成环后,得到同一产物香紫苏内酯。E的相对分子质量为310. 43, 其组成为C 69. 64%,H 9.74%,O 20.62%。请写出E的立体结构式_________ 。
(3)写出中间产物a和降龙涎醚的立体结构式_________ (用楔形线表示)。
(4)写出由中间产物a到降龙涎醚的最可能反应机理(用反应式表示)_________ 。
(5)上述合成路线中有2个步骤用到相转移催化剂,请推荐一种合适的相转移催化剂_________ (写出具体化合物,用名称或结构式表示)。
(6)使用氢化铝锂的缺点除价格昂贵外,还有其他什么不利之处?简述理由_________ 。

(1)香紫苏醇分子中有几个手性碳原子?指出侧链上和环内带有羟基的手性碳原子的构型(用R、S表示)
(2)香紫苏醇经高锰酸钾氧化得到香紫苏内酯和另一副产物E的的混合物,该混合物经水解、酸化和成环后,得到同一产物香紫苏内酯。E的相对分子质量为310. 43, 其组成为C 69. 64%,H 9.74%,O 20.62%。请写出E的立体结构式
(3)写出中间产物a和降龙涎醚的立体结构式
(4)写出由中间产物a到降龙涎醚的最可能反应机理(用反应式表示)
(5)上述合成路线中有2个步骤用到相转移催化剂,请推荐一种合适的相转移催化剂
(6)使用氢化铝锂的缺点除价格昂贵外,还有其他什么不利之处?简述理由
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】3-氯-2-丁氨酸的结构简式为 ,该有机物分子中含有
,该有机物分子中含有___________ 个手性碳原子;其中-NH2中N原子的杂化轨道类型是___________ 。
 ,该有机物分子中含有
,该有机物分子中含有
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】学习有机化学,掌握有机物的组成、结构、命名和官能团性质是重中之重。
(1) 的分子式为
的分子式为_______ ,所含官能团的名称为_______ 。
(2)烃A的结构简式为 ,用系统命名法命名烃A:
,用系统命名法命名烃A:_______ 。
(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为: ,下列各物质:
,下列各物质:

与麻黄素互为同分异构体的是_______ (填字母,下同),互为同系物的是_______ (填字母)。
(4)当有机化合物分子中碳原子连有四个不同基团时称为手性碳原子,如A中星号“*”碳原子就是手性碳原子。

若使A失去手性,下列方法可行的是_______ 。
A.一定条件下和乙醇发生酯化反应 B.一定条件下和乙酸发生酯化反应
C.一定条件下发生催化氧化反应 D.一定条件下发生消去反应
(1)
 的分子式为
的分子式为(2)烃A的结构简式为
 ,用系统命名法命名烃A:
,用系统命名法命名烃A:(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为:
 ,下列各物质:
,下列各物质:
与麻黄素互为同分异构体的是
(4)当有机化合物分子中碳原子连有四个不同基团时称为手性碳原子,如A中星号“*”碳原子就是手性碳原子。

若使A失去手性,下列方法可行的是
A.一定条件下和乙醇发生酯化反应 B.一定条件下和乙酸发生酯化反应
C.一定条件下发生催化氧化反应 D.一定条件下发生消去反应
您最近一年使用:0次
【推荐1】铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________ 种运动状态不同的电子,Fe3+基态核外电子排布式为_______________ 。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________ (用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________ ;HCN中C原子轨道的杂化类型为__________ 。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________ 。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________ ,其中Fe的配位数为_____________ 。
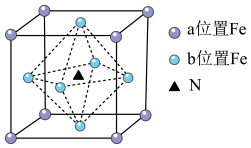
(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0, ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为__________ 、__________ 。N与Fe原子之间最短距离a pm。设阿伏加 德罗常数的值为NA,则该铁氮化合物的密度是__________ g·cm-3(列出计算表达式)。
(1)铁原子核外有
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,
 ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1) Zn原子基态核外电子排布式为___________________ 。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①SO42-中心原子的轨道杂化类型为_____ ,与它互为等电子体的阴离子化学式为____ (写出一种)。
②在[Zn(NH3)4]2+中Zn2+与NH3之间形成的化学键为___ ,提供孤电子对的成键原子是____ 。 ③氨的热稳定性强于膦(PH3),原因是_______ 。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为:ICu=746kJ/mol,Izn=906 kJ/mol,ICu < Izn的原因是_____________ 。
(4)《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。
Zn、C、O电负性由大至小的顺序是________ 。ZnCO3中阴离子的立体构型是______ 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为____________ 。
晶胞边长为a pm,阿伏伽德罗常数为NA,则ZnS晶体的密度为_____ g/cm3 (列出计算式即可)
(1) Zn原子基态核外电子排布式为
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①SO42-中心原子的轨道杂化类型为
②在[Zn(NH3)4]2+中Zn2+与NH3之间形成的化学键为
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为:ICu=746kJ/mol,Izn=906 kJ/mol,ICu < Izn的原因是
(4)《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。
Zn、C、O电负性由大至小的顺序是
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为
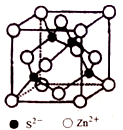
晶胞边长为a pm,阿伏伽德罗常数为NA,则ZnS晶体的密度为
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
【推荐3】(1)中国古代四大发明之一—黑火药,它的爆炸反应为:2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_______ 。
②在生成物中,A的晶体类型为____ ,含极性共价键的分子的中心原子轨道杂化类型为_____ 。
③已知CN-与N2结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为______ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,T的基态原子外围电子(价电子)排布为______ ,Q2+的未成对电子数是_______ 。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+,交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 ml,可知该配离子的化学式为_______ 。
 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的晶体类型为
③已知CN-与N2结构相似,推算HCN分子中
 键与
键与 键数目之比为
键数目之比为(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,T的基态原子外围电子(价电子)排布为
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+,交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 ml,可知该配离子的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】超分子化学在识别、催化、传输等功能方面已迅速渗透到各学科领域。如图是一种由两个相同分子(a)组装形成的分子盒(b)。请回答:
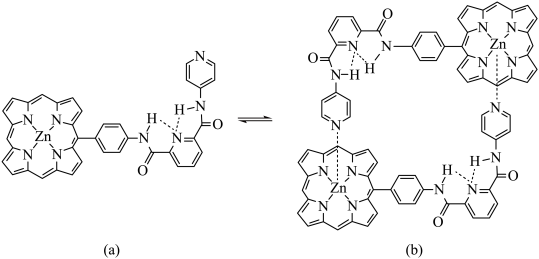
(1)两分子(a)通过______ 结合成(b)。
(2)(a)分子中C原子的杂化方式为______ ,基态Zn的价层电子轨道表示式为______ 。
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为_____ 。

(1)两分子(a)通过
| A.离子键 | B.配位键 | C.氢键 | D.分子间作用力 |
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】碳、氮、氧、氟、硫是中学常见的非金属元素,铁离子可与由这几种元素组成的SCN-、CN-、F-等形成很多配合物。
(1)基态Fe原子中,电子占据的最高电子层符号为__ ,该电子层具有的原子轨道数为__ 。
(2)已知(CN)2是直线形分子,并有对称性,则(CN)2中π键和σ键的个数比为__ ;在配合物[Fe(SCN)]2+中,提供空轨道接受孤对电子的微粒是__ 。
(3)配合物K4[Fe(CN)6]中不存在的作用力是__ (填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
(4)写出一种与SCN-互为等电子体的分子__ (用化学式表示),该分子的空间构型为__ 。
(5)已知乙烯酮(CH2=C=O)是一种重要的有机中间体,可由CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子的杂化轨道类型是__ 。1mol(C2H5O)3P=O分子中含有的σ键的物质的量为__ 。
(1)基态Fe原子中,电子占据的最高电子层符号为
(2)已知(CN)2是直线形分子,并有对称性,则(CN)2中π键和σ键的个数比为
(3)配合物K4[Fe(CN)6]中不存在的作用力是
A.极性键 B.离子键 C.非极性键 D.配位键
(4)写出一种与SCN-互为等电子体的分子
(5)已知乙烯酮(CH2=C=O)是一种重要的有机中间体,可由CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子的杂化轨道类型是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】请回答下列问题:
(1)(NH4)2SO4中含有化学键的类型为_________________________ 。
(2)KNO3中NO3-的立体构型为____________________ ,其中N原子的杂化方式为________ ,写出与NO 互为等电子体的另一种阴离子的化学式:
互为等电子体的另一种阴离子的化学式:_______________ 。
(3)已知配合物CrCl3·6H2O中心原子Cr3+的配位数为6,向含0.1 mol CrCl3·6H2O的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50 mL,则该配合物的化学式为________________ ,Cr在基态时,价电子排布式为_____________________ 。
(4)LiBH4由Li+和BH4-构成,BH4-的立体构型是____________ ,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为____________ 。
(5)丙酮( )分子中C原子轨道杂化类型为
)分子中C原子轨道杂化类型为_____________ ;含有的π键与σ键数目之比为___________ 。
(6)第一电离能I 1(Zn)______ I 1(Cu)(填“大于”或“小于”),原因是_______________ 。
(1)(NH4)2SO4中含有化学键的类型为
(2)KNO3中NO3-的立体构型为
 互为等电子体的另一种阴离子的化学式:
互为等电子体的另一种阴离子的化学式:(3)已知配合物CrCl3·6H2O中心原子Cr3+的配位数为6,向含0.1 mol CrCl3·6H2O的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50 mL,则该配合物的化学式为
(4)LiBH4由Li+和BH4-构成,BH4-的立体构型是
(5)丙酮(
 )分子中C原子轨道杂化类型为
)分子中C原子轨道杂化类型为(6)第一电离能I 1(Zn)
您最近一年使用:0次



