明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1) Zn原子基态核外电子排布式为___________________ 。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①SO42-中心原子的轨道杂化类型为_____ ,与它互为等电子体的阴离子化学式为____ (写出一种)。
②在[Zn(NH3)4]2+中Zn2+与NH3之间形成的化学键为___ ,提供孤电子对的成键原子是____ 。 ③氨的热稳定性强于膦(PH3),原因是_______ 。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为:ICu=746kJ/mol,Izn=906 kJ/mol,ICu < Izn的原因是_____________ 。
(4)《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。
Zn、C、O电负性由大至小的顺序是________ 。ZnCO3中阴离子的立体构型是______ 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为____________ 。
晶胞边长为a pm,阿伏伽德罗常数为NA,则ZnS晶体的密度为_____ g/cm3 (列出计算式即可)
(1) Zn原子基态核外电子排布式为
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①SO42-中心原子的轨道杂化类型为
②在[Zn(NH3)4]2+中Zn2+与NH3之间形成的化学键为
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为:ICu=746kJ/mol,Izn=906 kJ/mol,ICu < Izn的原因是
(4)《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。
Zn、C、O电负性由大至小的顺序是
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为
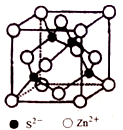
晶胞边长为a pm,阿伏伽德罗常数为NA,则ZnS晶体的密度为
更新时间:2017-05-17 07:24:29
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)氯原子核外有________ 种不同运动状态的电子;基态溴原子的价电子排布式为_______ ;比较氟、氯、溴单质熔点的高低并说明理由___________ 。
(2)HF极易溶于水的原因是______ 。
(3)已知高碘酸有两种形式,化学式分别为H5IO6(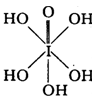 )和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______ HIO4。(填“>”、“<”或“=”)
(4)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____ ,中心原子的杂化类型为_____ 。
(5)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________ (多选,填字母);
A.金属键 B.离子键 C.极性键 D.非极性键 E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为_______ g·cm-3(用含a、NA的式子表示)。
(2)HF极易溶于水的原因是
(3)已知高碘酸有两种形式,化学式分别为H5IO6(
 )和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6(4)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为
(5)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有
A.金属键 B.离子键 C.极性键 D.非极性键 E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】[化学-选修3:物质结构与性质] 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是___________ (填元素符号),解释原因_____________________________________________ 。
(2)二甲基二硫和甲酸中,在水中溶解度较大的是__________ (填名称),原因是_____________ ;烧碱所属的晶体类型为________ ;硫化碱(Na2S)的S2-的基态电子排布式是________________ 。
(3)硝酸铵中,NO3-的立体构型为____ ,中心原子的杂化轨道类型为___________ 。
(4)1mol化合物NaCN中CN-所含的π键数为______ ,与-CN互为等电子体的分子有__ 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式________________ 。

(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________ ;晶胞中K 原子的配位数为___ ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 __________ (列出计算式,不需要计算出结果)。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是
(2)二甲基二硫和甲酸中,在水中溶解度较大的是
(3)硝酸铵中,NO3-的立体构型为
(4)1mol化合物NaCN中CN-所含的π键数为

(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图_______ 。
(2)在1mol DC2中,有___ mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有___ 个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是_____ (填元素符号),三种10e-的化合物中沸点最低的___ 。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是__________ 。
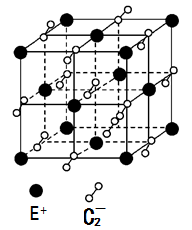
A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
(1)画出C元素的原子结构示意图
(2)在1mol DC2中,有
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】铜、镁等是非常重要的金属元素,回答下列问题:
(1) 在周期表中
在周期表中_______ 区,焰色反应时 的4s电子会跃迁至4p轨道,写出
的4s电子会跃迁至4p轨道,写出 的激发态电子排布式
的激发态电子排布式_______ 。
(2)分别向 、
、 溶液中加氨水至过量,前者生成白色沉淀,后者得到深蓝色溶液。白色沉淀的化学式为
溶液中加氨水至过量,前者生成白色沉淀,后者得到深蓝色溶液。白色沉淀的化学式为_______ ,形成深蓝色溶液的离子的化学式为_______ 。
(3)若在
 溶液中通入足量
溶液中通入足量 气体,使
气体,使 完全沉淀为
完全沉淀为 ,此时溶液中
,此时溶液中 浓度为
浓度为_______ (不考虑溶液体积变化)。
(4)高温下 容易转化为
容易转化为 ,试从原子结构角度解释原因:
,试从原子结构角度解释原因:_______ 。
(5)溶液中的水存在 、
、 等微粒形式,
等微粒形式, 可看作是
可看作是 与
与 通过氢键形成的离子,则
通过氢键形成的离子,则 的结构式为
的结构式为_______ , 空间构型为
空间构型为_______ 。
(1)
 在周期表中
在周期表中 的4s电子会跃迁至4p轨道,写出
的4s电子会跃迁至4p轨道,写出 的激发态电子排布式
的激发态电子排布式(2)分别向
 、
、 溶液中加氨水至过量,前者生成白色沉淀,后者得到深蓝色溶液。白色沉淀的化学式为
溶液中加氨水至过量,前者生成白色沉淀,后者得到深蓝色溶液。白色沉淀的化学式为(3)若在

 溶液中通入足量
溶液中通入足量 气体,使
气体,使 完全沉淀为
完全沉淀为 ,此时溶液中
,此时溶液中 浓度为
浓度为(4)高温下
 容易转化为
容易转化为 ,试从原子结构角度解释原因:
,试从原子结构角度解释原因:(5)溶液中的水存在
 、
、 等微粒形式,
等微粒形式, 可看作是
可看作是 与
与 通过氢键形成的离子,则
通过氢键形成的离子,则 的结构式为
的结构式为 空间构型为
空间构型为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】短周期的元素在自然界中比较常见,尤其是非金属元素及其化合物在社会生活中有着很重要的作用。
(1)补全元素周期表中符号。
表中元素形成的最稳定氢化物是_____ ,该氢化物在CCl4中的溶解度比在水中的溶解度_____ (填“大”或“小”)。
(2)硅原子核外电子运动状态为_____ 种,其最外层电子排布式为_____ ,硅微粒非常坚硬,比较晶体硅与碳化硅的熔点高低并解释说明_____ 。
(3)碳元素的非金属性比硫_____ ,可由一复分解反应推测而得,其反应的化学方程式为_____ 。
(4)烟气中的NO与尿素[CO(NH2)2](C的化合价为+4)反应进行脱硝。反应的化学方程式是:2CO(NH2)2+8NO=2CO2+6N2+O2+4H2O。该反应的氧化产物为_____ ,若反应过程中有2.24L(标准状况下)NO反应,则电子转移的数目为_____ 。
(1)补全元素周期表中符号。
| C | N | O | F | |
| Al | Si | S | Cl |
表中元素形成的最稳定氢化物是
(2)硅原子核外电子运动状态为
(3)碳元素的非金属性比硫
(4)烟气中的NO与尿素[CO(NH2)2](C的化合价为+4)反应进行脱硝。反应的化学方程式是:2CO(NH2)2+8NO=2CO2+6N2+O2+4H2O。该反应的氧化产物为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】钙和铜合金可用作电解制钙的阴极电极材料,回答下列问题:
(1)基态铜原子的价电子排布式为_______ 。
(2)CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成电石(CaC2),电石与水反应生成Ca(OH)2和一种4原子气体分子。
①写出电石与水反应的化学方程式_______ ;反应制得的气体中通常会含有硫化氢等杂质气体,可用_______ 吸收。
②CaCO3中阴离子的空间构型为_______ 。
③该气体分子中σ键与π键的数目之比为_______ 。
④写出2种与 互为等电子体的分子的化学式
互为等电子体的分子的化学式_______ 。
(3)工业上电解CaCl2制Ca而不采用电解CaO的原因是_______ 。
(4)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为_______ 、_______ 。

(1)基态铜原子的价电子排布式为
(2)CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成电石(CaC2),电石与水反应生成Ca(OH)2和一种4原子气体分子。
①写出电石与水反应的化学方程式
②CaCO3中阴离子的空间构型为
③该气体分子中σ键与π键的数目之比为
④写出2种与
 互为等电子体的分子的化学式
互为等电子体的分子的化学式(3)工业上电解CaCl2制Ca而不采用电解CaO的原因是
(4)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】氨基乙酸铜被广泛应用于染料、涂料、塑料和电池等领域,其化学式为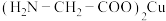 ,结构如图所示。
,结构如图所示。 原子的电子排布式为
原子的电子排布式为_______ , 位于元素周期表中
位于元素周期表中_______ 区元素(填“s、p、d、ds和f”其中一个)。
(2)氨基乙酸铜中碳原子的杂化方式有_______ 、_______ ,该分子中有_______ 个 键。
键。
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其价电子自旋磁量子数的代数和为
原子,其价电子自旋磁量子数的代数和为_______ 。
(4) 原子的第一电离能比
原子的第一电离能比 原子的
原子的_______ (填“大”或“小”),其原因是_______ 。
(5)氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中 的VSEPR模型名称为
的VSEPR模型名称为_______ ,氯乙酸的酸性大于乙酸的原因是_______ 。
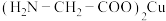 ,结构如图所示。
,结构如图所示。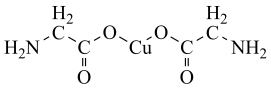
 原子的电子排布式为
原子的电子排布式为 位于元素周期表中
位于元素周期表中(2)氨基乙酸铜中碳原子的杂化方式有
 键。
键。(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其价电子自旋磁量子数的代数和为
原子,其价电子自旋磁量子数的代数和为(4)
 原子的第一电离能比
原子的第一电离能比 原子的
原子的(5)氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中
 的VSEPR模型名称为
的VSEPR模型名称为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】铁元素是最重要的金属元素之一,很多含铁化合物具有重要作用。
(1)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。
①与N同周期的主族元素中,第一电离能比N大的元素是_______ 。
②[Fe(SCN)(H2O)5]2+中该配离子中配位体是_______ ,Fe3+的配位数为_______ 。
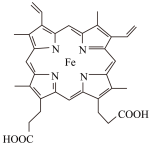
(2)血红素结构如图所示,在图中画出Fe2+与N原子间的化学键_______ (若是配位键,需要用箭头加以表示),血红素中C原子的杂化方式是_______ 。
(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:①r(Fe2+)为61pm,r(Co2+)为65pm。②隔绝空气加热:FeCO3 FeO+CO2↑,CoCO3
FeO+CO2↑,CoCO3 CoO+CO2↑分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是
CoO+CO2↑分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是_______ 。
(1)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。
①与N同周期的主族元素中,第一电离能比N大的元素是
②[Fe(SCN)(H2O)5]2+中该配离子中配位体是
(2)血红素结构如图所示,在图中画出Fe2+与N原子间的化学键

(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:①r(Fe2+)为61pm,r(Co2+)为65pm。②隔绝空气加热:FeCO3
 FeO+CO2↑,CoCO3
FeO+CO2↑,CoCO3 CoO+CO2↑分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是
CoO+CO2↑分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有_______ 种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为_______ ,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为_______ (填“发射”或“吸收”)光谱。
(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供_______ ,在BH3·NH3中B原子的杂化方式为_______ 。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
A. | B. |
C. | D. |
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为
(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】含碳元素的物质是化学世界中最庞大的家族。回答下列问题:
(1)CH4中的化学键从形成的过程来看属于_____ (填“σ”或“π”)键,从其极性来看属于_____ (填“极性”或“非极性”)键。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为_____ 。与CH4互为等电子体的阳离子是____ ;与CO2互为等电子体的阴离子是____ 。
(3)在①CH2=CH2、②HC≡CH、③HCHO三种物质中,其碳原子采取sp2杂化的分子有_____ (填序号)。
(4)碳有多种同素异形体,其中石墨烯的结构如图所示:

在石墨烯晶体中,每个六元环含有_____ 个C原 子,一种铁碳的化合物晶胞如图,该化合物的化学式为______ 。
(1)CH4中的化学键从形成的过程来看属于
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为
(3)在①CH2=CH2、②HC≡CH、③HCHO三种物质中,其碳原子采取sp2杂化的分子有
(4)碳有多种同素异形体,其中石墨烯的结构如图所示:


在石墨烯晶体中,每个六元环含有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】与NO 互为等电子体的分子
互为等电子体的分子__ ,根据等电子体原理,在NO 中氮原子轨道杂化类型是
中氮原子轨道杂化类型是__ ;O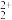 与N2互为等电子体,1molO
与N2互为等电子体,1molO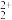 中含有的π键数目为
中含有的π键数目为__ 个。
 互为等电子体的分子
互为等电子体的分子 中氮原子轨道杂化类型是
中氮原子轨道杂化类型是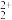 与N2互为等电子体,1molO
与N2互为等电子体,1molO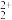 中含有的π键数目为
中含有的π键数目为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】在工业上,通过含锌矿石制取应用广泛的锌及其化合物。
(1)Zn在元素周期表中位于_____ 区,其基态原子价电子排布式为________ 。
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为_____ ,与CN-互为等电子体的粒子有_____ 、________ (写出两种)。
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为________ .中心原子杂化方式为________ ;HOCH2CN中元素电负性由大到小的顺序_______ ,1 mol HOCH2CN分子中,含有σ键的数为_________ 。
(4)ZnS和HgS晶体在岩浆中先晶出的是________ ,其原因是___________ 。
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为______ g/cm3(设晶胞参数为apm,NA表示阿伏伽德罗常数)
(1)Zn在元素周期表中位于
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为
(4)ZnS和HgS晶体在岩浆中先晶出的是
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为
您最近一年使用:0次



