某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是
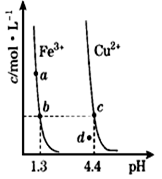

| A.Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕 |
| B.加适量浓NH3·H2O可使溶液由a 点变到b点 |
| C.c、d两点代表的溶液中c(H+) 与c(OH-)乘积不相等 |
| D.Fe(OH)3在d点代表的溶液过饱和 |
更新时间:2018-10-22 12:58:31
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】已知25°C时有关物质的颜色和溶度积(Ksp)如下表所示:
下列叙述中正确的是
| 物质 | AgCl | AgBr | AgI | Ag2S |
| 颜色 | 白 | 淡黄 | 黄 | 黑 |
| Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
| A.向AgCl悬浊液中加入0.1mol·L-lNa2S溶液,有黑色沉淀产生 |
| B.25°C时,AgBr、AgI饱和水溶液中c(Ag+)的大小关系为后者大于前者 |
| C.25°C,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积不相同 |
| D.在5mL1.8×10-6mol·L-1NaCl溶液中,加入1滴(20滴约为1mL)1×10-3mol·L-1AgNO3溶液,能产生白色沉淀 |
您最近半年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】已知:pBa=-lgc(Ba2+),Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=3.0×10-9。常温下,用 0.1 mol·L-1Na2SO4溶液滴定 20 mL 0.1 mol·L-1BaCl2溶液的曲线如图所示,V0达到滴定终点,下列说法错误的是
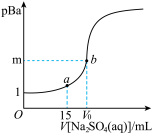

| A.图象中,m=5,V0=20 |
| B.若将c(BaCl2)从 0.1 mol· L-1变为 0.2 mol· L-1,m 值将减小 |
| C.a 点溶液中离子浓度大小关系为:c(Cl-)>c(Na+)>c(Ba2+)>c(OH-) |
D.向b点溶液中滴加Na2CO3溶液至 ≥30 时将生成BaCO3 ≥30 时将生成BaCO3 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++2NH3·H2O Ag(NH3)2++2H2O,平衡常数记为K[Ag(NH3)2+],下列分析
Ag(NH3)2++2H2O,平衡常数记为K[Ag(NH3)2+],下列分析不正确 的是( )
 Ag(NH3)2++2H2O,平衡常数记为K[Ag(NH3)2+],下列分析
Ag(NH3)2++2H2O,平衡常数记为K[Ag(NH3)2+],下列分析A.浊液中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.实验表明实验室可用氨水洗涤附着有银的试管 |
| C.由实验可以判断K[Ag(NH3)2+]>KSP(AgCl) |
| D.由资料信息可推知:加浓硝酸后生成的沉淀为AgCl |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】室温下,用含少量 的
的 溶液制备
溶液制备 的过程如题图所示。已知
的过程如题图所示。已知 ,
,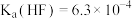 。下列说法正确的是
。下列说法正确的是
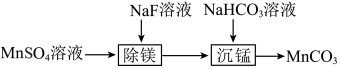
 的
的 溶液制备
溶液制备 的过程如题图所示。已知
的过程如题图所示。已知 ,
,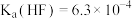 。下列说法正确的是
。下列说法正确的是
A.上述 溶液中: 溶液中: |
B.“除镁”得到的上层清液中: |
C. 的 的 溶液中: 溶液中: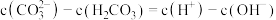 |
D.“沉锰”后的滤液中: |
您最近半年使用:0次

 和
和 的沉淀溶解平衡曲线如图所示,下列说法正确的是
的沉淀溶解平衡曲线如图所示,下列说法正确的是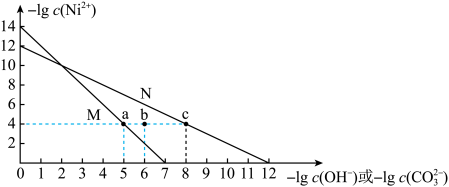

 和
和 均为0.001
均为0.001 的溶液中,滴加
的溶液中,滴加 溶液,先产生
溶液,先产生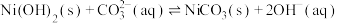 的平衡常数K为
的平衡常数K为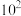
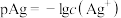 ,
,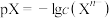 。
。 时,几种物质的
时,几种物质的 的值如下表:
的值如下表:





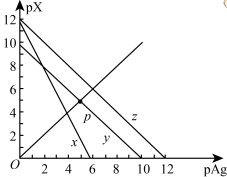
 和
和 的物质的量浓度均为
的物质的量浓度均为 的溶液中,滴入少量
的溶液中,滴入少量 溶液,首先产生的是红色沉淀
溶液,首先产生的是红色沉淀 的平衡常数
的平衡常数


