已知:pBa=-lgc(Ba2+),Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=3.0×10-9。常温下,用 0.1 mol·L-1Na2SO4溶液滴定 20 mL 0.1 mol·L-1BaCl2溶液的曲线如图所示,V0达到滴定终点,下列说法错误的是
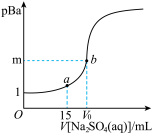

| A.图象中,m=5,V0=20 |
| B.若将c(BaCl2)从 0.1 mol· L-1变为 0.2 mol· L-1,m 值将减小 |
| C.a 点溶液中离子浓度大小关系为:c(Cl-)>c(Na+)>c(Ba2+)>c(OH-) |
D.向b点溶液中滴加Na2CO3溶液至 ≥30 时将生成BaCO3 ≥30 时将生成BaCO3 |
2020·四川泸州·三模 查看更多[3]
(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题(已下线)第26讲 难溶电解质的溶解平衡(精练)-2022年高考化学一轮复习讲练测四川省泸州市2020届高三第三次教学质量诊断性考试理综化学试题
更新时间:2020-05-24 13:05:10
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】下列说法中错误的是
A.含有Al3+的溶液中K+、Na+、HCO 、Cl- 不可能大量共存 、Cl- 不可能大量共存 |
B.室温下,向NH4HSO4溶液中加入NaOH至中性,则c(Na+)>c(SO )>c(NH )>c(NH ) ) |
C.向醋酸溶液中加入水,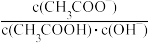 不变(稀释过程中温度变化忽略不计) 不变(稀释过程中温度变化忽略不计) |
D.25 ℃,a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合溶液中c(NH )=c(Cl-),则Kb(NH3·H2O)= )=c(Cl-),则Kb(NH3·H2O)= |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如下图,下列说法正确的是
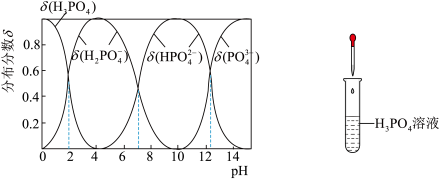

| A.滴加NaOH溶液至pH=7,溶液中c(Na+)>c(H2PO4-)+c(HPO42—)+c(PO43—) |
| B.该温度下,H3PO4的三级电离常数Ka3>10-12 |
| C.H3PO4的电离方程式为:H3PO4⇌ 3H+ + PO43— |
| D.滴加少量Na2CO3溶液,化学反应方程式为3 Na2CO3 + 2H3PO4=2Na2PO4+3H2O+3CO2↑ |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是


A.a点所得溶液中:2c(HSO )+c(SO )+c(SO )=0.1mol/L )=0.1mol/L |
B.b点所得溶液中:c(H+)+c(SO )=c(OH-)+c(H2SO3) )=c(OH-)+c(H2SO3) |
C.c点所得溶液中:c(Na+)>3c(HSO ) ) |
D.d点所得溶液中:c(Na+)>c(OH-)>c(SO ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
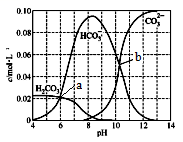

| A.b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-) |
| B.随pH增大,c(CO32-)/c(HCO3-)数值先减小后增大 |
| C.25℃时,碳酸的第一步电离常数Ka1=10-6 |
| D.溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】已知:常温下浓度均为0.1 mol/L的下列溶液的pH如下表:
下列有关说法正确的是
| 溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
| pH | 7.5 | 11.6 | 9.7 | 8.3 |
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF |
| B.等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N(NaClO)<N(NaF) |
| C.向0.1 mol/L Na2CO3溶液中通入CO2至中性,则溶液中:2c(CO32-) + c(HCO3-) = 0.1 mol/L |
| D.向Na2CO3溶液中通入少量的HF气体,发生反应的化学方程式为:Na2CO3 + 2HF = CO2 + H2O + 2NaF |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】常温下,向某浓度的二元弱酸H2A溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是


| A.pH由2增大到3的过程中,水的电离程度先减小后增大 |
| B.溶液中存在点d满足3[c(H2A)+c(HA-)+c(A2-)] = 2c(Na+),该点位于b、c之间 |
| C.pH=3时,溶液中c(HA-)= c(A2-) > c(H2A) |
| D.常温下,溶液中c(H2A)·c(A2-)与c2(HA-)的比值为104.5 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表。以下推断正确的是


| A.AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-=2BaSO4↓+Al(OH)3↓ |
| B.C点的沉淀为Fe(OH)3 |
| C.OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Fe3++Al3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ |
| D.据图计算原溶液中c(Cl-)>c(SO42-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
真题
名校
【推荐2】下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】下列说法正确的有几个
①pH=0的溶液中Fe3+与S2−因发生双水解而不共存
②MgCl2溶液蒸干后得Mg(OH)2固体,如果想要得到MgCl2固体应通入HCl的气流
③将0.1mol的Na2CO3溶于水中,形成溶液中阴离子总数小于0.1NA
④已知:AgCl(s)⇌Ag+(aq)+Cl−(aq),加少量水稀释平衡右移,c(Ag+)减小.
⑤ 和
和 在溶液中因为互相抑制水解而大量共存
在溶液中因为互相抑制水解而大量共存
⑥pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大
⑦NaHSO3溶液中加入少量NaOH固体, 将增大
将增大
①pH=0的溶液中Fe3+与S2−因发生双水解而不共存
②MgCl2溶液蒸干后得Mg(OH)2固体,如果想要得到MgCl2固体应通入HCl的气流
③将0.1mol的Na2CO3溶于水中,形成溶液中阴离子总数小于0.1NA
④已知:AgCl(s)⇌Ag+(aq)+Cl−(aq),加少量水稀释平衡右移,c(Ag+)减小.
⑤
 和
和 在溶液中因为互相抑制水解而大量共存
在溶液中因为互相抑制水解而大量共存⑥pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大
⑦NaHSO3溶液中加入少量NaOH固体,
 将增大
将增大| A.2个 | B.3个 | C.4个 | D.5个 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列关系中正确的是( )
| A.将AgCl、AgBr饱和溶液等体积混合后,滴加足量的硝酸银溶液,其主要沉淀物为AgBr |
| B.常温下,浓度为0.1mol•L﹣1的HA溶液(Ka=10﹣5)pH≈3 |
| C.c(SO32﹣)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3) |
| D.25℃时,向10mL0.01mol•L﹣1KOH溶液中滴加10mL0.01mol•L﹣1的醋酸溶液后,混合液中:c(K+)>c(CH3COO﹣)>c(OH﹣)=c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】化学实验是研究化学的重要方法,是化学探究的重要途径。根据实验目的,下列实验及现象。结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 比较 和 和 的水解常数的大小 的水解常数的大小 | 分别测浓度均为 的 的 和 和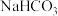 溶液的pH,后者大于前者 溶液的pH,后者大于前者 | 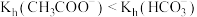 |
| B | 比较 和 和 的酸性强弱 的酸性强弱 | 量取一定浓度 溶液,滴加少量稀醋酸,无气泡产生 溶液,滴加少量稀醋酸,无气泡产生 | 酸性 |
| C | 探究氢离子浓度对 转化为 转化为 的影响 的影响 | 向 溶液中缓慢滴加硫酸,黄色变为橙红色 溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,平衡向生成 的方向移动 的方向移动 |
| D | 比较AgCl和AgI的溶度积常数 | 向NaCl、NaI的混合液中滴加2滴 溶液,振荡,沉淀呈黄色 溶液,振荡,沉淀呈黄色 | 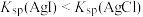 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,向10mL0.1mol·L-1 NaX溶液和10mL0.1mol·L-1Na2Y溶液分别滴加0.1mol·L-1AgNO3溶液。滴加过程中pM[pM= -lgc (X )或-lgc (Y2-)]与所加溶液体积之间的关系如图所示(提示:不考虑NaX和Na2Y水解,AgX和Ag2Y均为难溶物)。下列说法正确的是


| A.曲线I是向Na2Y溶液中滴加AgNO3溶液 |
| B.若将c(NaX)改为0.2mol·L-1 ,则m点可平移至n点 |
| C.m、p、w点所在溶液中c(Ag+):m>w>p |
D.Ag2Y(s) + 2X-(aq)  2AgX(s)+Y2-(aq)的平衡常数为107.6 2AgX(s)+Y2-(aq)的平衡常数为107.6 |
您最近一年使用:0次



