羰基硫(COS)是全球硫循环的重要中间体,也是有机合成中的重要原料,是化学工作者重要的研究对象。已知:
Ⅰ.COS(g)+H2(g)⇌H2S(g)+CO(g) △Hl=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)⇌H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)反应CO(g)+H2O(g)⇌H2(g)+CO2(g)的△H=________ 。
(2)在充有催化剂的恒压密闭容器中进行反应I。设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示。
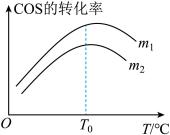 ①m1
①m1________ m2(填>、<或=)。
②温度高于T0时,COS转化率减小的可能原因为_________ 。
A.有副反应发生。
B.反应的△H增大。
C.催化剂活性降低。
D.逆反应速率增大的倍数小于正反应速率增大的倍数
(3)在恒温、恒容密闭容器中.进行反应I。下列说法中能说明反应I已达到平衡状态的是___________ 。
A.c(H2S)=c(CO) B.v正(H2)=v逆(H2S)
C.容器中气体密度保持不变 D.容器中混合气体平均摩尔质量保持不变
E.c(COS)保持不变
(4)某温度下,向体积为2 L的恒容密闭容器中通入5 mol COS(g)和5 molH2O(g),发生反应Ⅱ,5 min后反应达到平衡,测得COS(g)的转化率为80%。
①反应从起始至5 min内,用H2S浓度变化表示的平均反应速度v(H2S)=________ 。
②该温度下,上述反应的平衡常数K=________ 。
③其他条件相同时,既能使上述反应中COS的平衡转化率降低,又能使反应速率加快的做法是________ 。
A.缩小容器容积 B.升高温度
C.分离出硫化氢 D.加入一定量H2O(g)
Ⅰ.COS(g)+H2(g)⇌H2S(g)+CO(g) △Hl=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)⇌H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)反应CO(g)+H2O(g)⇌H2(g)+CO2(g)的△H=
(2)在充有催化剂的恒压密闭容器中进行反应I。设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示。
 ①m1
①m1②温度高于T0时,COS转化率减小的可能原因为
A.有副反应发生。
B.反应的△H增大。
C.催化剂活性降低。
D.逆反应速率增大的倍数小于正反应速率增大的倍数
(3)在恒温、恒容密闭容器中.进行反应I。下列说法中能说明反应I已达到平衡状态的是
A.c(H2S)=c(CO) B.v正(H2)=v逆(H2S)
C.容器中气体密度保持不变 D.容器中混合气体平均摩尔质量保持不变
E.c(COS)保持不变
(4)某温度下,向体积为2 L的恒容密闭容器中通入5 mol COS(g)和5 molH2O(g),发生反应Ⅱ,5 min后反应达到平衡,测得COS(g)的转化率为80%。
①反应从起始至5 min内,用H2S浓度变化表示的平均反应速度v(H2S)=
②该温度下,上述反应的平衡常数K=
③其他条件相同时,既能使上述反应中COS的平衡转化率降低,又能使反应速率加快的做法是
A.缩小容器容积 B.升高温度
C.分离出硫化氢 D.加入一定量H2O(g)
更新时间:2018-11-19 14:56:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) CO(g)+ 2H2 △H =+90kJ·mol-1
CO(g)+ 2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g) CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1
(1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为_______________ (填“A”或“B”),理由为_____________ 。T1℃时,体系的平衡压强与起始压强之比为_________________________ 。

(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i和反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______ (填“增大““减小”或“不变”),理由为____________ 。
②p1、p2、p3由大到小的顺序为___________________ 。
③测得C点时、体系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=________ 。
i.CH3OH(g)
 CO(g)+ 2H2 △H =+90kJ·mol-1
CO(g)+ 2H2 △H =+90kJ·mol-1 ii.CO(g)+H2O(g)
 CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1 (1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为

(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i和反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值
②p1、p2、p3由大到小的顺序为
③测得C点时、体系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】CO2催化加氢制甲醇是极具前景的资源化研究领域,主要反应有:
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.4 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.4 kJ·mol-1
ii.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
iii.CO(g)+2H2(g) CH3OH(g) ΔH3
CH3OH(g) ΔH3
(1)ΔH3=___________ kJ·mol-1。
(2)已知反应i的速率方程为v正=k正·x(CO2)·x3(H2),v逆=k逆·x(CH3OH)·x(H2O),k正、k逆均为速率常数且只与温度有关,x为物质的量分数。则反应i用物质的量分数表示的平衡常数Kx=__ (用k正、k逆表示)。
(3)5 MPa时,往某密闭容器中按投料比n(H2)∶n(CO2)=3∶1充入H2和CO2.反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图甲所示。

①图甲中Y代表__ (填化学式)。
②250 ℃时反应ii的Kx__ 1(填“>”“<”或“=”)。
③下列措施中,一定无法提高甲醇产率的是__ (填字母)。
A. 加入适量CO B. 使用催化剂
C. 循环利用原料气 D. 升高温度
(4)在10 MPa下将H2、CO按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图乙所示。曲线b代表的物质为___________ (填化学式)。温度为700 K时,该反应的平衡常数Kp=___________ (结果用分数表示)。

i.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.4 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.4 kJ·mol-1ii.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1iii.CO(g)+2H2(g)
 CH3OH(g) ΔH3
CH3OH(g) ΔH3(1)ΔH3=
(2)已知反应i的速率方程为v正=k正·x(CO2)·x3(H2),v逆=k逆·x(CH3OH)·x(H2O),k正、k逆均为速率常数且只与温度有关,x为物质的量分数。则反应i用物质的量分数表示的平衡常数Kx=
(3)5 MPa时,往某密闭容器中按投料比n(H2)∶n(CO2)=3∶1充入H2和CO2.反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图甲所示。

①图甲中Y代表
②250 ℃时反应ii的Kx
③下列措施中,一定无法提高甲醇产率的是
A. 加入适量CO B. 使用催化剂
C. 循环利用原料气 D. 升高温度
(4)在10 MPa下将H2、CO按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图乙所示。曲线b代表的物质为

您最近一年使用:0次
【推荐3】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一、合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体 CO2的研究一直是科技界关注的重点。在催化剂存在下用 H2还原 CO2是解决温室效应的重要手段之一、
已知:①H2和 CH4的燃烧热分别为 285.5 kJ/mol 和 890.0 kJ/mol。
②H2O(1)=H2O(g) ΔH=+44 kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式___________ 。
(2)汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
已知 4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1
①对于有气体参加的反应,表示平衡常数时,用气体组分(B)的平衡分压p(B)代替该气体的平衡浓度C(B),求得的平衡常数叫做压强平衡常数Kp。则上述反应的Kp=___________ [写出表达式]。
②该反应在___________ (填“高温、低温或任何温度”)下能自发进行。
③某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为___________ ;两种方式达平衡时,N2的体积分数:甲___________ 乙( 填“>、=、<或不确定”,下同),NO2的浓度:甲___________ 乙。
(3)汽车尾气是雾霾形成的原因之一,研究氮氧化物的处理方法可有效减少雾霾的形成。可采用氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g)  4N2(g)+6H2O(g)ΔH<0
4N2(g)+6H2O(g)ΔH<0
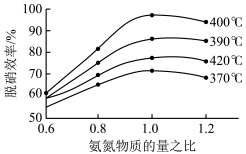
根据图示判断提高脱硝效率的最佳条件是___________ ;氨氮比一定时,在400℃时,脱硝效率最大,其可能的原因是___________ 。
(1)对温室气体 CO2的研究一直是科技界关注的重点。在催化剂存在下用 H2还原 CO2是解决温室效应的重要手段之一、
已知:①H2和 CH4的燃烧热分别为 285.5 kJ/mol 和 890.0 kJ/mol。
②H2O(1)=H2O(g) ΔH=+44 kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式
(2)汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
已知 4CO(g)+2NO2(g)
 4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1①对于有气体参加的反应,表示平衡常数时,用气体组分(B)的平衡分压p(B)代替该气体的平衡浓度C(B),求得的平衡常数叫做压强平衡常数Kp。则上述反应的Kp=
②该反应在
③某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为
| 甲 | 乙 |
| 0.2 molNO2 | 0.1mol NO2 |
| 0.4 molCO | 0.2 molCO |
 4N2(g)+6H2O(g)ΔH<0
4N2(g)+6H2O(g)ΔH<0
根据图示判断提高脱硝效率的最佳条件是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某化学课外小组通过实验探究化学反应速率和化学反应限度。
(1)实验一:探究温度和浓度对反应速率的影响
方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘(2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O),生成的碘可用淀粉溶液检验,根据出现蓝色所需的 时间来衡量该反应的速率。
则V1=_____ mL,V2=_____ mL.
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。
实验步骤:
ⅰ.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
①写出KI和FeCl3反应的离子方程式:_______________________________ 。
②步骤ⅲ中,试剂X是_____ 。
③步骤ⅱ和ⅲ中的实验现象说明KI和FeCl3混合时生成KCI、I2和FeCl2的反应存在一定的限度,该实验现象是:
ⅱ中____________________________________________ 。
ⅲ中_________________________________________________ 。
(1)实验一:探究温度和浓度对反应速率的影响
方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘(2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O),生成的碘可用淀粉溶液检验,根据出现蓝色所需的 时间来衡量该反应的速率。
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
则V1=
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。
实验步骤:
ⅰ.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
①写出KI和FeCl3反应的离子方程式:
②步骤ⅲ中,试剂X是
③步骤ⅱ和ⅲ中的实验现象说明KI和FeCl3混合时生成KCI、I2和FeCl2的反应存在一定的限度,该实验现象是:
ⅱ中
ⅲ中
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】六氟锑酸钠( NaSbF6)可作为新型钠离子电池的离子导体。一种由锑白(主要含Sb2O3、Sb2S3和少量Sb2O5、Fe2O3、CuS等)合成六氟锑酸钠的工艺流程如图所示:

①Sb的氧化物及氢氧化物的性质与Al的类似,Sb2S3可溶于NaOH溶液;
②NaSbO3·3H2O晶体难溶于水。
请回答下列问题:
(1)“碱浸渣”的主要成分是___________ (填化学式)。
(2)“碱浸、还原”时,Sb2O3发生的离子方程式为___________ ; 若Na2S2O3与Sb2O5反应时的氧化产物为Na2SO4,则Na2S2O3与Sb2O5计量关系比为___________ 。
(3)“转化”时控温约50℃的原因是___________ 。
(4)“氟化”反应的化学方程式为___________ ,此过程不选用玻璃仪器的原因是___________ 。
(5)以六氟锑酸钠为离子导体的新型钠离子可充电电池的结构如图所示,该电池放电时的工作原理为Na +CnSbF6=NaSbF6+nC,则放电时,石墨电极上的电极反应式为___________ 。


①Sb的氧化物及氢氧化物的性质与Al的类似,Sb2S3可溶于NaOH溶液;
②NaSbO3·3H2O晶体难溶于水。
请回答下列问题:
(1)“碱浸渣”的主要成分是
(2)“碱浸、还原”时,Sb2O3发生的离子方程式为
(3)“转化”时控温约50℃的原因是
(4)“氟化”反应的化学方程式为
(5)以六氟锑酸钠为离子导体的新型钠离子可充电电池的结构如图所示,该电池放电时的工作原理为Na +CnSbF6=NaSbF6+nC,则放电时,石墨电极上的电极反应式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】高铁酸钾(K2FeO4)是一种安全性很高的水处理剂,其合成的部分流程如下。

资料:
ⅰ.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速产生O2,且﹢3价铁能催化该反应。
ⅱ.次氯酸钾容易分解,2KClO 2KCl+O2。
2KCl+O2。
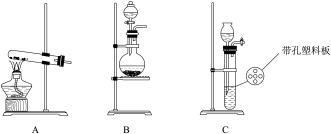
(1)实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的_______ 。
(2)写出步骤①的离子反应方程式_________________________________ 。
(3)加入KOH固体是为了过滤除盐,过滤除去的是__________________________________ 。
(4)相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示:
请分析高铁酸钾产率随温度变化的原因:________________ 。

(5)相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示:
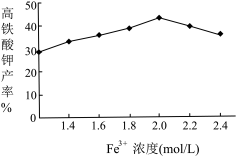
当Fe3+浓度大于2.0mol/L时,高铁酸钾产率变化的原因可能是:_________________________________________ 。
(6)高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1gMn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为______ mol。

资料:
ⅰ.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速产生O2,且﹢3价铁能催化该反应。
ⅱ.次氯酸钾容易分解,2KClO
 2KCl+O2。
2KCl+O2。(1)实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的

(2)写出步骤①的离子反应方程式
(3)加入KOH固体是为了过滤除盐,过滤除去的是
(4)相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示:
请分析高铁酸钾产率随温度变化的原因:

(5)相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示:

当Fe3+浓度大于2.0mol/L时,高铁酸钾产率变化的原因可能是:
(6)高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1gMn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为
您最近一年使用:0次
【推荐1】研究化学反应的快慢和限度,能更好的服务于人类。500℃时,向2L的恒容密闭容器中,充入2molCO2和6molH2,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),n(CO2)随时间的变化如下表。
回答下列问题:
(1)该温度下,反应达到平衡时,c(H2)=_______ 。
(2)下图中表示CH3OH变化的曲线是_______ 。

(3)下列能说明该反应达到平衡状态的是_______。
(4)下列措施能使化学反应速率减小的是_______。
(5)其他条件不变,4min时向该密闭容器中再充入1molCO2和1molH2O,则化学反应速率_______ (填“变大”“变小”或“不变”),化学平衡_______ (填“正向移动”“逆向移动”或“不移动”)。
已知:化学反应aA(g)+bB(g)⇌cC(g)+dD(g),一定温度下,可逆反应达到平衡状态时,K=-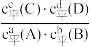 (K为平衡常数,c平代表平衡浓度);任意状态时,Qc=
(K为平衡常数,c平代表平衡浓度);任意状态时,Qc=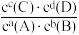 (Qc为浓度商,c代表任意时刻浓度)。若Qc<K,反应向正反应方向进行;若Qc=K,反应处于平衡状态;若Qc>K,反应向逆反应方向进行。
(Qc为浓度商,c代表任意时刻浓度)。若Qc<K,反应向正反应方向进行;若Qc=K,反应处于平衡状态;若Qc>K,反应向逆反应方向进行。
| 时间(min) | 0 | 1 | 2 | 3 | 4 |
| n(CO2)(mol) | 2 | 1.5 | 1.2 | 1.0 | 1.0 |
(1)该温度下,反应达到平衡时,c(H2)=
(2)下图中表示CH3OH变化的曲线是

(3)下列能说明该反应达到平衡状态的是_______。
| A.3v(H2)正=v(CH3OH)逆 | B.混合气体的密度不再改变 |
| C.容器内压强保持不变 | D.消耗1molCO2的同时生成3molH2 |
| A.适当升高温度 | B.保持温度不变,增大容器体积 |
| C.保持容器体积不变,通入氢气 | D.保持容器体积不变,充入氦气 |
已知:化学反应aA(g)+bB(g)⇌cC(g)+dD(g),一定温度下,可逆反应达到平衡状态时,K=-
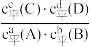 (K为平衡常数,c平代表平衡浓度);任意状态时,Qc=
(K为平衡常数,c平代表平衡浓度);任意状态时,Qc=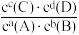 (Qc为浓度商,c代表任意时刻浓度)。若Qc<K,反应向正反应方向进行;若Qc=K,反应处于平衡状态;若Qc>K,反应向逆反应方向进行。
(Qc为浓度商,c代表任意时刻浓度)。若Qc<K,反应向正反应方向进行;若Qc=K,反应处于平衡状态;若Qc>K,反应向逆反应方向进行。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】工业合成氨反应:N2+3H2⇌2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂.
(1)已知1molN2完全反应生成NH3可放出92kJ热量.如果将1molN2和3molH2混合,使其充分反应,放出的热量总小于上述数值,其原因是_____ .
(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成10molNH3,则用N2表示的化学反应速率为_____ .
(3)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是_____ .
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.该条件下,N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.恒容时体系密度保持不变
(4)在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果,判断该反应的速率由大到小的顺序是_____ (用编号填写).
A.v(NH3)=0.45mol•L-1•min-1 B.v(H2)=0.5mol•L-1•min-1
C.v(N2)=0.25mol•L-1•min-1 D.v(H2)=0.01mol•L-1•s-1
(5)如图所示是实验室制取氨气的装置和选用的试剂,其中正确的是_____ .
A、 B、
B、 C、
C、 D、
D、
(1)已知1molN2完全反应生成NH3可放出92kJ热量.如果将1molN2和3molH2混合,使其充分反应,放出的热量总小于上述数值,其原因是
(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成10molNH3,则用N2表示的化学反应速率为
(3)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.该条件下,N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.恒容时体系密度保持不变
(4)在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果,判断该反应的速率由大到小的顺序是
A.v(NH3)=0.45mol•L-1•min-1 B.v(H2)=0.5mol•L-1•min-1
C.v(N2)=0.25mol•L-1•min-1 D.v(H2)=0.01mol•L-1•s-1
(5)如图所示是实验室制取氨气的装置和选用的试剂,其中正确的是
A、
 B、
B、 C、
C、 D、
D、
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C (s)+H2O (g) ⇌ CO(g)+H2(g) ΔH = +131.4 kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为________ 。
(2)关于上述反应在化学平衡状态时的描述正确的是____ 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如右图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);_____
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。______
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:______ 。
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为______ 。当甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为__ g。

(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为
(2)关于上述反应在化学平衡状态时的描述正确的是
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如右图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=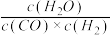 ,它所对应的化学反应为:
,它所对应的化学反应为:__________________ 。
(2)已知在一定温度下,
①C(s)+CO2(g) 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g) CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。
则K1、K2、K3之间的关系是________ ,ΔH3=__________________ (用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
该反应的正反应方向是______ 反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________ 。
(4)高炉炼铁产生的废气中的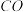 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和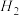 反应制备甲醇:
反应制备甲醇: 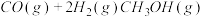 。请回答下列问题;
。请回答下列问题;
①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
则下列关系正确的是__________ 。
a. b.
b.  c.
c. 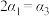 d.
d. 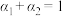
e.该反应若生成1
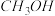 ,则放出(
,则放出(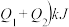 热量
热量
②若在一体积可变的密闭容器中充入1
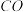 、2
、2
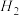 和1
和1
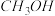 ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________ (填“正”或“逆”)反应方向移动。
(1)已知某温度下某反应的化学平衡常数表达式为:K=
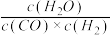 ,它所对应的化学反应为:
,它所对应的化学反应为:(2)已知在一定温度下,
①C(s)+CO2(g)
 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;②CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;③C(s)+H2O(g)
 CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。则K1、K2、K3之间的关系是
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)高炉炼铁产生的废气中的
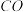 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和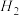 反应制备甲醇:
反应制备甲醇: 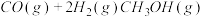 。请回答下列问题;
。请回答下列问题;①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 | 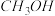 的浓度 的浓度 | 能量变化(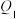 、 、 、 、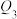 均大于0) 均大于0) |
| 甲 | 1 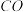 和2 和2 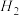 | 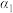 | 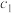 | 放出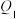 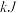 热量 热量 |
| 乙 | 1 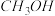 | 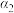 | 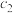 | 放出 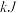 热量 热量 |
| 丙 | 2 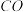 和4 和4 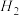 | 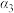 | 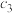 | 放出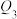 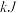 热量 热量 |
a.
 b.
b.  c.
c. 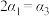 d.
d. 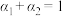
e.该反应若生成1

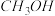 ,则放出(
,则放出(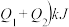 热量
热量②若在一体积可变的密闭容器中充入1

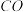 、2
、2
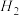 和1
和1
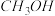 ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。以 和
和 为原料合成尿素
为原料合成尿素
 。研究发现,合成尿素反应分两步完成。
。研究发现,合成尿素反应分两步完成。
第1步: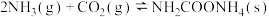

第2步:……
(1)第1步反应的平衡常数表达式为___________ 。
(2)第2步反应的热化学反应方程式为___________ 。
(3)一定条件下的恒容容器中,充入1.5mol 和1mol
和1mol  ,平衡时
,平衡时 的转化率为50%,则平衡时
的转化率为50%,则平衡时
___________ ,已知第2步反应的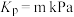 ,测得平衡时容器内总压为3m kPa,则反应
,测得平衡时容器内总压为3m kPa,则反应 的平衡常数
的平衡常数
___________ 。
(4)若要提高 平衡转化率,可采取的措施有
平衡转化率,可采取的措施有___________ (任写一条)。
 和
和 为原料合成尿素
为原料合成尿素
 。研究发现,合成尿素反应分两步完成。
。研究发现,合成尿素反应分两步完成。第1步:
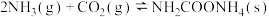

第2步:……
(1)第1步反应的平衡常数表达式为
(2)第2步反应的热化学反应方程式为
(3)一定条件下的恒容容器中,充入1.5mol
 和1mol
和1mol  ,平衡时
,平衡时 的转化率为50%,则平衡时
的转化率为50%,则平衡时
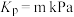 ,测得平衡时容器内总压为3m kPa,则反应
,测得平衡时容器内总压为3m kPa,则反应 的平衡常数
的平衡常数
(4)若要提高
 平衡转化率,可采取的措施有
平衡转化率,可采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】杭州亚运会主火炬燃料是“零碳甲醇”,是一种利用焦炉气中的H2和工业废气捕获的CO2生产的绿色燃料,在适宜的过渡金属及其氧化物催化下发生反应:
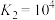
(1)已知:Ⅰ.

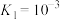
Ⅱ.

Ⅲ.


则
_________  ,
,
_________ (计算其数值)。
(2)甲醇气相脱水制甲醚(CH3OCH3)的反应可表示为: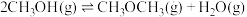
 。
。
①一定温度下,在恒容密闭容器中充入一定量的 发生上述反应,能判断反应达到化学平衡状态的是
发生上述反应,能判断反应达到化学平衡状态的是________
A.CH3OH(g)和CH3OCH3(g)的浓度比保持不变
B.
C.容器内压强不再变化
D.混合气体的平均相对分子质量不再变化
②200℃时向2 L恒容密闭容器中充入2 mol CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如下表:
达平衡时该反应放出的热量为________ kJ,若此时平衡压强为P0,则该温度条件下,压强平衡常数Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③200℃时,向该容器中投入三种成分的浓度如下:
此时,正、逆反应速率的大小关系为:
________ 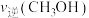 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
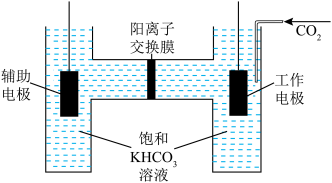
(3)我国科研团队在CO2电化学还原反应机理的研究上取得新突破,CO2电化学还原法中采用TiO2纳米管作电解池工作电极,惰性电极作辅助电极,以一定流速通入CO2,测得CO2生成CO的产率接近80%。
①工作电极上主要发生的电极反应为_____________ ;
②电解一段时间,交换膜左侧溶液的浓度_________ (填“增大”、“减小”或“不变”)。
(1)已知:Ⅰ.


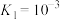
Ⅱ.



Ⅲ.



则

 ,
,
(2)甲醇气相脱水制甲醚(CH3OCH3)的反应可表示为:
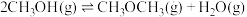
 。
。①一定温度下,在恒容密闭容器中充入一定量的
 发生上述反应,能判断反应达到化学平衡状态的是
发生上述反应,能判断反应达到化学平衡状态的是A.CH3OH(g)和CH3OCH3(g)的浓度比保持不变
B.

C.容器内压强不再变化
D.混合气体的平均相对分子质量不再变化
②200℃时向2 L恒容密闭容器中充入2 mol CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
③200℃时,向该容器中投入三种成分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
c/(mol·L-1) | 0.64 | 0.68 | 0.68 |

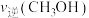 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)我国科研团队在CO2电化学还原反应机理的研究上取得新突破,CO2电化学还原法中采用TiO2纳米管作电解池工作电极,惰性电极作辅助电极,以一定流速通入CO2,测得CO2生成CO的产率接近80%。
①工作电极上主要发生的电极反应为
②电解一段时间,交换膜左侧溶液的浓度
您最近一年使用:0次



