化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
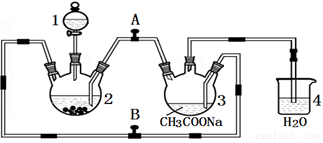
请回答下列问题:
(1)仪器1的名称是__________ ;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是__________ (填序号);目的是______________________________ 。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门__________ (填“A”或“B”,下同),打开阀门___________________ 。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是__________________________ 。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.024g,则该实验所得产品的产率为__________ (不考虑溶解的M)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的________ ,再加入碱液,调节pH至少为________ 才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31, =4,lg2≈0.3】
=4,lg2≈0.3】
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)

请回答下列问题:
(1)仪器1的名称是
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.024g,则该实验所得产品的产率为
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的
 =4,lg2≈0.3】
=4,lg2≈0.3】
更新时间:2018-12-06 16:04:41
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】从烟气脱硝催化剂(SCR)中回收金属元素可实现资源的循环利用。一种从废弃SCR(主要含TiO2、V2O5、WO3及SiO2、Al2O3)中回收金属钒和钨的工艺流程如下:
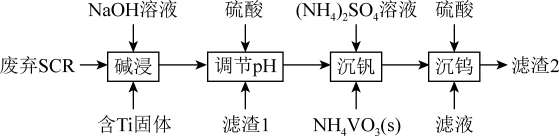
已知:
①Al元素及Si元素在水溶液中的主要存在形式与pH的关系为:
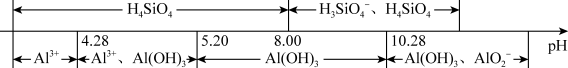
②V2O5为两性氧化物:在水溶液中存在:VO +2H+⇌VO
+2H+⇌VO +H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:
+H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:
回答下列问题:
(1)“碱浸”时,滤液中的金属含氧酸根离子除WO 外还有
外还有_______ 。
(2)“调节pH”时,所调pH的范围是_______ 。
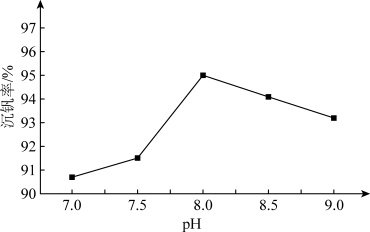
(3)“沉钒”过程中:
①沉钒率随溶液pH的变化如下图所示。沉钒率随溶液pH值的增加先升高后降低的原因可能是___ 。
②已知25℃时,Kb(NH3·H2O)=1.8×10-5,Ksp(NH4VO3)=3.0×10-8。若25℃时控制“沉钒”的pH为8.0,当VO 恰好完全沉淀时,溶液中的c(NH3·H2O)=
恰好完全沉淀时,溶液中的c(NH3·H2O)=_______ mol·L-1。
(4)常温下,钨酸(H2WO4)是一种难溶于水的弱酸。“沉钨”过程中发生反应的离子方程式为_______ ;“沉钨”后需对滤渣2进行洗涤、干燥,判断滤渣2已洗涤干净的方法为_______ 。
(5)V2O5具有强氧化性,可与浓盐酸发生反应生成气体单质,该反应中氧化剂与还原剂的物质的量之比为1:2,则反应的化学方程式为_______ 。

已知:
①Al元素及Si元素在水溶液中的主要存在形式与pH的关系为:

②V2O5为两性氧化物:在水溶液中存在:VO
 +2H+⇌VO
+2H+⇌VO +H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:
+H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:| 价态 | +5 | +4 | +3 | +2 |
| 存在形式 | VO /VO /VO | VO2+ | V3+ | V2+ |
回答下列问题:
(1)“碱浸”时,滤液中的金属含氧酸根离子除WO
 外还有
外还有(2)“调节pH”时,所调pH的范围是
(3)“沉钒”过程中:
①沉钒率随溶液pH的变化如下图所示。沉钒率随溶液pH值的增加先升高后降低的原因可能是

②已知25℃时,Kb(NH3·H2O)=1.8×10-5,Ksp(NH4VO3)=3.0×10-8。若25℃时控制“沉钒”的pH为8.0,当VO
 恰好完全沉淀时,溶液中的c(NH3·H2O)=
恰好完全沉淀时,溶液中的c(NH3·H2O)=(4)常温下,钨酸(H2WO4)是一种难溶于水的弱酸。“沉钨”过程中发生反应的离子方程式为
(5)V2O5具有强氧化性,可与浓盐酸发生反应生成气体单质,该反应中氧化剂与还原剂的物质的量之比为1:2,则反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】钴及其化合物广泛应用于航天、电池、磁性合金等高科技领域,我国钴资源贫乏,再生钴资源的回收利用是解决钴资源供给的重要途径。一种利用含钴废料(主要成分为 ,含少量
,含少量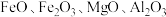 、有机物)制取
、有机物)制取 的工艺流程如图:
的工艺流程如图: ,回答下列问题:
,回答下列问题:
(1)“焙烧”的主要目的是_______ 。
(2)“浸取”过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)“沉淀”时先加入 溶液,
溶液, 的作用主要是
的作用主要是_______ ;再加入 溶液调节
溶液调节 为5.0,此时滤液中的
为5.0,此时滤液中的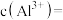
_______  。
。
(4)“萃取”用到的玻璃仪器主要有_______ 、烧杯,萃取原理可表述为: (水层)
(水层) (有机层)
(有机层)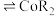 (有机层)
(有机层) (水层)。已知
(水层)。已知 萃取率随
萃取率随 变化如图所示,分析其变化原因
变化如图所示,分析其变化原因_______ 。水相中含有的阳离子有_______ 。 ,反应的离子方程式为
,反应的离子方程式为_______ 。
 ,含少量
,含少量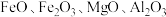 、有机物)制取
、有机物)制取 的工艺流程如图:
的工艺流程如图: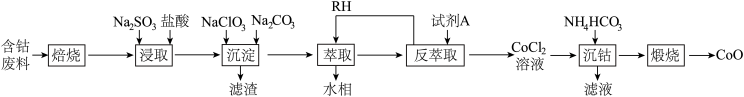
 ,回答下列问题:
,回答下列问题:| 金属离子 |  |  |  |  |  |
开始沉淀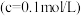 的 的 | 7.5 | 1.8 | 3.4 | 9.1 | 6.5 |
沉淀完全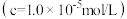 的 的 | 9.5 | 3.2 | 4.7 | 11.1 | 8.5 |
(1)“焙烧”的主要目的是
(2)“浸取”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(3)“沉淀”时先加入
 溶液,
溶液, 的作用主要是
的作用主要是 溶液调节
溶液调节 为5.0,此时滤液中的
为5.0,此时滤液中的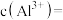
 。
。(4)“萃取”用到的玻璃仪器主要有
 (水层)
(水层) (有机层)
(有机层)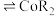 (有机层)
(有机层) (水层)。已知
(水层)。已知 萃取率随
萃取率随 变化如图所示,分析其变化原因
变化如图所示,分析其变化原因
 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
【推荐3】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图所示.

(1)步骤Ⅱ所得滤渣中的物质是(写化学式)_____________ 。
(2)步骤II中的氧化还原反应的离子方程式为___________________________________ 。
(3)步骤Ⅳ还可以回收Na2SO4来制取Na2S。Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为__________________________ 。
(4)已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图:

从滤液中得到Na2SO4的操作方法是_________________________________ 。
(5)在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 mol•L-1 Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.010 -4 mol•L-1时,Mn2+开始沉淀,则a=____________ 。[已知:H2S 的电离常数Ka1=1.310 -7,Ka2=7.010 -15;Ksp(MnS)=1.410 -15]

(1)步骤Ⅱ所得滤渣中的物质是(写化学式)
(2)步骤II中的氧化还原反应的离子方程式为
(3)步骤Ⅳ还可以回收Na2SO4来制取Na2S。Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为
(4)已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图:

从滤液中得到Na2SO4的操作方法是
(5)在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 mol•L-1 Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.010 -4 mol•L-1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以软锰矿(主要成分为MnO2,还含少量Fe、Si、Al、Ca、Mg的氧化物)和硫铁矿(主要成分为FeS2)为原料,制取电池级Mn3O4的流程如图:

回答下列问题:
(1)“浸取”时反应机理如图。MnO2氧化Fe2+的离子方程式为___________ 。随硫铁矿量增加,锰浸取速率减慢,此时加入一定量H2O2溶液,浸取速率又会加快,原因是___________ 。

(2)浸取液中的Fe3+可以利用有机试剂萃取分离,Fe3+的萃取率与溶液pH之间的关系如图所示。pH>1.7时,Fe3+的萃取率急剧下降的原因为___________ 。

(3)已知Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9,加入NH4F溶液除钙、镁时,当Ca2+恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,c(Mg2+)=___________ mol·L-1。
(4)加入氨水生成的沉淀是Mn(OH)2和Mn2(OH)2SO4,该过程中Mn2+的沉降率与溶液pH之间的关系如表所示:
根据表格数据分析,应调节最佳pH为___________ ;氨水过量时,Mn2+沉降率降低的可能原因是___________ 。
(5)将“沉淀”步骤所得含少量Mn2(OH)2SO4的Mn(OH)2固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。实验测得浆液pH随时间变化如图所示。

浆液pH先基本不变,表明___________ [填“Mn2(OH)2SO4”或“Mn(OH)2”]先被氧化,7h后pH迅速下降的原因是___________ 。

回答下列问题:
(1)“浸取”时反应机理如图。MnO2氧化Fe2+的离子方程式为

(2)浸取液中的Fe3+可以利用有机试剂萃取分离,Fe3+的萃取率与溶液pH之间的关系如图所示。pH>1.7时,Fe3+的萃取率急剧下降的原因为

(3)已知Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9,加入NH4F溶液除钙、镁时,当Ca2+恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,c(Mg2+)=
(4)加入氨水生成的沉淀是Mn(OH)2和Mn2(OH)2SO4,该过程中Mn2+的沉降率与溶液pH之间的关系如表所示:
| pH | 氨水体积/mL | 残余率/% | 沉降率/% |
| 8.5 | 2.7 | 71.1 | 28.9 |
| 9.0 | 4.5 | 45.2 | 54.8 |
| 9.5 | 7.6 | 20.5 | 79.5 |
| 10.0 | 10.5 | 16.3 | 83.7 |
| 10.5 | 16.1 | 18.4 | 81.6 |
(5)将“沉淀”步骤所得含少量Mn2(OH)2SO4的Mn(OH)2固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。实验测得浆液pH随时间变化如图所示。

浆液pH先基本不变,表明
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】碱式氯化铜为绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。

(1)仪器X的名称是_______ ,在本实验中其主要作用有导气、_______ 。
(2)实验室利用装置A制NH3,发生反应的化学方程式为_______
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象是_______
a.有墨绿色固体产生 b.液面下导管口有气泡冒出 c.溶液蓝色加深
(4)反应结束后,将三颈瓶中的混合物过滤,经提纯得产品无水碱式氯化铜,从滤液中还可以获得的副产品是_______ (填化学式)。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29克,加硝酸溶解,并加水定容至200mL,得到待测液。
(5)铜的测定:取20.00mL待测液,经测定,Cu2+浓度为0.20mol·L-1,Cl-浓度为0.10mol·L-1。则所称取的产品中Cl-的物质的量为_______ mol。
(6)根据上述实验结果可推知无水碱式氯化铜的化学式为_______ 。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。

(1)仪器X的名称是
(2)实验室利用装置A制NH3,发生反应的化学方程式为
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象是
a.有墨绿色固体产生 b.液面下导管口有气泡冒出 c.溶液蓝色加深
(4)反应结束后,将三颈瓶中的混合物过滤,经提纯得产品无水碱式氯化铜,从滤液中还可以获得的副产品是
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29克,加硝酸溶解,并加水定容至200mL,得到待测液。
(5)铜的测定:取20.00mL待测液,经测定,Cu2+浓度为0.20mol·L-1,Cl-浓度为0.10mol·L-1。则所称取的产品中Cl-的物质的量为
(6)根据上述实验结果可推知无水碱式氯化铜的化学式为
您最近一年使用:0次
【推荐3】 铝土矿
铝土矿 主要成分为
主要成分为 ,还含有
,还含有 、
、 是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:

①沉淀A成分是______ ;步骤 中的试剂a是
中的试剂a是______ ; 以上均填化学式
以上均填化学式 ;
;
②简述检验所得滤液甲中存在 的操作方法:
的操作方法:______ ;
 用含少量铁的氧化铜制取氯化铜晶体
用含少量铁的氧化铜制取氯化铜晶体 。有如下操作:
。有如下操作:

已知:在pH 为 时,
时, 几乎完全转化为
几乎完全转化为 沉淀,
沉淀, 却不反应。
却不反应。
①氧化剂A可选用______  填编号,下同
填编号,下同 ;
;
A.


 浓盐酸
浓盐酸
②试剂B可选用______ ;
A.NaOH


③试剂B 的作用是______ ;
A.使 完全沉淀
完全沉淀  使
使 完全沉淀
完全沉淀  提高溶液的pH
提高溶液的pH  除去过量的氧化剂
除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是______ 。
 铝土矿
铝土矿 主要成分为
主要成分为 ,还含有
,还含有 、
、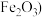 是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
①沉淀A成分是
 中的试剂a是
中的试剂a是 以上均填化学式
以上均填化学式 ;
;②简述检验所得滤液甲中存在
 的操作方法:
的操作方法: 用含少量铁的氧化铜制取氯化铜晶体
用含少量铁的氧化铜制取氯化铜晶体 。有如下操作:
。有如下操作:
已知:在pH 为
 时,
时, 几乎完全转化为
几乎完全转化为 沉淀,
沉淀, 却不反应。
却不反应。①氧化剂A可选用
 填编号,下同
填编号,下同 ;
;A.



 浓盐酸
浓盐酸②试剂B可选用
A.NaOH



③试剂B 的作用是
A.使
 完全沉淀
完全沉淀  使
使 完全沉淀
完全沉淀  提高溶液的pH
提高溶液的pH  除去过量的氧化剂
除去过量的氧化剂④从滤液经过结晶得到氯化铜晶体的方法是
您最近一年使用:0次



