一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示,回答下列问题:
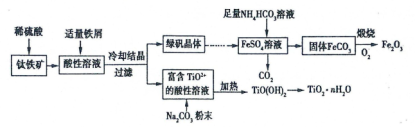
(1)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有______ 任写两种)。
(2)FeSO4溶液与 NH4HCO3溶液反应的离子方程式是________ 。
(3)TiO2+水解为TiO(OH)2沉淀的离子方程式为__________ ,需要加入Na2CO3粉末的目的是__________________________________________ 。
(4)常温下,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-) = 3.0×10-6 mol/L,需要控制溶液pH____________ 时,才能使所得的FeCO3中不含Fe(OH)2。(已知:Ksp[FeCO3] = 3.0×10-11,Ksp[Fe(OH)2] = 1.0×10-16)

(1)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有
(2)FeSO4溶液与 NH4HCO3溶液反应的离子方程式是
(3)TiO2+水解为TiO(OH)2沉淀的离子方程式为
(4)常温下,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-) = 3.0×10-6 mol/L,需要控制溶液pH
更新时间:2018-12-13 23:14:32
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】某厂利用富锗ZnO烟尘(还含有CuO、CaO、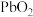 、
、 、
、 等)生产储精矿和碱式碳酸锌
等)生产储精矿和碱式碳酸锌 。其流程如下:
。其流程如下:
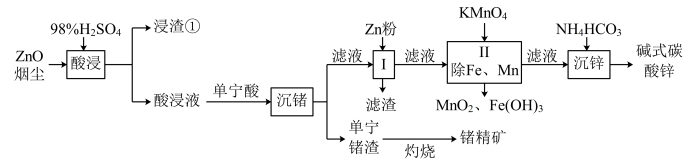
已知:I.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
II.25℃: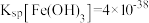 、
、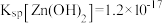 。
。
请回答下列问题:
(1)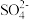 的空间结构
的空间结构_______ ;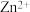 的价层电子排布式
的价层电子排布式_______
(2)浸渣①主要含有_______ ;酸浸中Pb元素发生变化的化学反应方程式_______
(3)采取下列哪些措施可以提高锗的浸出率_______ (填代号);
A.增大烟尘与硫酸的固液比 B.多次反复浸出 C.适当进行搅拌
(4)流程中,“I”加入Zn粉主要是为了置换_______ (填离子符号);
(5)流程中,“II”控制pH最高为_______ (溶液中金属离子浓度均按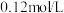 计算),该步骤pH不宜过低,除了考虑到锰的形态可能发生变化外,主要原因可能是
计算),该步骤pH不宜过低,除了考虑到锰的形态可能发生变化外,主要原因可能是_______ 。
(6)流程中,“II”除锰反应的离子方程式为_______ ;
(7)沉锌的化学方程式为_______ 。
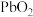 、
、 、
、 等)生产储精矿和碱式碳酸锌
等)生产储精矿和碱式碳酸锌 。其流程如下:
。其流程如下:
已知:I.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
II.25℃:
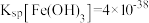 、
、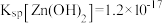 。
。请回答下列问题:
(1)
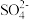 的空间结构
的空间结构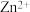 的价层电子排布式
的价层电子排布式(2)浸渣①主要含有
(3)采取下列哪些措施可以提高锗的浸出率
A.增大烟尘与硫酸的固液比 B.多次反复浸出 C.适当进行搅拌
(4)流程中,“I”加入Zn粉主要是为了置换
(5)流程中,“II”控制pH最高为
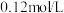 计算),该步骤pH不宜过低,除了考虑到锰的形态可能发生变化外,主要原因可能是
计算),该步骤pH不宜过低,除了考虑到锰的形态可能发生变化外,主要原因可能是(6)流程中,“II”除锰反应的离子方程式为
(7)沉锌的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池、医药工业、催化行业以及印染工业等行业,由一种废料(主要成分是铁镍合金,还含有铜、镁、硅的氧化物)为原料制取NiSO4·6H2O的步骤如下:

已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价。
②常温下Ksp(MgF2)=6.4×10-9,Ka(HF)=6.4×10-4。
(1)滤渣的主要成分是___________
(2)“除铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,其中铁元素的化合价为___________ 。
(3)“溶解”时加入H2O2溶液的目的是___________ 。
(4)向“除铜”后的滤液中加入NaF溶液,使Mg2+转化为MgF2沉淀除去。若溶液pH偏低,将会导致MgF2沉淀不完全,其原因是______ 。当溶液中镁离子恰好沉淀完全时,溶液中c(F-)为_________ mol/L。
(5)“沉镍”后得到的滤液中,可循环使用的主要溶质为___________ (填化学式)。
(6)制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是___________ 。
(7)NiSO4在NaOH溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为___________ 。

已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价。
②常温下Ksp(MgF2)=6.4×10-9,Ka(HF)=6.4×10-4。
(1)滤渣的主要成分是
(2)“除铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,其中铁元素的化合价为
(3)“溶解”时加入H2O2溶液的目的是
(4)向“除铜”后的滤液中加入NaF溶液,使Mg2+转化为MgF2沉淀除去。若溶液pH偏低,将会导致MgF2沉淀不完全,其原因是
(5)“沉镍”后得到的滤液中,可循环使用的主要溶质为
(6)制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是
(7)NiSO4在NaOH溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】工业上常用绿矾( )作还原剂
)作还原剂
(1)检验久置绿矾是否变质可用试剂___________ 。
(2)①工业上常用 溶液刻蚀铜电路板,反应的离子方程式为
溶液刻蚀铜电路板,反应的离子方程式为___________ 。
腐蚀废液含 、
、 、
、 ,某小组欲从腐蚀废液中回收铜及制绿矾,工艺流程如下:
,某小组欲从腐蚀废液中回收铜及制绿矾,工艺流程如下:
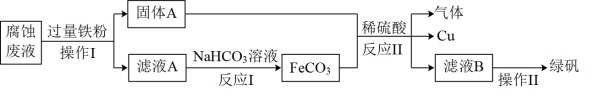
②操作I中使用的玻璃仪器除烧杯、玻璃棒外还有____ ;腐蚀废液中加入过量铁粉的目的____ 。
③固体A中含有______ ;操作II的过程是:蒸发至出现一层晶膜、______ 、过滤、洗涤、常温晾干。
④反应I中生成 沉淀同时有
沉淀同时有 和水生成,反应的离子方程式为
和水生成,反应的离子方程式为___________ 。
(3)绿矾可用于缺铁性贫血的补铁剂,医生建议与维生素C同服。某同学探究维生素C的作用,取少量 溶液于试管中,加入维生素C片2片,并振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论
溶液于试管中,加入维生素C片2片,并振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论___________ 。(已知: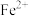 遇铁氰化钾溶液产生蓝色沉淀)
遇铁氰化钾溶液产生蓝色沉淀)
 )作还原剂
)作还原剂(1)检验久置绿矾是否变质可用试剂
(2)①工业上常用
 溶液刻蚀铜电路板,反应的离子方程式为
溶液刻蚀铜电路板,反应的离子方程式为腐蚀废液含
 、
、 、
、 ,某小组欲从腐蚀废液中回收铜及制绿矾,工艺流程如下:
,某小组欲从腐蚀废液中回收铜及制绿矾,工艺流程如下:
②操作I中使用的玻璃仪器除烧杯、玻璃棒外还有
③固体A中含有
④反应I中生成
 沉淀同时有
沉淀同时有 和水生成,反应的离子方程式为
和水生成,反应的离子方程式为(3)绿矾可用于缺铁性贫血的补铁剂,医生建议与维生素C同服。某同学探究维生素C的作用,取少量
 溶液于试管中,加入维生素C片2片,并振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论
溶液于试管中,加入维生素C片2片,并振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论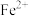 遇铁氰化钾溶液产生蓝色沉淀)
遇铁氰化钾溶液产生蓝色沉淀)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成不利影响,因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂成为热点。以下是以含钴废渣(主要成分CoO、Co2O3,还含有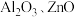 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程:
的一种工艺流程:

已知:Ksp[ ]
]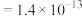 ,Ksp[
,Ksp[ ]
]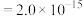
回答下列问题:
(1)“酸浸”时通入 的目的是
的目的是_______ 。
(2)“除铝”步骤中,铝离子发生的离子反应方程式_______ 。
(3)“萃取”过程可表示为 ,从有机层获取
,从有机层获取 ,下列试剂最好选择_______。
,下列试剂最好选择_______。
(4)“沉钴”的离子方程式是_______ 。“沉钴”步骤选择 ,而不选择
,而不选择 是为了避免有
是为了避免有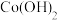 的生成,向溶液加入
的生成,向溶液加入 溶液,当溶液的
溶液,当溶液的 达到7.4时,就会同时有
达到7.4时,就会同时有 生成,计算当溶液的
生成,计算当溶液的 为7.4时,此时溶液中的
为7.4时,此时溶液中的 浓度=
浓度=_______  。
。
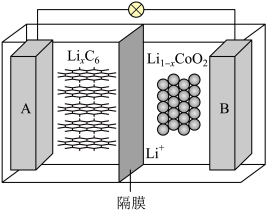
(5) 与纯碱反应可以制备重要的电极材料钴酸锂
与纯碱反应可以制备重要的电极材料钴酸锂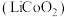 。一种充电电池的装置如下图所示,充放电过程中,存在
。一种充电电池的装置如下图所示,充放电过程中,存在 与
与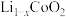 之间的转化,放电过程中
之间的转化,放电过程中 从A电极向B电极迁移,写出该电池放电时的正极反应:
从A电极向B电极迁移,写出该电池放电时的正极反应:_______ ,若用该电池进行电解食盐水,当通过隔膜的离子数目为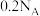 时,电解池阴极收集到的气体体积在标准状况下为
时,电解池阴极收集到的气体体积在标准状况下为_______ L。
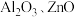 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程:
的一种工艺流程:
已知:Ksp[
 ]
]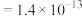 ,Ksp[
,Ksp[ ]
]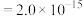
回答下列问题:
(1)“酸浸”时通入
 的目的是
的目的是(2)“除铝”步骤中,铝离子发生的离子反应方程式
(3)“萃取”过程可表示为
 ,从有机层获取
,从有机层获取 ,下列试剂最好选择_______。
,下列试剂最好选择_______。| A.稀硫酸 | B. 溶液 溶液 | C. | D.水 |
 ,而不选择
,而不选择 是为了避免有
是为了避免有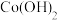 的生成,向溶液加入
的生成,向溶液加入 溶液,当溶液的
溶液,当溶液的 达到7.4时,就会同时有
达到7.4时,就会同时有 生成,计算当溶液的
生成,计算当溶液的 为7.4时,此时溶液中的
为7.4时,此时溶液中的 浓度=
浓度= 。
。(5)
 与纯碱反应可以制备重要的电极材料钴酸锂
与纯碱反应可以制备重要的电极材料钴酸锂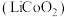 。一种充电电池的装置如下图所示,充放电过程中,存在
。一种充电电池的装置如下图所示,充放电过程中,存在 与
与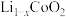 之间的转化,放电过程中
之间的转化,放电过程中 从A电极向B电极迁移,写出该电池放电时的正极反应:
从A电极向B电极迁移,写出该电池放电时的正极反应: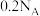 时,电解池阴极收集到的气体体积在标准状况下为
时,电解池阴极收集到的气体体积在标准状况下为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:
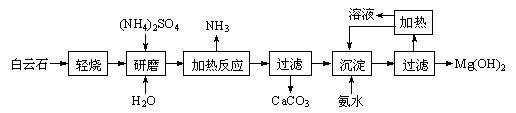
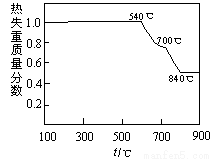
已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:
② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份_____ (填化学式)。结合上图判断“轻烧”温度应不超过 _____ 。
(2)“加热反应”的化学方程式为_________________________ 。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)=_______ (已知)。
(4)该工艺中可以循环使用的物质是________ (填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石 的方法,其优点是__________________________ 。

已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:

② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份
(2)“加热反应”的化学方程式为
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)=
(4)该工艺中可以循环使用的物质是
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石 的方法,其优点是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】对废催化剂进行回收可有效利用金属资源。某废催化剂主要含有TiO2、V2O5、WO3、SiO2、Al2O3,一种回收利用工艺的流程如图:

已知:25℃时,Ksp(CaWO4)=8.7×10-9,Ksp[Ca(OH)2]=5.5×10-6。
回答下列问题:
(1)“焙烧”产物中含有NaVO3和NaAlO2。NaVO3中V元素的化合价为___ ,Al2O3转化为NaAlO2的化学方程式为___ 。“焙烧”时不能使用陶瓷容器,原因是___ 。
(2)“水浸”所得滤液中含有的阴离子除OH-、CO 、AlO
、AlO 、VO
、VO 外,还有
外,还有___ 。
(3)“调pH=8”的目的是___ 。
(4)焙烧NH4VO3可生成V2O5,并产生一种碱性气体,该气体用___ (填试剂名称)吸收后,可循环利用。
(5)“沉钨”过程中,当溶液中c(OH-)=___ (写出计算式)mol•L-1时,溶液中WO 恰好完全沉淀(离子浓度等于1×10-5mol•L-1),应停止加入石灰乳。
恰好完全沉淀(离子浓度等于1×10-5mol•L-1),应停止加入石灰乳。
(6)用热盐酸淋洗CaWO4获得H2WO4。设计实验证明CaWO4已经转化完全的实验方案:取少量最后一次的淋洗液于试管中,___ 。

已知:25℃时,Ksp(CaWO4)=8.7×10-9,Ksp[Ca(OH)2]=5.5×10-6。
回答下列问题:
(1)“焙烧”产物中含有NaVO3和NaAlO2。NaVO3中V元素的化合价为
(2)“水浸”所得滤液中含有的阴离子除OH-、CO
 、AlO
、AlO 、VO
、VO 外,还有
外,还有(3)“调pH=8”的目的是
(4)焙烧NH4VO3可生成V2O5,并产生一种碱性气体,该气体用
(5)“沉钨”过程中,当溶液中c(OH-)=
 恰好完全沉淀(离子浓度等于1×10-5mol•L-1),应停止加入石灰乳。
恰好完全沉淀(离子浓度等于1×10-5mol•L-1),应停止加入石灰乳。(6)用热盐酸淋洗CaWO4获得H2WO4。设计实验证明CaWO4已经转化完全的实验方案:取少量最后一次的淋洗液于试管中,
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】氮氧化铝(AlON)具有多晶陶瓷在材料制备方面的优势,有着广阔的应用前景。工业上利用某铝土矿(含Al2O3及少量的MgO等杂质)生产氮氧化铝的流程如图所示。回答下列问题:
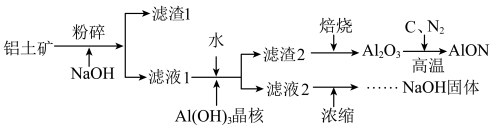
(1)为提高铝土矿碱浸的速率,除粉碎外,还可以采取的措施是_____ (写出一项即可)
(2)滤液1的溶质有NaOH、_____ 。滤渣2的成分是_____ 。向滤液1中加水的目的是_______ 。该过程也可用通入足量的_____ 气体的方法来代替。
(3)滤液2浓缩的过程中常会吸收空气中的CO2,为得到纯净的NaOH,需要加入适量____ (填化学式)。整个流程中,可循环的物质是_____ 。
(4)写出制备AlON的化学方程式_______ 。
(5)取1吨Al2O3质量分数为91.8%的铝土矿样品,利用上述流程AlON,最终制得氮氧化铝820.8kg,则氮氧化铝的产率为______ 。

(1)为提高铝土矿碱浸的速率,除粉碎外,还可以采取的措施是
(2)滤液1的溶质有NaOH、
(3)滤液2浓缩的过程中常会吸收空气中的CO2,为得到纯净的NaOH,需要加入适量
(4)写出制备AlON的化学方程式
(5)取1吨Al2O3质量分数为91.8%的铝土矿样品,利用上述流程AlON,最终制得氮氧化铝820.8kg,则氮氧化铝的产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为 ,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:

已知: 与C、
与C、 在600℃的沸腾炉中充分反应后,尾气中每产生
在600℃的沸腾炉中充分反应后,尾气中每产生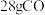 同时生成
同时生成 。
。
(1)尾气中CO与 的物质的量之比为
的物质的量之比为___________ ;氯化过程中氧化剂是___________ (填化学式)。
(2)该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为___________ 。
(3)随着温度升高,尾气中CO的含量升高,原因是___________ 。
(4)写出流程中加入Mg冶炼Ti的化学方程式___________ ,该过程要在氩气(Ar)气体氛围中进行的理由是___________ 。
 ,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知:
 与C、
与C、 在600℃的沸腾炉中充分反应后,尾气中每产生
在600℃的沸腾炉中充分反应后,尾气中每产生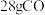 同时生成
同时生成 。
。(1)尾气中CO与
 的物质的量之比为
的物质的量之比为(2)该温度下,
 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为(3)随着温度升高,尾气中CO的含量升高,原因是
(4)写出流程中加入Mg冶炼Ti的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如图所示:
 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出浸出过程中Co2O3发生反应的离子方程式__________________________ 。
(2)NaClO3的作用是___________________________________ 。
(3)加Na2CO3调pH至5.2所得沉淀为____________________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。萃取剂的作用是_____ ;其使用的适宜pH范围是_____ (填字母)。
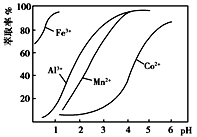
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)NaClO3的作用是
(3)加Na2CO3调pH至5.2所得沉淀为
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。萃取剂的作用是

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】叠氮化钠( )常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚。
)常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚。
(1)实验室制取叠氮化钠的原理、装置及主要步骤如下:
a.
b.

①组装仪器检查装置气密性后,装入药品,装置C中盛放的药品是___________ 。
②实验过程应先点燃___________ (填“A”或“D”)的酒精灯,理由是___________ 。
③在反应a充分进行后,通入 气体,此时加热采用油浴而不用水浴的主要原因是
气体,此时加热采用油浴而不用水浴的主要原因是___________ 。
(2)装置D反应完全结束后,取出混合物进行以下操作,得到 固体:
固体:

已知: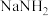 能与水反应生成
能与水反应生成 和氨气。操作Ⅱ的目的是
和氨气。操作Ⅱ的目的是___________ ;操作IV最好选用的试剂是___________ 。
 )常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚。
)常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚。(1)实验室制取叠氮化钠的原理、装置及主要步骤如下:
a.

b.


①组装仪器检查装置气密性后,装入药品,装置C中盛放的药品是
②实验过程应先点燃
③在反应a充分进行后,通入
 气体,此时加热采用油浴而不用水浴的主要原因是
气体,此时加热采用油浴而不用水浴的主要原因是(2)装置D反应完全结束后,取出混合物进行以下操作,得到
 固体:
固体:
已知:
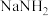 能与水反应生成
能与水反应生成 和氨气。操作Ⅱ的目的是
和氨气。操作Ⅱ的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上以硫酸渣(含Fe2O3、SiO2等)为主要原料生产氧化铁黄的一种工艺流程如图所示:
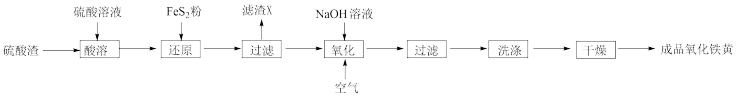
已知:硫酸渣(含Fe2O3、SiO2等)是指黄铁矿制硫酸后的残渣。
(1)“过滤”操作中需要用到的玻璃仪器有_____ 。
(2)“滤渣X”的成分主要有SiO2和_____ 。
(3)“氧化”过程生成氧化铁黄的离子方程式是_____ 。
(4)若在实验室中进行上述流程,“洗涤”的方法是_____ 。
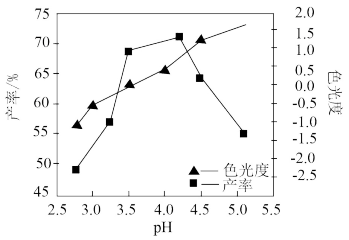
(5)合格氧化铁黄的色光度值范围为-0.5~0.5,氧化过程中溶液的pH对产率、色光度的影响如图所示,氧化时应控制pH的合理范围是____ ,pH过大会导致产品的颜色变黑,可能含有的杂质____ (填化学式)。

已知:硫酸渣(含Fe2O3、SiO2等)是指黄铁矿制硫酸后的残渣。
(1)“过滤”操作中需要用到的玻璃仪器有
(2)“滤渣X”的成分主要有SiO2和
(3)“氧化”过程生成氧化铁黄的离子方程式是
(4)若在实验室中进行上述流程,“洗涤”的方法是
(5)合格氧化铁黄的色光度值范围为-0.5~0.5,氧化过程中溶液的pH对产率、色光度的影响如图所示,氧化时应控制pH的合理范围是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以低品位红土镍矿(主要成分可表示为 、
、 、
、 ,含有少量
,含有少量 、
、 、
、 、
、 )为原料制备纳米级
)为原料制备纳米级 的工艺流程如下:
的工艺流程如下:
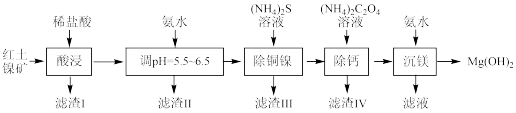
已知氢氧化物的参数如下表:
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是______ (填化学式)。
(2)常温下,调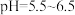 的目的是
的目的是______ 。当 时,溶液中
时,溶液中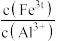 =
=______
(3)写出“除铜镍”过程发生反应的离子方程式为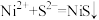 、
、______________ 。“除钙”过程反应温度不宜超过 的原因
的原因_________________________ 。
(4)“滤液”中溶质的主要成分为________________ ,获取该物质晶体的具体实验操作为__________ 。
 、
、 、
、 ,含有少量
,含有少量 、
、 、
、 、
、 )为原料制备纳米级
)为原料制备纳米级 的工艺流程如下:
的工艺流程如下: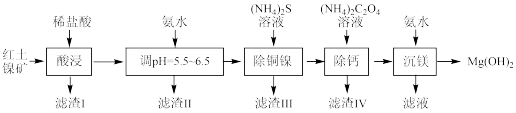
已知氢氧化物的参数如下表:
| 氢氧化物 | 溶度积 | 开始沉淀 | 完全沉淀 |
 |  | 4.1 | 5.5 |
 | 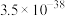 | 2.2 | 3.5 |
 | 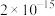 | 6.7 | 9.5 |
 | 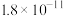 | 9.4 | 12.4 |
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是
(2)常温下,调
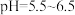 的目的是
的目的是 时,溶液中
时,溶液中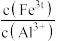 =
=(3)写出“除铜镍”过程发生反应的离子方程式为
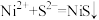 、
、 的原因
的原因(4)“滤液”中溶质的主要成分为
您最近一年使用:0次



