室温下,下列溶液等体积混合后,所得溶液的pH大于7的是
| A.pH=4的盐酸和pH=10的氨水 |
| B.0.1mol/L的硫酸和0.1mol/L的氢氧化钡溶液 |
| C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液 |
| D.0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 |
更新时间:2018-12-24 22:10:51
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】常温下,将0.1mol·L-1的CH3COONa 溶液与0.1mol·L-1的HCl溶液混合至中性,下列叙述不正确的是
| A.加入的CH3COONa 溶液体积更大 |
| B.c(OH-)=c(H+) |
| C.c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) |
| D.c(Na+)+c(H+)=c(OH-)+ c(CH3COO-)+ c(Cl-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温时,分别向 20 mL0.1 mol·L-1CH3COOH 溶液和20 mL 0.1 mol·L-1HCl溶液中逐滴加入0.1mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是
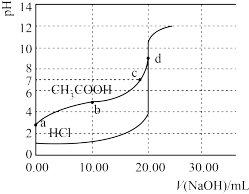

| A.CH3COOH滴定曲线上的a、b、c、d四点中水的电离程度最大的是c点 |
| B.b点时溶液的 pH近似等于CH3COOH的电离平衡常数的负对数 |
| C.c点时溶液中c(Na+)>c(CH3COO-) |
| D.该实验中滴定时HCl溶液pH的突变范围(恰好中和时少滴或多滴1滴NaOH溶液的pH,1滴溶液体积约0.04mL)是3~11 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】下列有关说法中错误的是
A.某温度时的混合溶液中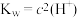 ,说明该溶液呈中性( ,说明该溶液呈中性(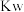 为该温度时水的离子积常数) 为该温度时水的离子积常数) |
B.常温下,由水电离出的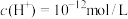 的溶液的 的溶液的 可能为2或12 可能为2或12 |
C.已知 , ,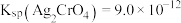 ,向含有Cl-、CrO ,向含有Cl-、CrO 且浓度均为 且浓度均为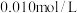 溶液中逐滴加入 溶液中逐滴加入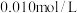 的 的 溶液时,CrO 溶液时,CrO 先产生沉淀 先产生沉淀 |
D.常温下,某 的 的 和 和 混合溶液中, 混合溶液中,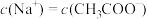 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】25℃时,用NaOH溶液分别滴定HA(弱酸)、 、
、 三种溶液,pM[
三种溶液,pM[ ,M表示
,M表示 、
、 或
或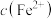 ]随pH变化关系如图所示。下列有关分析不正确的是
]随pH变化关系如图所示。下列有关分析不正确的是
已知:①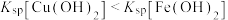 ;②溶液中离子浓度小于
;②溶液中离子浓度小于 可以认为已经除尽。
可以认为已经除尽。
 、
、 三种溶液,pM[
三种溶液,pM[ ,M表示
,M表示 、
、 或
或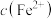 ]随pH变化关系如图所示。下列有关分析不正确的是
]随pH变化关系如图所示。下列有关分析不正确的是已知:①
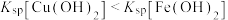 ;②溶液中离子浓度小于
;②溶液中离子浓度小于 可以认为已经除尽。
可以认为已经除尽。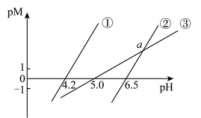
A.图中②代表滴定 溶液的变化关系 溶液的变化关系 |
B.25℃时,要除尽工业废水中的 ,需调整溶液的pH至少为6.7 ,需调整溶液的pH至少为6.7 |
| C.图中a点pH=7 |
D.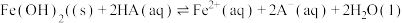 的平衡常数为 的平衡常数为 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】设NA为阿伏加德罗常数的值。下列说法正确的是
| A.100g质量分数为46%的乙醇溶液中,含O—H键的数目为7NA |
| B.0.1mol·L-1的CH3COONa溶液中,含CH3COO-的数目小于0.1NA |
| C.含0.2molH2SO4的浓硫酸与足量的镁反应,转移的电子数小于0.2NA |
| D.常温下,1LpH=11的Ba(OH)2溶液中,含OH-的数目为0.002NA |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】25℃时,用0.1000mol·L-1的NaOH溶液滴定20.00mL0.1000mol·L-1的HA溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法错误的是
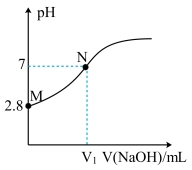

| A.V1<20 |
| B.Ka(HA)的数量级为10-5 |
C.M点溶液加少量水稀释, 增大 增大 |
| D.pH=4的HA溶液和pH=10的NaA溶液,由水电离出的c(H+)相等 |
您最近一年使用:0次
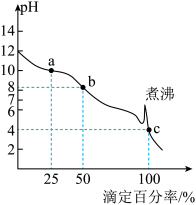
【推荐2】常温下,用 盐酸滴定
盐酸滴定 溶液时,溶液pH随滴定百分率的变化如图所示。已知:b点溶液中
溶液时,溶液pH随滴定百分率的变化如图所示。已知:b点溶液中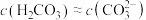 ,
,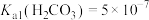 ,
,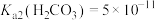 ,
, 。下列说法错误的是
。下列说法错误的是
 盐酸滴定
盐酸滴定 溶液时,溶液pH随滴定百分率的变化如图所示。已知:b点溶液中
溶液时,溶液pH随滴定百分率的变化如图所示。已知:b点溶液中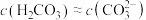 ,
,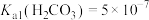 ,
,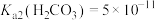 ,
, 。下列说法错误的是
。下列说法错误的是
A.a点的溶液中: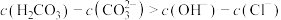 |
| B.b点溶液的pH约为8.3 |
C.煮沸的目的是除去溶解的 ,使突跃变大,冷却后继续滴定到终点 ,使突跃变大,冷却后继续滴定到终点 |
| D.滴定过程可选用酚酞、甲基橙双指示剂 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下,向 的
的 溶液中滴加
溶液中滴加 的
的 溶液,溶液中
溶液,溶液中 随pH的变化关系如图所示(
随pH的变化关系如图所示(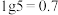 )。下列说法错误的是
)。下列说法错误的是
 的
的 溶液中滴加
溶液中滴加 的
的 溶液,溶液中
溶液,溶液中 随pH的变化关系如图所示(
随pH的变化关系如图所示(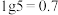 )。下列说法错误的是
)。下列说法错误的是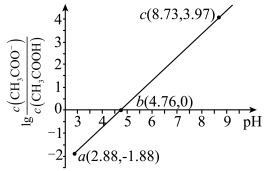
A.常温下, 的电离平衡常数为 的电离平衡常数为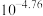 |
B.当溶液的 时,消耗 时,消耗 溶液体积小于 溶液体积小于 |
C.c点溶液中: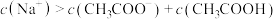 |
D.溶液中水的电离程度大小: |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,向二元弱酸 溶液中滴加
溶液中滴加 溶液,测得混合溶液的
溶液,测得混合溶液的 与离子浓度变化的关系如图所示,下列说法不正确的是
与离子浓度变化的关系如图所示,下列说法不正确的是
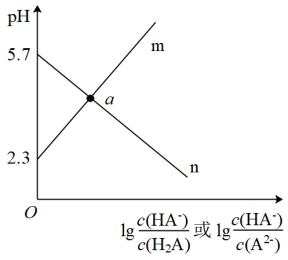
 溶液中滴加
溶液中滴加 溶液,测得混合溶液的
溶液,测得混合溶液的 与离子浓度变化的关系如图所示,下列说法不正确的是
与离子浓度变化的关系如图所示,下列说法不正确的是
A.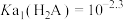 |
B.m表示 与 与 的变化关系 的变化关系 |
C.交点a的溶液中: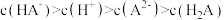 |
D.等浓度等体积的 溶液与 溶液与 溶液混合,所得溶液呈酸性 溶液混合,所得溶液呈酸性 |
您最近一年使用:0次

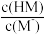 、pOH与加入NaOH溶液的体积V的变化关系如图所示。
、pOH与加入NaOH溶液的体积V的变化关系如图所示。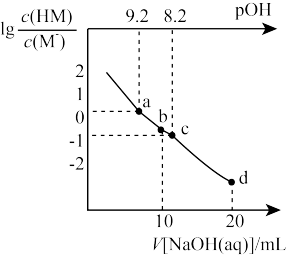
 溶液和
溶液和

 的
的 溶液与
溶液与 的NaOH溶液等体积混合:
的NaOH溶液等体积混合: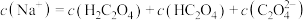
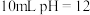 的氢氧化钠溶液中加入
的氢氧化钠溶液中加入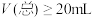
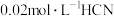 溶液与
溶液与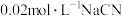 溶液等体积混合,已知混合溶液中
溶液等体积混合,已知混合溶液中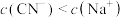 ,则
,则
 ,已知醋酸的电离常数为
,已知醋酸的电离常数为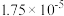 ,将
,将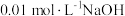 溶液滴入
溶液滴入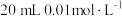
 溶液的过程中,溶液中由水电离出的
溶液的过程中,溶液中由水电离出的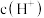 与加入
与加入
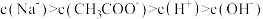
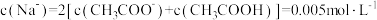
 与
与 的比值逐渐减小
的比值逐渐减小

