某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)元素B,C,D的第一电离能由大到小排列顺序为________ (用元素符号表示)。
(2)D元素基态原子的最外层电子排布图为________ 。
(3)该配位化合物的化学式为________ ,配体的中心原子的杂化方式为________ 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_______________ 。
(5)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________ ,分子中含有________ 个σ键,________ 个π键。
(1)元素B,C,D的第一电离能由大到小排列顺序为
(2)D元素基态原子的最外层电子排布图为
(3)该配位化合物的化学式为
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为
(5)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为
更新时间:2019-01-02 22:51:52
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】2019年诺贝尔化学奖授予约翰•古德伊纳夫、斯坦利•惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题:
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为_______ ,基态磷原子中,电子占据的最高能层符号为_______ 。
(2)[Co(NO3)4]2-中Co2+的配位数为4,配体中N原子的杂化方式为_______ ,该配离子中各元素的第一电离能由小到大的顺序为_______ (填元素符号)。
(3)下列实验事实不能用氢键来解释的是_______。
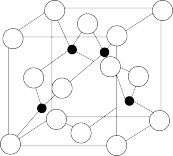
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。该晶体中铜原子和M原子之间的最短距离为apm,阿伏加德罗常数为NA,则该晶体的密度为_____ g/cm3(只写计算式)。
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为
(2)[Co(NO3)4]2-中Co2+的配位数为4,配体中N原子的杂化方式为
(3)下列实验事实不能用氢键来解释的是_______。
| A.CH4比SiH4稳定 |
| B.接近沸点的水蒸气的相对分子质量测量值大于18 |
| C.邻羟基苯甲醛的沸点低于对羟基苯甲醛 |
| D.乙醇能与水以任意比互溶 |

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】B和Ni均为新材料的主角。回答下列问题:
(1)基态B原子的核外电子有___________ 种空间运动状态;基态Ni原子核外占据最高能层电子的电子云轮廓图的形状为___________ 。
(2)硼的卤化物的沸点如表所示:
解释表中卤化物之间沸点差异的原因___________ 。
(3)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为___________ ;Ni(PPh3)2晶体中存在的化学键类型有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
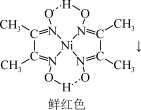
(4)鉴定Ni2+的特征反应如下:
Ni2++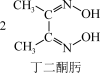

 +2H+
+2H+
在1mol鲜红色沉淀中,含有sp2杂化原子的数目为___________ 个(阿伏加德罗常数的值为NA)。丁二酮肟中,各元素电负性由大到小的顺序为___________ (用元素符号表示)。
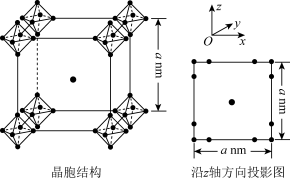
(5)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=___________ g·cm-3。
(1)基态B原子的核外电子有
(2)硼的卤化物的沸点如表所示:
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
解释表中卤化物之间沸点差异的原因
(3)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(4)鉴定Ni2+的特征反应如下:
Ni2++


 +2H+
+2H+在1mol鲜红色沉淀中,含有sp2杂化原子的数目为
(5)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______ ,铬元素在周期表中______ 区。
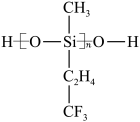
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为_______ 杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______ 填元素符号
②根据价层电子对互斥理论,预测ClO3-的空间构型为______ 形,写出一个ClO3-的等电子体的化学符号______ 。
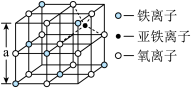
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?_____ (填“是”或“否”);该立方体是不是Fe3O4的晶胞?______ (填“是”或“否”);立方体中铁离子处于氧离子围成的_______ (填空间结构)空隙;根据下图计算Fe3O4晶体的密度为________ g/cm3。(图中a=0.42nm,计算结果保留两位有效数字)
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】元素周期表有许多有趣的编排方式,一种元素周期表的一部分如图所示,0、I~VIII均代表族序数,A~I代表不同的元素。
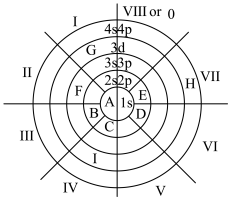
回答下列问题:
(1)H所代表的元素为_____ (填元素符号),I元素在周期表中的位置是_____ ,基态I原子的外围电子排布式为_____ 。
(2)图示周期表所列的元素中,电负性最大的元素是_____ (填元素符号,下同);B、C、D、E的第一电离能从大到小的顺序为_____ 。
(3)F、G分别与D形成的化合物中均含的键是_____ (填“离子键”或“共价键”),均属于_____ 晶体。
(4)利用图示周期表中所列元素,完成表格:(中心原子X上没有孤电子对,所用元素均为图中元素)

回答下列问题:
(1)H所代表的元素为
(2)图示周期表所列的元素中,电负性最大的元素是
(3)F、G分别与D形成的化合物中均含的键是
(4)利用图示周期表中所列元素,完成表格:(中心原子X上没有孤电子对,所用元素均为图中元素)
| XYn | 分子的空间结构 | 典型例子(填化学式) |
| n=2 | ① | ② |
| n=3 | ③ | ④ |
| n=4 | ⑤ | ⑥ |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】钴及其化合物被广泛应用于光电材料领域。一种钴的化合物能高效催化 还原为
还原为 ,其结构如图所示。
,其结构如图所示。
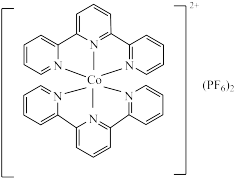
回答下列问题:
(1)基态Co原子的价电子排布式为___________ 。
(2)该物质所含非金属元素中杂化方式为 的有
的有___________ ;其中N、F和P的电负性大小顺序为___________ 。
(3) 的空间结构为
的空间结构为___________ , 与有机基团形成的离子液体常作电解质,其优点是
与有机基团形成的离子液体常作电解质,其优点是___________ 。
(4)该钴的化合物晶体中存在的相互作用力有___________ (填字母)。
a.离子键 b.共价键 c.金属键 d.氢键
(5)一种钴的氧化物在纳米储能领域被广泛研究,其晶胞结构如图所示(白球为Co,黑球为O):
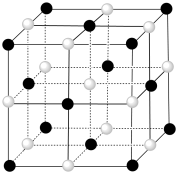
①Co的配位数为___________ 。
②已知晶胞参数为 ,则该晶体的密度为
,则该晶体的密度为___________  。
。
 还原为
还原为 ,其结构如图所示。
,其结构如图所示。
回答下列问题:
(1)基态Co原子的价电子排布式为
(2)该物质所含非金属元素中杂化方式为
 的有
的有(3)
 的空间结构为
的空间结构为 与有机基团形成的离子液体常作电解质,其优点是
与有机基团形成的离子液体常作电解质,其优点是(4)该钴的化合物晶体中存在的相互作用力有
a.离子键 b.共价键 c.金属键 d.氢键
(5)一种钴的氧化物在纳米储能领域被广泛研究,其晶胞结构如图所示(白球为Co,黑球为O):

①Co的配位数为
②已知晶胞参数为
 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如下。回答下列问题:

已知:①MnSO4·H2O易溶于水,不溶于乙醇。
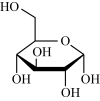
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:
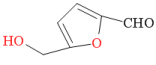

 +HCOOH
+HCOOH
(1)请写出Mn原子基态价层电子排布式_______ 。
(2)已知Pb2Mn8O16中 Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为_______ 。
(3)“还原酸浸”过程中主要反应的离子方程式为_______ 。
(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为_______ 。
(5)整个流程中可循环利用的物质是_______ 。获得MnSO4·H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是_______ 。
(6)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为_______ mol/L(保留两位小数)。判断沉淀转化能否彻底进行并说明理由_______ 。[已知: 20℃时Ksp (PbSO4)=1.6×10-8mol2·L-2,Ksp (PbCO3)=7.4×10-14mol2·L-2,1.262≈1.6]

已知:①MnSO4·H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

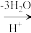


 +HCOOH
+HCOOH(1)请写出Mn原子基态价层电子排布式
(2)已知Pb2Mn8O16中 Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
(3)“还原酸浸”过程中主要反应的离子方程式为
(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为
(5)整个流程中可循环利用的物质是
(6)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】高氯酸三碳酰肼合镍{[Ni(CHZ)3](C104)2}是一种新型的起爆药。
(1)Ni2+核外电子排布式为___ 。
(2)ClO4-空间构型是___ ;与ClO4-互为等电子体的一种分子为___ (填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为___ ;C、N、O三种元素的电负性由大到小的顺序为___ 。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为___ 。
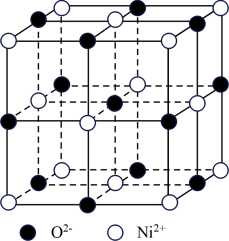
(1)Ni2+核外电子排布式为
(2)ClO4-空间构型是
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为

您最近一年使用:0次
【推荐2】钴及其化合物在催化剂、磁性材料、电池等领域应用十分广泛。回答下列问题:
(1)纳米氧化钴可以在室温下将甲醛完全催化氧化为 和
和 。
。
①基态钴原子的核外价层电子排布式为___________ 。
②甲醛分子中三种元素电负性由大到小的顺序为___________ (填元素符号);甲醛分子的立体构型为___________ ;分子中 键与
键与 键数目比为
键数目比为___________ 。
(2) 是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是
是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是___________ , 是
是___________ (填“极性”或“非极性”)分子。
(3) 可用作锂离子电池的电极材料。在元素周期表中,与
可用作锂离子电池的电极材料。在元素周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ (填元素符号),该元素基态原子核外M层电子的自旋状态___________ (填“相同”或“相反”); 的熔点为848℃,属于
的熔点为848℃,属于___________ 晶体。
(4)某钴化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图,已知晶胞参数为 ,则此晶体密度为(列出计算式即可)
,则此晶体密度为(列出计算式即可)___________  。(
。( 代表阿伏伽德罗常数)
代表阿伏伽德罗常数)

(1)纳米氧化钴可以在室温下将甲醛完全催化氧化为
 和
和 。
。①基态钴原子的核外价层电子排布式为
②甲醛分子中三种元素电负性由大到小的顺序为
 键与
键与 键数目比为
键数目比为(2)
 是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是
是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是 是
是(3)
 可用作锂离子电池的电极材料。在元素周期表中,与
可用作锂离子电池的电极材料。在元素周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是 的熔点为848℃,属于
的熔点为848℃,属于(4)某钴化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图,已知晶胞参数为
 ,则此晶体密度为(列出计算式即可)
,则此晶体密度为(列出计算式即可) 。(
。( 代表阿伏伽德罗常数)
代表阿伏伽德罗常数)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)CuSO4晶体中 S 原子的杂化方式为________ , 的立体构型为
的立体构型为 ___________ 。
(2)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为___________________ 。N、O、S 三种元素的第一电离能大小顺序为 _________________ (填元素符号)。
②向 CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是______ 。
A.NH3分子和H2O 分子均为极性分子但中心原子杂化类型不一样;
B.NH3分子和H2O 分子,分子空间构型不同,氨气分子的键角小于水分子的键角;
C.Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体;
D.已知 3.4 g 氨气在氧气中完全燃烧生成无污染的气体,并放出 a kJ 热量,则 NH3的燃烧热的热化学方程式为:NH3 (g)+3/4O 2(g)=1/2N2 (g)+3/2H2O(g) ΔH=-5a kJ•mol-1
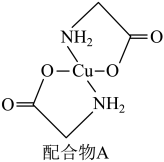
(3)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物 A,其结构如下图所示。
①氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:______________ (写化学式)。
②1 mol 氨基乙酸钠(H2NCH2COONa)含有σ键的数目为_____________ 。(NA为阿伏加 德罗常数的值)
③该结构中,除共价键外还存在配位键,请在图中用“→”表示出配位键_____________ 。
(1)CuSO4晶体中 S 原子的杂化方式为
 的立体构型为
的立体构型为 (2)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为
②向 CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是
A.NH3分子和H2O 分子均为极性分子但中心原子杂化类型不一样;
B.NH3分子和H2O 分子,分子空间构型不同,氨气分子的键角小于水分子的键角;
C.Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体;
D.已知 3.4 g 氨气在氧气中完全燃烧生成无污染的气体,并放出 a kJ 热量,则 NH3的燃烧热的热化学方程式为:NH3 (g)+3/4O 2(g)=1/2N2 (g)+3/2H2O(g) ΔH=-5a kJ•mol-1
(3)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物 A,其结构如下图所示。

①氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:
②1 mol 氨基乙酸钠(H2NCH2COONa)含有σ键的数目为
③该结构中,除共价键外还存在配位键,请在图中用“→”表示出配位键
您最近一年使用:0次



