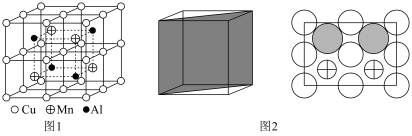
已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F 与E位于同一周期,且是该周期元素中电负性最大的元素。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为____________ (用化学式表示),原因是_____________________ 。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是____________ 。
(3)1 mol B2A2分子中含σ键的数目是____________ 。
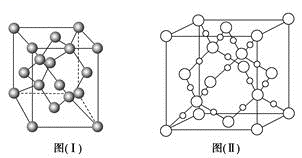
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有_____ 个原子,该晶体类型为________ 。
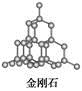
(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以_________ 相结合,其晶胞中共有8个原子,其中在面心位置贡献______ 个原子。
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于_______ (填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__________ 。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是
(3)1 mol B2A2分子中含σ键的数目是
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有


(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于
更新时间:2019-01-11 16:41:38
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】化学,让生活更美好。回答下列问题:
(1)乳酸亚铁 是一种常用的补铁剂。
是一种常用的补铁剂。
①基态 核外电子的空间运动状态有
核外电子的空间运动状态有________ 种。
②乳酸分子中σ键与π键的数目比为________ 。
③乳酸亚铁中各元素的电负性由大到小的顺序为________ 。
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如图:
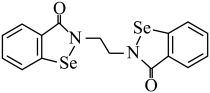
①该新药分子中有________ 种不同化学环境的C原子。
②研究发现,适量硒酸钠 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。
比较键角大小:
________  (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是________ 。
③ 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为________ (填化学式)。
(3)砷化镓(GaAs)是一种优良的半导体材料,可用于制作微型激光器或太阳能电池等。
①根据元素周期律,原子半径Ga________ As(填“>”、“<”)。
② 分子的空间构型为
分子的空间构型为________ 。 的熔点高于1000℃,
的熔点高于1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是________ 。
(1)乳酸亚铁
 是一种常用的补铁剂。
是一种常用的补铁剂。①基态
 核外电子的空间运动状态有
核外电子的空间运动状态有②乳酸分子中σ键与π键的数目比为
③乳酸亚铁中各元素的电负性由大到小的顺序为
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如图:

①该新药分子中有
②研究发现,适量硒酸钠
 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。比较键角大小:

 (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是③
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为(3)砷化镓(GaAs)是一种优良的半导体材料,可用于制作微型激光器或太阳能电池等。
①根据元素周期律,原子半径Ga
②
 分子的空间构型为
分子的空间构型为 的熔点高于1000℃,
的熔点高于1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】由美国科学家Curl和Smalley教授及英国科学家Kroto教授等人在激光气化蒸发石墨实验中,首次发现含有60个碳原子的原子簇,命名为 ,为此获得1996年诺贝尔化学奖。按要求回答下列问题:
,为此获得1996年诺贝尔化学奖。按要求回答下列问题:
(1) 为碳的一种同素异形体,基态碳原子的核外电子排布式是
为碳的一种同素异形体,基态碳原子的核外电子排布式是_______ 。
(2) 分子是由12个互不相连的五边形和20个六边形镶嵌而成的球形32面体,结构如图所示。其中
分子是由12个互不相连的五边形和20个六边形镶嵌而成的球形32面体,结构如图所示。其中 分子所含的
分子所含的 键的数目是
键的数目是_______ (已知阿伏加德罗常数的值为 )。
)。
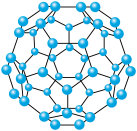
(3) 溶于氯仿
溶于氯仿_______ (填“易”或“难”),其原因可能是_______ 。
(4) 的晶胞结构如图所示。
的晶胞结构如图所示。
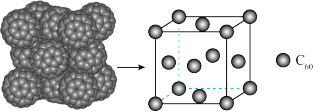
① 晶体中,每个
晶体中,每个 周围等距且紧邻的
周围等距且紧邻的 有
有_______ 个。同为分子晶体,但 的配位数(一个分子周围最近邻的分子数日)大于冰中水分子的配位数4的原因是
的配位数(一个分子周围最近邻的分子数日)大于冰中水分子的配位数4的原因是_______ 。
②已知 晶胞的晶胞参数为
晶胞的晶胞参数为 ,则
,则 晶体的密度是
晶体的密度是_______  。
。
 ,为此获得1996年诺贝尔化学奖。按要求回答下列问题:
,为此获得1996年诺贝尔化学奖。按要求回答下列问题:(1)
 为碳的一种同素异形体,基态碳原子的核外电子排布式是
为碳的一种同素异形体,基态碳原子的核外电子排布式是(2)
 分子是由12个互不相连的五边形和20个六边形镶嵌而成的球形32面体,结构如图所示。其中
分子是由12个互不相连的五边形和20个六边形镶嵌而成的球形32面体,结构如图所示。其中 分子所含的
分子所含的 键的数目是
键的数目是 )。
)。
(3)
 溶于氯仿
溶于氯仿(4)
 的晶胞结构如图所示。
的晶胞结构如图所示。
①
 晶体中,每个
晶体中,每个 周围等距且紧邻的
周围等距且紧邻的 有
有 的配位数(一个分子周围最近邻的分子数日)大于冰中水分子的配位数4的原因是
的配位数(一个分子周围最近邻的分子数日)大于冰中水分子的配位数4的原因是②已知
 晶胞的晶胞参数为
晶胞的晶胞参数为 ,则
,则 晶体的密度是
晶体的密度是 。
。
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】乙炔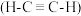 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
碳化钙晶胞示意图: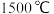 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。
①反应的化学方程式为_______ 。
②上述反应中碳原子轨道杂化类型的变化为_______ 。
③乙炔分子中 键和
键和 键数目之比为
键数目之比为_______ 。
(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
① 基态核外电子排布式为
基态核外电子排布式为_______ 。
②碳化钙晶体中哑铃形 的存在,使晶胞延一个方向拉长。碳化钙晶体中1个
的存在,使晶胞延一个方向拉长。碳化钙晶体中1个 周围距离
周围距离最近 的 围成的几何图形为
围成的几何图形为_______ (填正方形、正四面体或正八面体)。
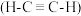 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。碳化钙晶胞示意图:
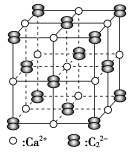
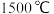 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。①反应的化学方程式为
②上述反应中碳原子轨道杂化类型的变化为
③乙炔分子中
 键和
键和 键数目之比为
键数目之比为(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
①
 基态核外电子排布式为
基态核外电子排布式为②碳化钙晶体中哑铃形
 的存在,使晶胞延一个方向拉长。碳化钙晶体中1个
的存在,使晶胞延一个方向拉长。碳化钙晶体中1个 周围距离
周围距离 围成的几何图形为
围成的几何图形为
您最近半年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】化合物E是合成降糖药瑞格列净的重要中间体,其合成路线如下:

(1)化合物E中含氧官能团的名称为___________ 。
(2)化合物A分子中发生 、
、 杂化的碳原子数目之比为
杂化的碳原子数目之比为___________ 。
(3)A→B的反应类型为___________ 。
(4)相同条件下,B的沸点比A的高,其主要原因是___________ 。
(5)B→C的反应中有副产物X(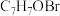 )生成,X的结构简式为
)生成,X的结构简式为___________ 。
(6)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式___________ 。
①分子中含有苯环,且只含有两种不同化学环境的氢原子;
②1mol该物质与NaOH溶液反应,最多消耗4molNaOH。

(1)化合物E中含氧官能团的名称为
(2)化合物A分子中发生
 、
、 杂化的碳原子数目之比为
杂化的碳原子数目之比为(3)A→B的反应类型为
(4)相同条件下,B的沸点比A的高,其主要原因是
(5)B→C的反应中有副产物X(
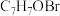 )生成,X的结构简式为
)生成,X的结构简式为(6)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式
①分子中含有苯环,且只含有两种不同化学环境的氢原子;
②1mol该物质与NaOH溶液反应,最多消耗4molNaOH。
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】一定条件下,苯甲酸可实现如下转化:
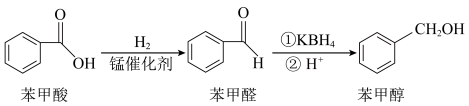
(1)Mn2+基态核外电子排布式为________ 。
(2)B、C、O、K 的第一电离能由小到大的顺序是________ 。
(3)1mol苯甲酸分子含有δ键的数目为________ ,苯甲醇分子中O原子的轨道杂化类型为____ 。
(4)KBH4中所含BH4-离子空间构型为_____ ,写出一种与BH4-互为等电子体的阳离子的化学式:_________ 。
(5)苯甲酸、苯甲醛、苯甲醇三种物质中沸点最低的是____ ,原因是_____________ 。

(1)Mn2+基态核外电子排布式为
(2)B、C、O、K 的第一电离能由小到大的顺序是
(3)1mol苯甲酸分子含有δ键的数目为
(4)KBH4中所含BH4-离子空间构型为
(5)苯甲酸、苯甲醛、苯甲醇三种物质中沸点最低的是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)已知:
分析表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的各自原因是____ 。
②结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时____ 先液化。
(2)SO2与CO2分子的空间结构分别是____ 和___ ,相同条件下两者在水中的溶解度较大的是___ (写分子式),理由是什么?___ 。
(3)醋酸的球棍模型如图1所示。
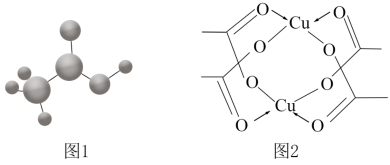
①在醋酸中,碳原子的轨道杂化类型有____ 。
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是___ (填选项字母)。
A.极性键 B.非极性键 C.金属键 D.配位键
(1)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点/K | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度/K | 873 | 773 | 1073 | 713.2 |
分析表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的各自原因是
②结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时
(2)SO2与CO2分子的空间结构分别是
(3)醋酸的球棍模型如图1所示。

①在醋酸中,碳原子的轨道杂化类型有
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是
A.极性键 B.非极性键 C.金属键 D.配位键
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是___________________ 。
(2)①硫单质的一种结构为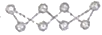 ,杂化方式为
,杂化方式为___________ ,该物质__________ (填“可溶”或“难溶”)于水。
②SO42-、CS2、CO32-键角由大到小的顺序是_____________ 。
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点FeO__________ NiO(填“<”或“>”)
②铁有δ、Υ、ɑ三种同素异形体,各晶胞如下图,则δ、ɑ两种晶胞中铁原子的配位数之比为_________ 。

(4)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O 表示这类特殊晶体的化学式:____________ 。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为_________ 。(用x表示)
③下列有关说法正确的是__________________ 。
A.镧、锰、氧分别位于周期表f、d、P区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
(1)基态硫原子的价层电子排布图是
(2)①硫单质的一种结构为
 ,杂化方式为
,杂化方式为②SO42-、CS2、CO32-键角由大到小的顺序是
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点FeO
②铁有δ、Υ、ɑ三种同素异形体,各晶胞如下图,则δ、ɑ两种晶胞中铁原子的配位数之比为

(4)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O 表示这类特殊晶体的化学式:
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为
③下列有关说法正确的是
A.镧、锰、氧分别位于周期表f、d、P区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D为短周期元素。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。B、C、D三种元素的基态原子具有相同的能层和能级,且第一电离能B<D<C。A位于周期表的s区,其电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;CD2+与BD2互为等电子体。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)E的基态原子的价层电子排布式为______ ,B、C、D三种元素的电负性由小到大的顺序为______ ;
(2)B2A2分子中含有___ 个σ键和___ 个π键;
(3)下列叙述正确的是_________
A.M易溶于水,与M和水分子间可以形成氢键有关;
B.M和CO2分子中的中心原子均采用sp2杂化;
C.N分子中含有6个σ键和6个π键;
D.常见的BD2晶体的熔点、沸点都比二氧化硅晶体的低
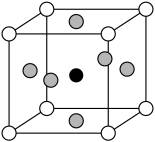
(4)Q是E的一种天然矿物,属于离子化合物,其晶胞结构如图所示,其中E4+位于立方体的顶点,D离子位于立方体的面心,体心是钙离子。则Q的化学式为______ ,每个E4+离子和___ 个D离子相紧邻。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为ECl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为_________ 。
(1)E的基态原子的价层电子排布式为
(2)B2A2分子中含有
(3)下列叙述正确的是
A.M易溶于水,与M和水分子间可以形成氢键有关;
B.M和CO2分子中的中心原子均采用sp2杂化;
C.N分子中含有6个σ键和6个π键;
D.常见的BD2晶体的熔点、沸点都比二氧化硅晶体的低
(4)Q是E的一种天然矿物,属于离子化合物,其晶胞结构如图所示,其中E4+位于立方体的顶点,D离子位于立方体的面心,体心是钙离子。则Q的化学式为

(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为ECl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】2022年北京冬季奥运会场馆建设使用了大量不锈钢材质,不锈钢属于铁碳合金,常含铬(Cr)、镍(Ni)等元素。回答下列问题:
(1)某铁酸盐晶体结构模型如图所示。该晶体的化学式是______ ,在晶体中1个Co原子周围距离最近的O原子数目为______ 个。______ 个,该铁镁合金中原子个数比
______ ;原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为 ,C为
,C为 ,B点坐标参数为
,B点坐标参数为______ . ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体中铬原子的半径为
,则晶体中铬原子的半径为______ cm(用含 的表达式表示)。
的表达式表示)。
(1)某铁酸盐晶体结构模型如图所示。该晶体的化学式是


 ,C为
,C为 ,B点坐标参数为
,B点坐标参数为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体中铬原子的半径为
,则晶体中铬原子的半径为 的表达式表示)。
的表达式表示)。
A.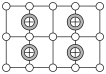 | B. | C. | D. |
您最近半年使用:0次
【推荐1】表中列出了元素周期表中前20号元素中某些元素性质的一些数据:
(1)以上10种元素中,第一电离能最小的是____ (填元素符号),它位于元素周期表的____ 区。
(2)上述⑤⑥⑦三种元素中的任意两种元素形成的化合物中,每个原子都满足8电子稳定结构的物质可能是____ (填分子式)。
(3)元素⑨和⑩形成的化合物的化学式为____ ,该物质的晶体类型是____ 。
(4)①⑥⑦⑩四种元素的气态氢化物的稳定性由强到弱的顺序是____ (填化学式)。
(5)④的单质和⑧的最高价氧化物水化物发生反应的离子反应方程式为____ 。
| 性质元素 | 原子半径/(10-10m) | 最高价态 | 最低价态 |
| ① | 1.02 | +6 | -2 |
| ② | 2.27 | +1 | |
| ③ | 0.74 | -2 | |
| ④ | 1.43 | +3 | |
| ⑤ | 0.77 | +4 | -4 |
| ⑥ | 1.10 | +5 | -3 |
| ⑦ | 0.99 | +7 | -1 |
| ⑧ | 1.86 | +1 | |
| ⑨ | 0.75 | +5 | -3 |
| ⑩ | 1.17 | +4 | -4 |
(2)上述⑤⑥⑦三种元素中的任意两种元素形成的化合物中,每个原子都满足8电子稳定结构的物质可能是
(3)元素⑨和⑩形成的化合物的化学式为
(4)①⑥⑦⑩四种元素的气态氢化物的稳定性由强到弱的顺序是
(5)④的单质和⑧的最高价氧化物水化物发生反应的离子反应方程式为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】磷酸亚铁锂( )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,文献报道可采用
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,文献报道可采用 、LiCl和苯胺等作为原料制备。
、LiCl和苯胺等作为原料制备。
(1)铁元素在元素周期表中的位置是_______ ,其基态原子核外N层电子的自旋状态_______ (填“相同”或“相反”)。
(2) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为_______ ,其中Fe的配位数为_______ 。
(3)苯胺( )的晶体类型是
)的晶体类型是_______ 。苯胺与甲苯的相对分子质量相近,但苯胺的熔点(-5.9℃)高于甲苯的熔点(-95.0℃),原因是_______ 。
 )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,文献报道可采用
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,文献报道可采用 、LiCl和苯胺等作为原料制备。
、LiCl和苯胺等作为原料制备。(1)铁元素在元素周期表中的位置是
(2)
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为(3)苯胺(
 )的晶体类型是
)的晶体类型是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】FeOOH为一种不溶于水的黄色固体。某学校以 废料(含少量
废料(含少量 、FeO等)为原料制备FeOOH,流程如图所示。
、FeO等)为原料制备FeOOH,流程如图所示。

回答以下问题:
(1)为提高“酸浸”的速率,可采取的措施有_______ (填一种即可)。
(2)“废渣”的主要成分可用于_______ (填一种即可)。
(3)“酸浸”时_______ (填“能”或“不能”)使用稀 ,原因是
,原因是_______ 。
(4)“试剂X”可使用_______ (填化学式,填一种即可)。
(5)从“滤液2”中获得晶体的一种方法是:_______ 、过滤、洗涤。
(6)由 转化为FeOOH的离子方程式是
转化为FeOOH的离子方程式是_______ 。
(7)研究晶体性质对工业流程的探究十分重要,该学校的化学社团欲探究A、B、C(均为单质或化合物)三种由H、C、Na、Cl元素组成的晶体。他们对上述物质进行相关实验,数据如下:
根据以上实验数据,填写表格:
 废料(含少量
废料(含少量 、FeO等)为原料制备FeOOH,流程如图所示。
、FeO等)为原料制备FeOOH,流程如图所示。
回答以下问题:
(1)为提高“酸浸”的速率,可采取的措施有
(2)“废渣”的主要成分可用于
(3)“酸浸”时
 ,原因是
,原因是(4)“试剂X”可使用
(5)从“滤液2”中获得晶体的一种方法是:
(6)由
 转化为FeOOH的离子方程式是
转化为FeOOH的离子方程式是(7)研究晶体性质对工业流程的探究十分重要,该学校的化学社团欲探究A、B、C(均为单质或化合物)三种由H、C、Na、Cl元素组成的晶体。他们对上述物质进行相关实验,数据如下:
| 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与 反应 反应 | |
| A | 811 | 较大 | 易溶 | 水溶液或熔融时导电 | 白色沉淀 |
| B | 3550 | 很大 | 不溶 | 不导电 | 不反应 |
| C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
| 化学式 | 晶体类型 | 微粒间作用力 | |
| A | |||
| B | |||
| C |
您最近半年使用:0次



