硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是___________________ 。
(2)①硫单质的一种结构为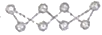 ,杂化方式为
,杂化方式为___________ ,该物质__________ (填“可溶”或“难溶”)于水。
②SO42-、CS2、CO32-键角由大到小的顺序是_____________ 。
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点FeO__________ NiO(填“<”或“>”)
②铁有δ、Υ、ɑ三种同素异形体,各晶胞如下图,则δ、ɑ两种晶胞中铁原子的配位数之比为_________ 。

(4)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O 表示这类特殊晶体的化学式:____________ 。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为_________ 。(用x表示)
③下列有关说法正确的是__________________ 。
A.镧、锰、氧分别位于周期表f、d、P区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
(1)基态硫原子的价层电子排布图是
(2)①硫单质的一种结构为
 ,杂化方式为
,杂化方式为②SO42-、CS2、CO32-键角由大到小的顺序是
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点FeO
②铁有δ、Υ、ɑ三种同素异形体,各晶胞如下图,则δ、ɑ两种晶胞中铁原子的配位数之比为

(4)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O 表示这类特殊晶体的化学式:
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为
③下列有关说法正确的是
A.镧、锰、氧分别位于周期表f、d、P区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
更新时间:2017-11-30 17:51:56
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】硒是典型的半导体材料。
(1)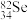 是硒的一种放射性同位素,其中子数与价电子数之差为
是硒的一种放射性同位素,其中子数与价电子数之差为___________ , 、
、 、
、 其沸点从大到小的顺序是
其沸点从大到小的顺序是___________ 。
(2) 是一种无色液体,其分子空间构型是
是一种无色液体,其分子空间构型是___________ (填标号)。
a.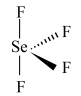 b.
b.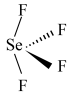 c.
c. d.
d. e.
e.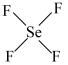
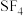 与
与 结构相似,其键角较大的是
结构相似,其键角较大的是___________ 。
(3)锂硒电池正极的充放电原理为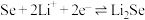
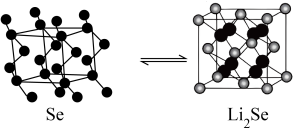
硒晶胞中含有___________ 个 原子,若
原子,若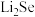 晶胞参数边长为
晶胞参数边长为 ,在
,在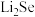 晶胞中2个
晶胞中2个 、
、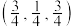 间距离是
间距离是___________  ,
, 填充在
填充在 的
的___________ 型空隙中,充电过程正极材料体积___________ (填“膨胀”、“不变”或“收缩”)
(4) 与
与 可形成直线型阴离子(结构如下),其中
可形成直线型阴离子(结构如下),其中
___________ 。

(1)
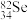 是硒的一种放射性同位素,其中子数与价电子数之差为
是硒的一种放射性同位素,其中子数与价电子数之差为 、
、 、
、 其沸点从大到小的顺序是
其沸点从大到小的顺序是(2)
 是一种无色液体,其分子空间构型是
是一种无色液体,其分子空间构型是a.
 b.
b. c.
c. d.
d. e.
e.
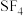 与
与 结构相似,其键角较大的是
结构相似,其键角较大的是(3)锂硒电池正极的充放电原理为
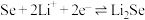

硒晶胞中含有
 原子,若
原子,若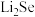 晶胞参数边长为
晶胞参数边长为 ,在
,在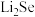 晶胞中2个
晶胞中2个 、
、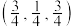 间距离是
间距离是 ,
, 填充在
填充在 的
的(4)
 与
与 可形成直线型阴离子(结构如下),其中
可形成直线型阴离子(结构如下),其中

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】金属锂及其重要化合物广泛应用在尖端科技领域及社会生产生活中。
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co3+核外M层电子排布式为___________ ;基态铁原子中,电子占据的最高能层符号为___________ ;基态磷原子核外能量最高的电子云在空间有___________ 个伸展方向。
(2)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示,这类磷酸根离子的化学式可用通式表示为___________ (用n代表P原子数)。

(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___________ 。LiAIH4中存在___________ (填字母序号)。
A.金属键 B.离子键 C.σ键 D.π键 E.氢键
(4)Li2O是一种白色粉末,常用于特种玻璃、陶瓷、医药等领域。请回答下列问题:
①Li2O具有反萤石结构,其立方晶胞结构如图所示,A表示___________ (填“Li”或“O”),配位数是___________ 。

②若晶胞中M的坐标为(0,0,0),N的坐标为(1,1,1),则P的坐标为___________ 。
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co3+核外M层电子排布式为
(2)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示,这类磷酸根离子的化学式可用通式表示为

(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是
A.金属键 B.离子键 C.σ键 D.π键 E.氢键
(4)Li2O是一种白色粉末,常用于特种玻璃、陶瓷、医药等领域。请回答下列问题:
①Li2O具有反萤石结构,其立方晶胞结构如图所示,A表示

②若晶胞中M的坐标为(0,0,0),N的坐标为(1,1,1),则P的坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】元素C与过渡元素Co、Fe等在工业、农业、科学技术以及人类生活有机合成等方面有重要作用。
(1)基态Co原子价电子轨道排布式为_______ ,第四电离能I4(Co)4(Fe),其原因是_________ 。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为_______ 。
(3)治疗铅中毒可滴注依地酸,使Pb2+转化为依地酸铅盐。如图,下列说法正确的是____ (填序号)。

A.形成依地酸铅离子所需n(Pb2+) :n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)Fe(CO)x常温下是液态,熔点为-20.5℃,沸点为103℃,易容于非极性溶剂,据此可判断Fe(CO)x晶体属于______ (填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=______ 。
(5)Co的一种氧化物的晶胞如图.已知钴原于的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,钴原子填在氧原子的_____ (填“正八面体”“正四面体”或“立方体” )空隙中,在该钴的氧化物晶胞中原子的空间利用率为______ (均用含a、b的计算表达式表示)。

(1)基态Co原子价电子轨道排布式为
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为
(3)治疗铅中毒可滴注依地酸,使Pb2+转化为依地酸铅盐。如图,下列说法正确的是

A.形成依地酸铅离子所需n(Pb2+) :n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)Fe(CO)x常温下是液态,熔点为-20.5℃,沸点为103℃,易容于非极性溶剂,据此可判断Fe(CO)x晶体属于
(5)Co的一种氧化物的晶胞如图.已知钴原于的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,钴原子填在氧原子的

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】I.CP是一种起爆药,化学式为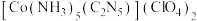 ,CP可由5-氰基四唑(结构简式如下图所示)和
,CP可由5-氰基四唑(结构简式如下图所示)和 反应制备。
反应制备。

(1)Co原子基态电子排布式为___________ ,C、N、O元素的第一电离能由大到小的顺序为___________ 。
(2)5-氰基四唑分子中C原子的杂化类型为___________ ;1 mol 5-氰基四唑分子中含有σ键的数目为___________ 。
(3)在 配合物中
配合物中
①Co3+的配体为___________ (填分子式)。
② 空间构型
空间构型___________ 。
Ⅱ.偏钛酸钡在小型变压器,话筒和扩音器中均有应用,其晶胞结构如图所示,
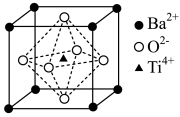
(4)偏钛酸钡的化学式为___________ 。
(5)与Ba2+最近且等距离的O2-为___________ 个。
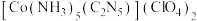 ,CP可由5-氰基四唑(结构简式如下图所示)和
,CP可由5-氰基四唑(结构简式如下图所示)和 反应制备。
反应制备。
(1)Co原子基态电子排布式为
(2)5-氰基四唑分子中C原子的杂化类型为
(3)在
 配合物中
配合物中①Co3+的配体为
②
 空间构型
空间构型Ⅱ.偏钛酸钡在小型变压器,话筒和扩音器中均有应用,其晶胞结构如图所示,

(4)偏钛酸钡的化学式为
(5)与Ba2+最近且等距离的O2-为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
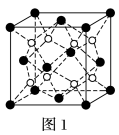
【推荐2】已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2。请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是_______ (填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为_______ (写出1种即可)。
(3)与C同族且位于第四周期元素所形成气态氢化物属于_______ (填“极性”或“非极性”)分子。
(4) F的基态原子核外电子排布式是_______ ,F的单质晶体中, F原子的配位数是_______ 。
(5) E原子的第一电离能比同周期后面相邻元素的第一电离能_______ (填“大”或“小”)。
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为_______ ,已知该晶体的密度为d g•cm-3,其摩尔质量为M g•mol-1,则该晶胞的边长是_______ 。

(1)B、C、D三种元素的电负性由大到小的顺序是
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为
(3)与C同族且位于第四周期元素所形成气态氢化物属于
(4) F的基态原子核外电子排布式是
(5) E原子的第一电离能比同周期后面相邻元素的第一电离能
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。①~⑥表示元素在周期表中的位置,回答下列问题。
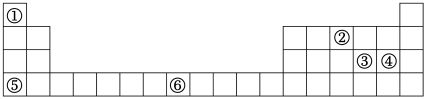
(1)①和④形成的化合物的化学式为_______ 。
(2)②的基态原子的轨道表示式为_______ ,其电子占据的最高能级的电子云轮廓是_______ 。
(3)⑤的基态原子占据的最高能层的符号是_______ ,其基态正一价离子占据的最高能级共有_______ 个原子轨道。
(4)⑥的基态正三价离子的价层电子排布式为_______ 。
(5)下列说法不正确 的是_______ 。
a.②的2px、2py、2pZ轨道互相垂直,但能量相等
b.④的p能级能量一定比s能级的能量高
c.⑥的2s、3s、4s能级的轨道数依次增多
(6)③和⑤形成的化合物的水溶液pH>7,结合离子方程式解释原因_______ 。

(1)①和④形成的化合物的化学式为
(2)②的基态原子的轨道表示式为
(3)⑤的基态原子占据的最高能层的符号是
(4)⑥的基态正三价离子的价层电子排布式为
(5)下列说法
a.②的2px、2py、2pZ轨道互相垂直,但能量相等
b.④的p能级能量一定比s能级的能量高
c.⑥的2s、3s、4s能级的轨道数依次增多
(6)③和⑤形成的化合物的水溶液pH>7,结合离子方程式解释原因
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】下列为几种晶体或晶胞的示意图:


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成晶体的是_______ 。
(2)冰、金刚石、干冰3种晶体的熔点由高到低的顺序为_______ 。晶体硅的结构与金刚石非常相似。金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为_______ (填化学式)。
(3)每个Cu晶胞中实际占有_______ 个 Cu原子,1 mol金刚石中含有C-C单键的数目约是_______ NA。
(4)观察干冰晶胞结构,每个CO2分子周围有_______ 个与之紧邻且等距的CO2分子;金刚石晶体中,碳原子的杂化类型为_______ 。
(5)若干冰分子的摩尔质量为M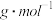 ,晶体的密度为
,晶体的密度为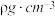 ,阿伏加德罗常数为
,阿伏加德罗常数为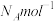 ,则该晶体晶胞的边长为
,则该晶体晶胞的边长为_______ cm。


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成晶体的是
(2)冰、金刚石、干冰3种晶体的熔点由高到低的顺序为
(3)每个Cu晶胞中实际占有
(4)观察干冰晶胞结构,每个CO2分子周围有
(5)若干冰分子的摩尔质量为M
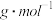 ,晶体的密度为
,晶体的密度为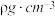 ,阿伏加德罗常数为
,阿伏加德罗常数为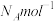 ,则该晶体晶胞的边长为
,则该晶体晶胞的边长为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为_______ ;该晶体中原子之间的作用力是_______ 。
(2)上述晶体具有储氢功能,氢原子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图1)的结构相似,该晶体储氢后的化学式应为_______ 。
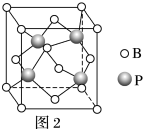
(3)立方BP(磷化硼)的晶胞结构如图2所示,晶胞中含B原子数目为_______ 。
(1)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为
(2)上述晶体具有储氢功能,氢原子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图1)的结构相似,该晶体储氢后的化学式应为

(3)立方BP(磷化硼)的晶胞结构如图2所示,晶胞中含B原子数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。

(1)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有____ 个。
(2)已知食盐晶体的密度为2.2g/cm3,阿伏加德罗常数为6.02×1023mol-1。食盐晶体中两个距离最近的钠离子中心间的距离为________________ cm。计算过程如下:
_________________________________________________________________________________________________________________________________________________________ 。

(1)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有
(2)已知食盐晶体的密度为2.2g/cm3,阿伏加德罗常数为6.02×1023mol-1。食盐晶体中两个距离最近的钠离子中心间的距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、材料等领域。
(1)基态钛原子的价电子排布式为_______ 。
(2)钛可与高于70℃的浓硝酸发生反应,生成 ,其球棍结构如图,Ti的配位数是
,其球棍结构如图,Ti的配位数是_______ ,试写出该反应的方程式_______ 。

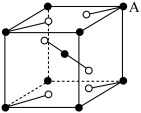
(3)某种晶型的 晶胞如图,A位置的元素为
晶胞如图,A位置的元素为_______ (填元素符号)。
(4) 是由钛精矿(主要成分为
是由钛精矿(主要成分为 制备钛(Ti)的重要中间产物,制备纯
制备钛(Ti)的重要中间产物,制备纯 的流程示意图如图:
的流程示意图如图:

资料: 及所含杂质氯化物的性质
及所含杂质氯化物的性质
 与
与 难以直接反应,加碳生成CO和
难以直接反应,加碳生成CO和 可使反应得以进行。
可使反应得以进行。
已知:

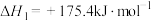
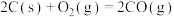
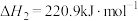
①沸腾炉中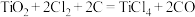 的热化学方程式
的热化学方程式_______ 。
②氯化过程中CO和 可以相互转化,根据如图判断:
可以相互转化,根据如图判断: 生成CO反应的△H
生成CO反应的△H_______ 0(填“>”“<”或“=”),判断依据_______ 。

(1)基态钛原子的价电子排布式为
(2)钛可与高于70℃的浓硝酸发生反应,生成
 ,其球棍结构如图,Ti的配位数是
,其球棍结构如图,Ti的配位数是
(3)某种晶型的
 晶胞如图,A位置的元素为
晶胞如图,A位置的元素为
(4)
 是由钛精矿(主要成分为
是由钛精矿(主要成分为 制备钛(Ti)的重要中间产物,制备纯
制备钛(Ti)的重要中间产物,制备纯 的流程示意图如图:
的流程示意图如图:
资料:
 及所含杂质氯化物的性质
及所含杂质氯化物的性质| 化合物 |  |  |  |  |  |
| 沸点/℃ | 58 | 136 | 81(升华) | 316 | 1412 |
| 熔点/℃ | -69 | -25 | 193 | 304 | 714 |
在 中的溶解性 中的溶解性 | 互溶 | — | 微溶 | 难溶 | |
 与
与 难以直接反应,加碳生成CO和
难以直接反应,加碳生成CO和 可使反应得以进行。
可使反应得以进行。已知:

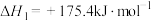
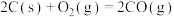
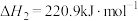
①沸腾炉中
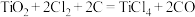 的热化学方程式
的热化学方程式②氯化过程中CO和
 可以相互转化,根据如图判断:
可以相互转化,根据如图判断: 生成CO反应的△H
生成CO反应的△H
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是______________ 。
A. B.
B. C.
C. D.
D.
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_________ 、_________ 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是____________ (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如表所示:
解释MgO熔点比P4O6熔点高得多的原因______________
(4)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)

①碳化硅晶体(金刚砂)的化学式______________
②金刚石、晶体硅、碳化硅的熔点由高到低的顺序为__________________
③立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是_____________ g/cm3(列出式子并化简,阿伏加 德罗常数为NA)
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是
A.
 B.
B. C.
C. D.
D.
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是
(3)一些氧化物的熔点如表所示:
| 氧化物 | Li2O | MgO | P4O6 | SO2 |
| 熔点/°C | 1570 | 2800 | 23.8 | −75.5 |
(4)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)

①碳化硅晶体(金刚砂)的化学式
②金刚石、晶体硅、碳化硅的熔点由高到低的顺序为
③立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】元素及其化合物在生活及生产中有很多重要用途。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)基态碳原子价电子的电子轨道表达式为____ ,第一电离能Ga____ As(填“>”、 “<”、“=”)。
(2)BN和GaAs都是原子晶体,它们的硬度和熔点BN>GaAs,原因是________________ 。
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。 (CN)2分子中氮原子的轨道杂化类型为_____ ,σ 键与 π 键数目之比为_______ ; (SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S),其原因是_________ 。
(4)①卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为_____________ ;②一定条件下(SCN)2可氧化为CO32—和SO32—等离子,其中SO32—的立体构型为_________ 。
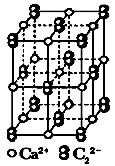
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),CaC2 晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。写出与C22﹣互为等电子体的微粒符号________ 、_______ ;此晶体中 1 个 C22﹣周围距离最近的Ca2+为______ 个;若该晶胞的边长为a、a、b(nm),则该晶体的密度为______ g·cm-3(写出表达式)。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)基态碳原子价电子的电子轨道表达式为
(2)BN和GaAs都是原子晶体,它们的硬度和熔点BN>GaAs,原因是
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。 (CN)2分子中氮原子的轨道杂化类型为
(4)①卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),CaC2 晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。写出与C22﹣互为等电子体的微粒符号

您最近一年使用:0次



