锌锰干电池是很古老的一次性电池,它的生产原料主要有软锰矿和闪锌矿。已知闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分;软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分。科研人员开发了综合利用软锰矿和闪锌矿的同槽酸浸工艺,工艺流程如下图所示。
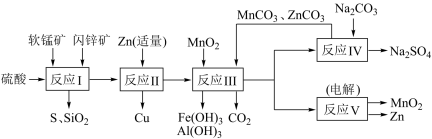
请回答下列问题:
(1)反应I需不断搅拌,目的是____________________________ 。
(2)检验反应I的滤液中含有Fe3+的试剂为____________ ;写出反应I中由FeS生成Fe3+的离子方程式____________________________________ 。
(3)反应Ⅱ加入适量锌的作用是__________________ ;反应III中MnO2的作用是________________ 。
(4)已知ZnCO3、MnCO3的Ksp分别为1.4×10-10、2.2×10-11;要使反应IV之后的溶液中Zn2+、Mn2+浓度均降到1.0×10-6mol/L,则溶液中残留的CO32-浓度至少为__________ mol/L。
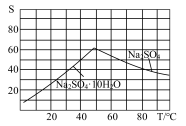
(5)图是Na2SO4和Na2SO4•10H2O的溶解 度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液________ →__________ → 用乙醇洗涤→干燥。用乙醇洗涤而不用水洗的原因是_________________________________________ 。

请回答下列问题:
(1)反应I需不断搅拌,目的是
(2)检验反应I的滤液中含有Fe3+的试剂为
(3)反应Ⅱ加入适量锌的作用是
(4)已知ZnCO3、MnCO3的Ksp分别为1.4×10-10、2.2×10-11;要使反应IV之后的溶液中Zn2+、Mn2+浓度均降到1.0×10-6mol/L,则溶液中残留的CO32-浓度至少为
(5)图是Na2SO4和Na2SO4•10H2O的溶解 度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液

更新时间:2019-02-13 19:34:45
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

(1)A的原子结构示意图为_____________ ,丙的化学式为_____________ 。
(2)金属A、B和气体甲、乙、丙以及物质C、D、E、F中不能导电的有__________________ 、属于电解质的有___________ 。(填“A”“B”“甲”“乙”“丙”“C”“D”“E”“F”)
(3)写出转化①发生的化学方程式:____________________ ,写出转化④发生的离子方程式:____________________ 。
(4)将Na2O2投入到E溶液中,可以观察到的现象是:_____________ 。

(1)A的原子结构示意图为
(2)金属A、B和气体甲、乙、丙以及物质C、D、E、F中不能导电的有
(3)写出转化①发生的化学方程式:
(4)将Na2O2投入到E溶液中,可以观察到的现象是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】七水硫酸亚铁,俗称绿矾,是一种无机化合物,化学式为FeSO4·7H2O,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:____ 、____ 。
(2)根据氧化还原反应原理,某实验小组认为FeSO4中的Fe2+既有还原性又有氧化性,为验证上述说法,设计了如下实验方案,并描述实验现象,完成下列表格:
提供的试剂:锌粒、铁粉、0.1mol·L-1的FeSO4溶液、KSCN溶液、新制氯水
利用上述提供的试剂来探究Fe2+的氧化性和还原性。
(3)探究硫酸亚铁的分解产物。将已脱水的绿矾置于装置A中,打开K1和K2。缓慢通入N2,加热。实验后反应管中残留固体为红色粉末。
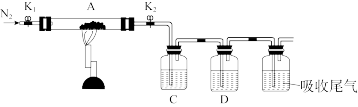
①装置C、D中的溶液分别为BaCl2溶液(足量)和品红溶液。装置C、D中均有气泡冒出,且可观察到的现象分别为____ 、____ ,说明FeSO4的分解产物中既含有SO2又含有SO3。
②写出高温分解硫酸亚铁反应的化学方程式:____ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
(2)根据氧化还原反应原理,某实验小组认为FeSO4中的Fe2+既有还原性又有氧化性,为验证上述说法,设计了如下实验方案,并描述实验现象,完成下列表格:
提供的试剂:锌粒、铁粉、0.1mol·L-1的FeSO4溶液、KSCN溶液、新制氯水
利用上述提供的试剂来探究Fe2+的氧化性和还原性。
| 探究内容 | 实验方案 | 实验现象 |
| Fe2+具有还原性 | 取少量0.1mol·L-1的FeSO4溶液于试管中,加入足量的① | 溶液变红 |
| Fe2+具有氧化性 | 取少量0.1mol·L-1的FeSO4溶液于试管中,加入锌粒充分反应 | ③ |

①装置C、D中的溶液分别为BaCl2溶液(足量)和品红溶液。装置C、D中均有气泡冒出,且可观察到的现象分别为
②写出高温分解硫酸亚铁反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液时需加入少量铁屑,其目的是___________ 。
(2)甲组同学取2mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___________ 。
(3)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:
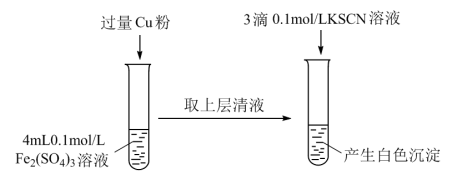
①Fe3+与Cu反应的离子方程式为___________ 。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN一的化学性质与I一相似;
iii.2Cu2++4I—=2CuI↓十I2。
填写实验方案:
Cu2+与SCN一反应的离子方程式为___________ 。
(1)分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液时需加入少量铁屑,其目的是
(2)甲组同学取2mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为
(3)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN一的化学性质与I一相似;
iii.2Cu2++4I—=2CuI↓十I2。
填写实验方案:
| 实验方案 | 现象 |
| 步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1moL/L的KSCN溶液 | 无明显现象 |
| 步骤2:取4mL | 产生白色沉淀 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。
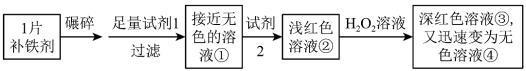
将补铁剂碾碎的目的是增大接触面积,使其充分溶解。
(1)试剂1是_______ ,试剂2是_______ 。
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有_______ 。
(3)能证明溶液①中含有Fe2+的实验现象是_______ 。
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:_______ 。
_______H++_______Fe2++_______H2O2=_______ _______+_______ _______
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是_______ 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是_______ 。
实验Ⅱ.测定该补铁剂中铁元素的含量。

(6)计算每片该补铁剂含铁元素的质量为_______ g。
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是_______ 。
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。

将补铁剂碾碎的目的是增大接触面积,使其充分溶解。
(1)试剂1是
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有
(3)能证明溶液①中含有Fe2+的实验现象是
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:
_______H++_______Fe2++_______H2O2=_______ _______+_______ _______
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是
实验Ⅱ.测定该补铁剂中铁元素的含量。

(6)计算每片该补铁剂含铁元素的质量为
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
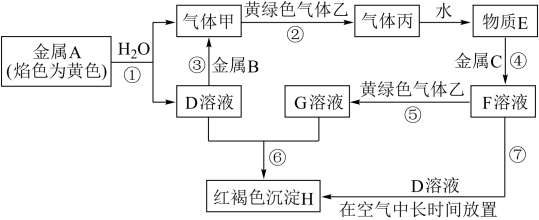
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B______ ,丙______ ,H______ 。
(2)写出实验室制备黄绿色气体乙的化学方程式:______ 。
(3)写出B+D→甲反应的化学方程式:______ 。
(4)D溶液和F溶液在空气中混合的现象:______ 。写出⑦涉及的离子方程式:______ 。
(5)检验物质D中金属阳离子的实验方法名称______ (不要求写具体操作过程),检验物质G中金属阳离子的常用试剂______ (填名称),实验现象为______ 。

请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B
(2)写出实验室制备黄绿色气体乙的化学方程式:
(3)写出B+D→甲反应的化学方程式:
(4)D溶液和F溶液在空气中混合的现象:
(5)检验物质D中金属阳离子的实验方法名称
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】电路板广泛用于计算机、手机等电子产品中。我区某中学化学兴趣小组拟制作带有“COP15”标志的电路板并对铁及其化合物的性质进行探究。
I.制作电路板
兴趣小组同学取一小块覆铜板,用油性笔在铜板上画出“COP15”标志(图1),然后浸入 溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
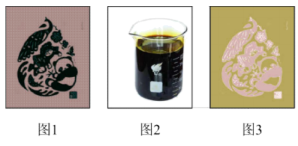
(1)在覆铜板上制作出“COP15”图案过程中发生反应的化学方程式为_______ 。取少量废液于试管中,滴加几滴_______ 溶液(填化学式),溶液出现红色,则废液中含有 。离子反应方程式为
。离子反应方程式为_______ 。
II.探究铁及其化合物的性质
(2)填写下表。
(3)将 溶液酸化后振荡,一段时间溶液变为黄色,写出反应过程的离子方程式
溶液酸化后振荡,一段时间溶液变为黄色,写出反应过程的离子方程式_______ 。
(4)向一定量的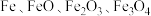 的混合物中加入
的混合物中加入 的盐酸,恰好完全反应,放出
的盐酸,恰好完全反应,放出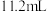 (标准状况)气体,所得溶液无
(标准状况)气体,所得溶液无 。用足量的
。用足量的 在高温下还原相同质量的此混合物,所得铁的质量为
在高温下还原相同质量的此混合物,所得铁的质量为_______ g。
I.制作电路板
兴趣小组同学取一小块覆铜板,用油性笔在铜板上画出“COP15”标志(图1),然后浸入
 溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
(1)在覆铜板上制作出“COP15”图案过程中发生反应的化学方程式为
 。离子反应方程式为
。离子反应方程式为II.探究铁及其化合物的性质
(2)填写下表。
| 实验 | 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
| a | 取少量废液于试管中,加入足量Fe粉 | 铁粉部分溶解,溶液呈浅绿色 | ①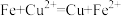 | ② |
| b | 取少量实验a中反应后的上层清液于试管中,滴加几滴氯水 | ③ | 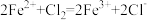 |  具有还原性 具有还原性 |
 溶液酸化后振荡,一段时间溶液变为黄色,写出反应过程的离子方程式
溶液酸化后振荡,一段时间溶液变为黄色,写出反应过程的离子方程式(4)向一定量的
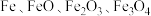 的混合物中加入
的混合物中加入 的盐酸,恰好完全反应,放出
的盐酸,恰好完全反应,放出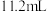 (标准状况)气体,所得溶液无
(标准状况)气体,所得溶液无 。用足量的
。用足量的 在高温下还原相同质量的此混合物,所得铁的质量为
在高温下还原相同质量的此混合物,所得铁的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备ZnO,工艺流程图所示:_________ 。(任写一点)
(2)“除铁”时,加入H2O2发生反应的离子方程式为________ 。如果用NaClO3代替H2O2,恰好完全反应时,理论上消耗n(NaClO3):n(H2O2)=________ 。
(3)常温下,“调pH=5”时,Fe3+的浓度降到了8×10-11mol/L,此时Fe(OH)3的溶度积常数的数值为________ 。
(4)已知三种硫化物的Ksp如表。当溶液中某离子物质的量浓度≤10-5mol/L时视为沉淀完全。假设原溶液中Cu2+、Cd2+、Ni2+的物质的量浓度均为0.1mol/L,则在加Na2S使Cu2+在溶液中的残留浓度为6.3×10-11mol/L时,此时Cd2+的去除率为________ (去除率=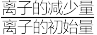 ×100%,不考虑溶液的体积变化)
×100%,不考虑溶液的体积变化)
(5)“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]固体,同时产生大量的气体。该反应的离子方程式为_________ 。
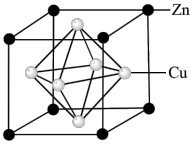
(6)用锌与铜侧得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为anm。________ 个。
②该铜锌合金晶体密度为_________ g•cm-3(设NA为阿伏加德罗常数的值)

(2)“除铁”时,加入H2O2发生反应的离子方程式为
(3)常温下,“调pH=5”时,Fe3+的浓度降到了8×10-11mol/L,此时Fe(OH)3的溶度积常数的数值为
(4)已知三种硫化物的Ksp如表。当溶液中某离子物质的量浓度≤10-5mol/L时视为沉淀完全。假设原溶液中Cu2+、Cd2+、Ni2+的物质的量浓度均为0.1mol/L,则在加Na2S使Cu2+在溶液中的残留浓度为6.3×10-11mol/L时,此时Cd2+的去除率为
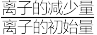 ×100%,不考虑溶液的体积变化)
×100%,不考虑溶液的体积变化)| 物质 | CdS | CuS | NiS |
| Ksp | 8.0×10-27 | 6.3×10-36 | 1.0×10-26 |
(5)“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]固体,同时产生大量的气体。该反应的离子方程式为
(6)用锌与铜侧得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为anm。
②该铜锌合金晶体密度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氨水及铵盐是化学工业的重要原料。回答下列问题:
(1)氨水中各种离子的物质的量的浓度从小到大的顺序是_______ ,其他条件不变,往稀氨水溶液中加入少量蒸馏水,则混合液中水的电离程度_______ (填“增加”“减小”或“不变”)。
(2)常温下向某氨水中缓缓通入 气体,溶液中
气体,溶液中 与
与 的关系如图所示。常温下
的关系如图所示。常温下 的电离平衡常数
的电离平衡常数
_______ (用含有a的代数式表示),温度升高A点的位置可能是_______ (填“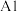 ”或“
”或“ ”),a
”),a_______ (填“>”“<”或“=”)7。

(3)某化学兴趣小组以某废液(主要含有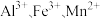 )为原料制取
)为原料制取 的工艺流程及各离子开始沉淀、完全沉淀的
的工艺流程及各离子开始沉淀、完全沉淀的 如图所示(常温下
如图所示(常温下 的
的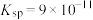 ):
):
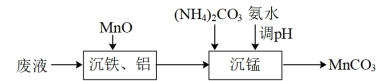
①“沉铁、铝”时反应液的 应控制的范围是
应控制的范围是_______
②“沉锰”时温度不能较高的原因是_______ , 完全沉淀时
完全沉淀时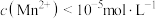 ,则此时溶液中
,则此时溶液中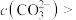
_______  。
。
(1)氨水中各种离子的物质的量的浓度从小到大的顺序是
(2)常温下向某氨水中缓缓通入
 气体,溶液中
气体,溶液中 与
与 的关系如图所示。常温下
的关系如图所示。常温下 的电离平衡常数
的电离平衡常数
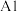 ”或“
”或“ ”),a
”),a
(3)某化学兴趣小组以某废液(主要含有
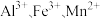 )为原料制取
)为原料制取 的工艺流程及各离子开始沉淀、完全沉淀的
的工艺流程及各离子开始沉淀、完全沉淀的 如图所示(常温下
如图所示(常温下 的
的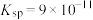 ):
):
| 金属离子 |  |  |  |
开始沉淀 | 2.2 | 4.1 | 8.8 |
完全沉淀 | 3.5 | 5.4 | 10.8 |
 应控制的范围是
应控制的范围是②“沉锰”时温度不能较高的原因是
 完全沉淀时
完全沉淀时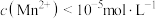 ,则此时溶液中
,则此时溶液中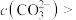
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】I.电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_______ (填序号)
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaClO溶液中通入少量CO2,所发生反应的化学方程式为___________ 。
(3)将相同物质的量浓度的NaClO溶液和Na2CO3溶液等体积混合,各离子浓度关系正确的是___________ (填标号)
a.c(ClO-)>c( )>c(H+) b.c(Na+)=3[c(HClO)+c(ClO-)]
)>c(H+) b.c(Na+)=3[c(HClO)+c(ClO-)]
c.c(H+)=2c( )+c(
)+c( )+c(HClO) d.c(HClO)+c(ClO-)=c(H2CO3)+c(
)+c(HClO) d.c(HClO)+c(ClO-)=c(H2CO3)+c( )
)
II.根据下列化合物:①NaOH②H2SO4③CH3COOH④NaCl⑤CH3COONa⑥(NH4)2SO4⑦CH3COONH4⑧NH4HSO4⑨NH3·H2O⑩NH4Cl,请回答下列问题:
(4)物质的量浓度相同的①NaOH②H2SO4③CH3COOH④NaCl⑤CH3COONa五种稀溶液中,水电离的OH-浓度由大到小的顺序为___________ (填序号)。
(5)物质的量浓度相同的⑥(NH4)2SO4⑦CH3COONH4⑧NH4HSO4⑨NH3·H2O⑩NH4Cl六种稀溶液中, 浓度由小到大的顺序为
浓度由小到大的顺序为___________ (填序号)。
(6)已知t℃时,Kw=1×10-13,在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___________ 。
III.乙二酸(H2C2O4)俗名草酸,是可溶于水的二元弱酸。
(7)利用滴定原理和装置。可以用0.0500mol·L-1酸性KMnO4溶液滴定某菠菜提取液中草酸的含量。原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
①取待测菠菜提取液2mL于锥形瓶中,并将酸性KMnO4标准溶液装入___________ 中备用。
②滴定终点的判断依据是___________ 。
(8)草酸钙能对血液起抗凝作用。已知正常人体血液中Ca2+含量约为2.5×10-3mol·L-1,则理论上c( )最低为
)最低为___________ 时会生成CaC2O4沉淀。[已知Ksp(CaC2O4)=4.0×10-9]
(9)常温下,用0.200mol/LKOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图所示,
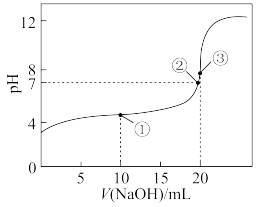
③点所示溶液中:2c( )+2c(
)+2c( )+2c(H2C2O4)=c(K+)。点①所示溶液中混合溶液中离子浓度大小关系为
)+2c(H2C2O4)=c(K+)。点①所示溶液中混合溶液中离子浓度大小关系为___________ 。
| 化学式 | CH3COOH | H2CO3 | HCN | HClO | NH3·H2O |
| 电离常数 | 1.8×10−5 | K1=4.4×10−7 K2=4.7×10−11 | 4.9×10−10 | 3.0×10−8 | 1.8×10−5 |
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaClO溶液中通入少量CO2,所发生反应的化学方程式为
(3)将相同物质的量浓度的NaClO溶液和Na2CO3溶液等体积混合,各离子浓度关系正确的是
a.c(ClO-)>c(
 )>c(H+) b.c(Na+)=3[c(HClO)+c(ClO-)]
)>c(H+) b.c(Na+)=3[c(HClO)+c(ClO-)]c.c(H+)=2c(
 )+c(
)+c( )+c(HClO) d.c(HClO)+c(ClO-)=c(H2CO3)+c(
)+c(HClO) d.c(HClO)+c(ClO-)=c(H2CO3)+c( )
)II.根据下列化合物:①NaOH②H2SO4③CH3COOH④NaCl⑤CH3COONa⑥(NH4)2SO4⑦CH3COONH4⑧NH4HSO4⑨NH3·H2O⑩NH4Cl,请回答下列问题:
(4)物质的量浓度相同的①NaOH②H2SO4③CH3COOH④NaCl⑤CH3COONa五种稀溶液中,水电离的OH-浓度由大到小的顺序为
(5)物质的量浓度相同的⑥(NH4)2SO4⑦CH3COONH4⑧NH4HSO4⑨NH3·H2O⑩NH4Cl六种稀溶液中,
 浓度由小到大的顺序为
浓度由小到大的顺序为(6)已知t℃时,Kw=1×10-13,在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=
III.乙二酸(H2C2O4)俗名草酸,是可溶于水的二元弱酸。
(7)利用滴定原理和装置。可以用0.0500mol·L-1酸性KMnO4溶液滴定某菠菜提取液中草酸的含量。原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
①取待测菠菜提取液2mL于锥形瓶中,并将酸性KMnO4标准溶液装入
②滴定终点的判断依据是
(8)草酸钙能对血液起抗凝作用。已知正常人体血液中Ca2+含量约为2.5×10-3mol·L-1,则理论上c(
 )最低为
)最低为(9)常温下,用0.200mol/LKOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图所示,

③点所示溶液中:2c(
 )+2c(
)+2c( )+2c(H2C2O4)=c(K+)。点①所示溶液中混合溶液中离子浓度大小关系为
)+2c(H2C2O4)=c(K+)。点①所示溶液中混合溶液中离子浓度大小关系为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。回答下列问题:
实验一:利用下图所示装置制取氯酸钾和氯水(加热装置和夹持装置已略去)

(1)仪器a的名称是___________ 。
(2)丙溶液中存在的分子有___________ 种。
(3)甲烧瓶中离子方程式是___________ ,若反应中消耗的固体质量为43.5克,则被氧化的HCl的物质的量为___________ 。
(4)氯气与30%KOH溶液反应生成氯酸钾和氯化钾,温度需控制在70~80℃之间,宜采用的加热方式是___________ ,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(5)若丙中为石灰乳,则制得的漂白粉主要成分是___________ (填化学式)。
实验一:利用下图所示装置制取氯酸钾和氯水(加热装置和夹持装置已略去)

(1)仪器a的名称是
(2)丙溶液中存在的分子有
(3)甲烧瓶中离子方程式是
(4)氯气与30%KOH溶液反应生成氯酸钾和氯化钾,温度需控制在70~80℃之间,宜采用的加热方式是
(5)若丙中为石灰乳,则制得的漂白粉主要成分是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】呋喃甲酸(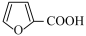 )是一种重要的有机合成中间体。实验室用呋喃甲醛(
)是一种重要的有机合成中间体。实验室用呋喃甲醛( )制备呋喃甲酸,并获得副产品呋喃甲醇。
)制备呋喃甲酸,并获得副产品呋喃甲醇。
I.反应原理: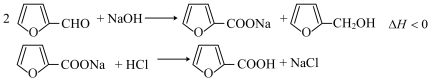
Ⅱ.实验装置: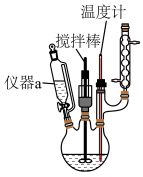
| 物质 | 相对分子质量 | 状态 | 熔点 | 沸点 | 溶解性 |
| 呋喃甲醛 | 96 | 油状液体 | 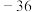 | 161.7 | 微溶于冷水,溶于热水、乙醇、乙醚 |
| 呋喃甲酸 | 112 | 白色晶体 | 130 | 易升华 | 难溶于冷水,易溶于乙醇、乙醚 |
| 呋喃甲醇 | 98 | 液体 |  | 171 | 溶于水,乙醇、乙醚 |
①向三颈烧瓶中加入
 呋喃甲醛,滴加
呋喃甲醛,滴加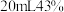 的
的 溶液,充分搅拌,保持反应温度在
溶液,充分搅拌,保持反应温度在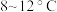 ,持续回流
,持续回流 。
。②冷却后,向三颈烧瓶中加入适量水使其完全溶解。
③将溶液转入分液漏斗中,少量多次加入乙醚萃取,合并乙醚萃取液,得到有机相(乙醚萃取液)和水相。
④向有机相中加入无水硫酸镁固体,再进一步分离乙醚和呋喃甲醇。
⑤向水相中滴加浓盐酸,冷却,结晶,抽滤,洗涤得到粗品
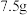 。
。回答下列问题:
(1)仪器a的名称为
A.
 B.
B. C.
C. D.
D.
(2)步骤①中反应温度保持在
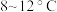 ,温度不宜过低的原因是
,温度不宜过低的原因是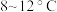 ,应采取的措施为
,应采取的措施为(3)步骤③中少量多次加入乙醚的目的是
(4)步骤④中加入硫酸镁固体的作用是
(5)纯度测定:称取
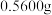 粗产品,配成
粗产品,配成 溶液。量取
溶液。量取 溶液,用
溶液,用 的
的 标准溶液滴定,三次滴定平均消耗
标准溶液滴定,三次滴定平均消耗 的
的 标准溶液。该产品中呋喃甲酸的纯度为
标准溶液。该产品中呋喃甲酸的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用,从钛白水解工业废酸(含Sc3+、TiO2+、Mn2+、H+、SO 等离子)中提取氧化钪(Sc2O3)的一种流程如图:
等离子)中提取氧化钪(Sc2O3)的一种流程如图:

请回答下列问题:
(1)在钛白水解工业废酸中,加入H2O2是为了使TiO2+转化为难萃取的[Ti(O2)(OH)(H2O)4]+,[Ti(O2)(OH)(H2O)4]+中Ti的化合价为________ 。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择的合适O/A值为________ 。

温度对钪、钛的萃取率影响情况见表,合适的萃取温度为10~15 ℃,其理由是_______ 。
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣Ⅰ,写出该反应的离子方程式_______ 。
(4)草酸钪“灼烧”的化学方程式为_______ 。
(5)若该钛白水解废酸中含Sc3+的浓度为16 mg·L-1,从1 m3该废酸中提取得到21.6 g Sc2O3,则钪的提取率为________ (保留两位有效数字)。
 等离子)中提取氧化钪(Sc2O3)的一种流程如图:
等离子)中提取氧化钪(Sc2O3)的一种流程如图:
请回答下列问题:
(1)在钛白水解工业废酸中,加入H2O2是为了使TiO2+转化为难萃取的[Ti(O2)(OH)(H2O)4]+,[Ti(O2)(OH)(H2O)4]+中Ti的化合价为
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择的合适O/A值为

温度对钪、钛的萃取率影响情况见表,合适的萃取温度为10~15 ℃,其理由是
| T/℃ | 5 | 10 | 15 | 25 | 30 |
| 钪的萃取率/% | 91.3 | 96 | 97.1 | 97.3 | 98.0 |
| 钛的萃取率/% | 0.94 | 0.95 | 2.10 | 3.01 | 4.20 |
(4)草酸钪“灼烧”的化学方程式为
(5)若该钛白水解废酸中含Sc3+的浓度为16 mg·L-1,从1 m3该废酸中提取得到21.6 g Sc2O3,则钪的提取率为
您最近一年使用:0次



