工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) CH3OH(1)△H=xkJ/mol
CH3OH(1)△H=xkJ/mol
(1)已知常温下CH3OH(1)、H2和CO的燃烧热分别为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________ ;为提高合成甲醇反应的选择性,关键因素是___________ 。
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g) CH3OH(g)△H<0,相关数据如图。
CH3OH(g)△H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________ mol/(L·min);M和N点的逆反应速率较大的是___________ (填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________ 。
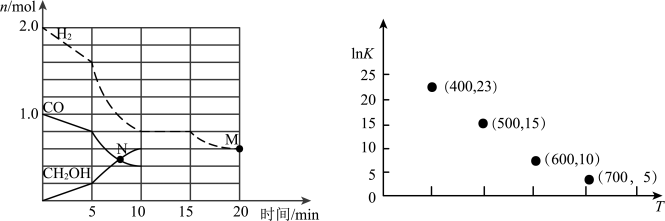
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________ (写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________ 。
CO(g)+2H2(g)
 CH3OH(1)△H=xkJ/mol
CH3OH(1)△H=xkJ/mol(1)已知常温下CH3OH(1)、H2和CO的燃烧热分别为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g)
 CH3OH(g)△H<0,相关数据如图。
CH3OH(g)△H<0,相关数据如图。①该反应0~10min的平均速率υ(H2)
②10min时容器内CO的体积分数为

③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=
更新时间:2019-02-26 17:54:45
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】化学反应过程中释放或吸收的热量在生活、生产、科技及科学研究中具有广泛的应用。
(1)“神舟”系列火箭用偏二甲肼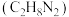 作燃料,
作燃料, 作氧化剂,反应后产物无污染。
作氧化剂,反应后产物无污染。
已知:
反应1:
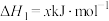 ;
;
反应2: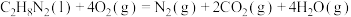
 。
。
写出 和
和 反应生成
反应生成 、
、 、
、 的热化学方程式:
的热化学方程式:_______ 。
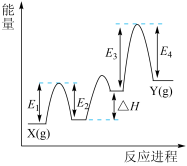
(2)已知某金属氧化物催化丙烷脱氢过程中,部分反应进程如图,则能 过程中的焓变为
过程中的焓变为_______ (列式表示)。
(3)已知,在25℃和101kPa下,部分化学键的键能数据如表所示。
①在25℃和101kPa下,工业合成氨的反应中每生成1mol 就会放出46kJ热量,在该条件下,向某容器中加入2mol
就会放出46kJ热量,在该条件下,向某容器中加入2mol 、6mol
、6mol 及合适的催化剂,充分反应后测得其放出的热量小于92kJ,原因可能是
及合适的催化剂,充分反应后测得其放出的热量小于92kJ,原因可能是_______ ,表中的a=_______ 。
②科学家发现了一种新的气态分子 (
( ),在25℃和101kPa下,
),在25℃和101kPa下,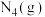 转化为
转化为 的热化学方程式为
的热化学方程式为_______ ,此可知1mol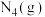 与1mol
与1mol 中能量更低的是
中能量更低的是_______ (填化学式)。
③已知:
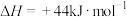 。甲烷是一种常用燃料,则表示甲烷的燃烧热的热化学方程式为
。甲烷是一种常用燃料,则表示甲烷的燃烧热的热化学方程式为_______ 。
(1)“神舟”系列火箭用偏二甲肼
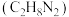 作燃料,
作燃料, 作氧化剂,反应后产物无污染。
作氧化剂,反应后产物无污染。已知:
反应1:
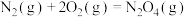
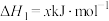 ;
;反应2:
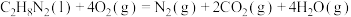
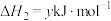 。
。写出
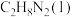 和
和 反应生成
反应生成 、
、 、
、 的热化学方程式:
的热化学方程式:(2)已知某金属氧化物催化丙烷脱氢过程中,部分反应进程如图,则能
 过程中的焓变为
过程中的焓变为
(3)已知,在25℃和101kPa下,部分化学键的键能数据如表所示。
| 化学键 | H—H | H—N | N≡N | O=O | C—H | C=O | H—O | N—N |
键能/( ) ) | 436 | 391 | a | 498 | 414 | 803 | 462 | 193 |
①在25℃和101kPa下,工业合成氨的反应中每生成1mol
 就会放出46kJ热量,在该条件下,向某容器中加入2mol
就会放出46kJ热量,在该条件下,向某容器中加入2mol 、6mol
、6mol 及合适的催化剂,充分反应后测得其放出的热量小于92kJ,原因可能是
及合适的催化剂,充分反应后测得其放出的热量小于92kJ,原因可能是②科学家发现了一种新的气态分子
 (
( ),在25℃和101kPa下,
),在25℃和101kPa下,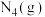 转化为
转化为 的热化学方程式为
的热化学方程式为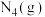 与1mol
与1mol 中能量更低的是
中能量更低的是③已知:

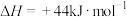 。甲烷是一种常用燃料,则表示甲烷的燃烧热的热化学方程式为
。甲烷是一种常用燃料,则表示甲烷的燃烧热的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】分类思想是化学重要的学科思想。下表是对部分常见的 18 电子微粒的分类。
请结合表格中的微粒(或由微粒组成的物质)完成下列问题:
(1)根据分类时呈现的规律,可推知表格中:①_________ ②_______ (填分子式)
(2)热稳定性:H2S____ SiH4(填“>”、“<”或“=”)还原性:Cl- ___ S2-(填“>”、“<”或“=”)
(3)KHS的电子式为______ , CaO2和 N2H4均含有____ 键(填“离子”、“极性”“非极性'”)
(4)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2)当它们混合时 , 即产 生大量的N2和水蒸气,并放出大量热。已知 0.2mol 液态肼 和足量H2O2反应,生成氮气和水蒸气, 放出 Q kJ 的热量。写出该反应的热化学方程式____ 。
(5)已知拆开 lmolHCl 分子中的化学键需要消耗 431kJ 能量, 根据下面的能量图,回答下列问题:
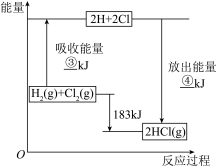
分别写出③、④ 的数值:③______ kJ;④______ kJ。
(6)已知在常温常压下:
2CH3OH(l)+ 3O2(g)=2CO2(g)+4H2O(g) ΔH= -1275.6kJ/mol
H2O(l)= H2O(g) ΔH = + .44.0kJ/mol
写出表示甲醇燃烧热的热化学方程式_______ 。
| 分子 | Ar |
| HCl H2S ① SiH4 | |
| F2 H2O2 N2H4 ② | |
| CH3F CH3OH | |
| 阳离子 | K+ Ca2+ |
| 阴离子 | Cl- S2- |
HS- O |
请结合表格中的微粒(或由微粒组成的物质)完成下列问题:
(1)根据分类时呈现的规律,可推知表格中:①
(2)热稳定性:H2S
(3)KHS的电子式为
(4)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2)当它们混合时 , 即产 生大量的N2和水蒸气,并放出大量热。已知 0.2mol 液态肼 和足量H2O2反应,生成氮气和水蒸气, 放出 Q kJ 的热量。写出该反应的热化学方程式
(5)已知拆开 lmolHCl 分子中的化学键需要消耗 431kJ 能量, 根据下面的能量图,回答下列问题:

分别写出③、④ 的数值:③
(6)已知在常温常压下:
2CH3OH(l)+ 3O2(g)=2CO2(g)+4H2O(g) ΔH= -1275.6kJ/mol
H2O(l)= H2O(g) ΔH = + .44.0kJ/mol
写出表示甲醇燃烧热的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有若重要作用。
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。
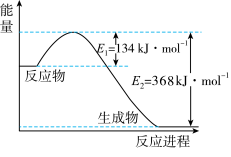
①该反应是___________ (填“吸热”或“放热”)反应。
②请写出反应的热化学方程式___________ 。
③若在反应体系中加入催化剂能使反应热___________ 。(填“增大”、“不变”或"减小")
(2)已知,可逆反应2NO2(g) N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会______ (填“变深”、“不变”或“变浅”),能量发生这种变化的原因是______ 。
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是___________ kJ。
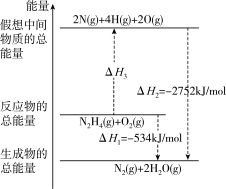
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。

①该反应是
②请写出反应的热化学方程式
③若在反应体系中加入催化剂能使反应热
(2)已知,可逆反应2NO2(g)
 N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】高炉炼铁中发生的反应为:FeO(s)+CO(g) Fe(s)+CO2(g) △H>0。已知t℃时,平衡常数K=0.25。
Fe(s)+CO2(g) △H>0。已知t℃时,平衡常数K=0.25。
(1)温度升高,化学平衡移动后达到新的平衡,平衡常数K_____ (填“增大”、“减小”或“不变”,下同),高炉内CO2和CO的体积比____
(2)t℃时测得高炉中c(CO2)=0.020 mol·Lˉ1,c(CO)=0.1 mol·Lˉ1,在这种情况下,该反应是否处于化学平衡状态_______ (填“是”或“否”),此时,化学反应速率是υ(正)_____ υ(逆)(填“大于”、“小于”或“等于”),其原因是________________
(3)若在1L密闭容器中加入0.02mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______________ 。
(4)如图为t2时刻后改变条件平衡体系中化学反应速率随时间变化的情况,且四个阶段各改变一种条件并且改变的条件均不同。已知,t3~t4阶段为使用催化剂,则t4时刻改变的条件为_____________ ,t5时刻改变的条件为____________

 Fe(s)+CO2(g) △H>0。已知t℃时,平衡常数K=0.25。
Fe(s)+CO2(g) △H>0。已知t℃时,平衡常数K=0.25。 (1)温度升高,化学平衡移动后达到新的平衡,平衡常数K
(2)t℃时测得高炉中c(CO2)=0.020 mol·Lˉ1,c(CO)=0.1 mol·Lˉ1,在这种情况下,该反应是否处于化学平衡状态
(3)若在1L密闭容器中加入0.02mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=
(4)如图为t2时刻后改变条件平衡体系中化学反应速率随时间变化的情况,且四个阶段各改变一种条件并且改变的条件均不同。已知,t3~t4阶段为使用催化剂,则t4时刻改变的条件为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】如图所示:

(1)①该反应是__________ 反应(填“吸热”或“放热”)。
②当反应达到平衡时,升高温度,A的转化率__________ (填“增大”“减小”“不变”)。
③在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1__________ ,E2__________ (填“增大”“减小”“不变”)。
(2)101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,表示H2燃烧热的化学方程式__________ 。

(1)①该反应是
②当反应达到平衡时,升高温度,A的转化率
③在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
(2)101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,表示H2燃烧热的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】在一定体积的密闭容器中,有如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度的关系如表:
(1)该反应的化学平衡常数表达式为K=_______ 。
(2)该反应为_______ 反应(填“吸热”“放热”)。
(3)向上述平衡体系中加入CO2,达新平衡后H2的转化率_______ (选填:“增大”“不变”“减小”)。
(4)反应达平衡后,向容器中通入与平衡混合气组成、比例相同的气体,达到新平衡时与原平衡相比,有关说法正确的是_______ 。
A.反应物转化率增大 B.逆反应速率增大
C.各物质的比例不变 D.c(CO2)增大、c(CO)减小
(5)某温度下,平衡浓度符合:3[c(CO2)·c(H2)]=5[c(CO)·c(H2O)],此温度为_______ ℃。
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)向上述平衡体系中加入CO2,达新平衡后H2的转化率
(4)反应达平衡后,向容器中通入与平衡混合气组成、比例相同的气体,达到新平衡时与原平衡相比,有关说法正确的是
A.反应物转化率增大 B.逆反应速率增大
C.各物质的比例不变 D.c(CO2)增大、c(CO)减小
(5)某温度下,平衡浓度符合:3[c(CO2)·c(H2)]=5[c(CO)·c(H2O)],此温度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】资源化利用碳、氮及其化合物具有重要意义
(1)在太阳能的作用下,缺铁氧化物(如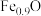 )能催化分解
)能催化分解 ,其过程如图所示.过程①的化学方程式为
,其过程如图所示.过程①的化学方程式为____________ ,过程②能量转化的主要形式为___________ ,

(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应: ,随着温度升高,容器I、II、III中
,随着温度升高,容器I、II、III中 的平衡转化率如图乙所示:
的平衡转化率如图乙所示:

①该反应的
_____ (填“>”或“<”)0.
②若容器I的体积为2L,反应在370℃下进行, 后达到平衡,则0~20s内容器II中用
后达到平衡,则0~20s内容器II中用 表示的反应速率为
表示的反应速率为______ .B点对应的平衡常数
_______ (保留两位有效数字).
③图中A、C、D三点容器内气体密度由大到小的顺序是_________ ;
④若容器Ⅳ体积为1L,反应在370℃下进行,则起始时反应_______ 进行(填“向正反应方向”“向逆反应方向”或“不”).
(1)在太阳能的作用下,缺铁氧化物(如
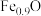 )能催化分解
)能催化分解 ,其过程如图所示.过程①的化学方程式为
,其过程如图所示.过程①的化学方程式为
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:
 ,随着温度升高,容器I、II、III中
,随着温度升高,容器I、II、III中 的平衡转化率如图乙所示:
的平衡转化率如图乙所示:
①该反应的

②若容器I的体积为2L,反应在370℃下进行,
 后达到平衡,则0~20s内容器II中用
后达到平衡,则0~20s内容器II中用 表示的反应速率为
表示的反应速率为
③图中A、C、D三点容器内气体密度由大到小的顺序是
④若容器Ⅳ体积为1L,反应在370℃下进行,则起始时反应
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________ ,表中b_________ c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________ mol·L-1,0~20s内N2O4的平均反应速率为________________ ;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________ (保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________ 。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为
(2)20s时,N2O4的的浓度为
(3)该反应的平衡常数表达式K=
在80℃时该反应的平衡常数K值为:
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】肼(N2H4)与N2O4是火箭发射中最常用的燃料与助燃剂。
(1)800 ℃时,某密闭容器中存在如下反应:2NO2(g) 2NO(g)+O2(g) ΔH>0,若开始向容器中加入1 mol·L-1的NO2,反应过程中NO的产率随时间的变化如图中曲线I所示。
2NO(g)+O2(g) ΔH>0,若开始向容器中加入1 mol·L-1的NO2,反应过程中NO的产率随时间的变化如图中曲线I所示。
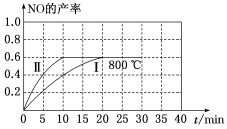
①反应II相对于反应I而言,改变的条件可能是_____ 。
②请在图中绘制出在其他条件与反应I相同,反应在820 ℃时进行,NO的产率随时间的变化曲线_____ 。
(2)已知N2O4(g) 2NO2(g) ΔH=+57.20 kJ·mol-1,开始时,将一定量的NO2、N2O4充入一个容器为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) ΔH=+57.20 kJ·mol-1,开始时,将一定量的NO2、N2O4充入一个容器为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
①c(X)代表___________ (填化学式)的浓度。
②前10 min内用NO2表示的反应速率为___________ ;20 min时改变的条件是___________ ;重新达到平衡时,NO2的百分含量___________ (填字母)。
a.增大 b.减小 c.不变 d.无法判断
(1)800 ℃时,某密闭容器中存在如下反应:2NO2(g)
 2NO(g)+O2(g) ΔH>0,若开始向容器中加入1 mol·L-1的NO2,反应过程中NO的产率随时间的变化如图中曲线I所示。
2NO(g)+O2(g) ΔH>0,若开始向容器中加入1 mol·L-1的NO2,反应过程中NO的产率随时间的变化如图中曲线I所示。
①反应II相对于反应I而言,改变的条件可能是
②请在图中绘制出在其他条件与反应I相同,反应在820 ℃时进行,NO的产率随时间的变化曲线
(2)已知N2O4(g)
 2NO2(g) ΔH=+57.20 kJ·mol-1,开始时,将一定量的NO2、N2O4充入一个容器为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) ΔH=+57.20 kJ·mol-1,开始时,将一定量的NO2、N2O4充入一个容器为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol·L-1) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol·L-1) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10 min内用NO2表示的反应速率为
a.增大 b.减小 c.不变 d.无法判断
您最近一年使用:0次



