氯化亚铜(CuC1)在化工、印染、电镀等行业应用广泛。CuCl微溶于水,不溶于醇和稀酸,可溶于Cl-浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuC1的工艺过程如图所示:
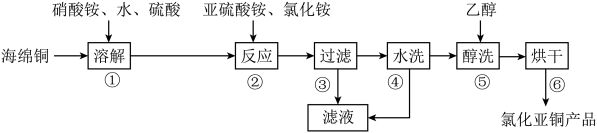
回答下列问题:
(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式___________ 。
(2)步骤②中,亚硫酸铵要略保持过量,原因是___________ ,滤液中可循环利用的物质是___________ 。
(3)步骤⑤中,醇洗的目的是______________________ 。
(4)常用K2Cr2O7溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品10.00g,将其置于过量的FeCl2溶液中,待样品完全溶解后,加入适量稀硫酸配成100mL溶液,取溶液10.00mL用0.1000mol·L K2Cr2O7溶液进行滴定,反应中Cr2O72-被还原成Cr3+,相关数据记录如下表所示:
该样品中CuCl的质量分数___________ 。(保留4位有效数字)
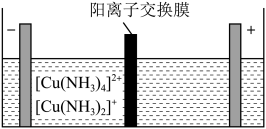
(5)制造印刷电路板产生的废液中含大量[Cu(NH3)4]2+等离子,利用膜电解技术对此废液进行电解,电解装置如下图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到CuCl,电解时阴极的电极反应式为___________ ,生成CuCl的离子方程式为______________________ 。

回答下列问题:
(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式
(2)步骤②中,亚硫酸铵要略保持过量,原因是
(3)步骤⑤中,醇洗的目的是
(4)常用K2Cr2O7溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品10.00g,将其置于过量的FeCl2溶液中,待样品完全溶解后,加入适量稀硫酸配成100mL溶液,取溶液10.00mL用0.1000mol·L K2Cr2O7溶液进行滴定,反应中Cr2O72-被还原成Cr3+,相关数据记录如下表所示:
| 实验编号 | 1 | 2 | 3 |
| 消耗K2Cr2O7溶液的体积/mL | 14.98 | 16.03 | 15.02 |
(5)制造印刷电路板产生的废液中含大量[Cu(NH3)4]2+等离子,利用膜电解技术对此废液进行电解,电解装置如下图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到CuCl,电解时阴极的电极反应式为

更新时间:2019-03-03 20:24:33
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】某地出产的矿石A可看作由主要成分硅酸铜盐 (摩尔质量=406
(摩尔质量=406 )与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液I和II中滴入KSCN溶液,前者无现象,后者显血红色。所有数据均已折算为标准状况。
)与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液I和II中滴入KSCN溶液,前者无现象,后者显血红色。所有数据均已折算为标准状况。

请回答:
(1)写出Y中除氧以外的元素符号_______ ,X的化学式为_______ 。
(2)写出溶液I中加入适量的 发生的离子方程式
发生的离子方程式_______ 。
(3)如果往溶液II中继续加入 ,发现有气泡产生,有观点认为:
,发现有气泡产生,有观点认为:
①是Y中的某元素离子将 氧化所致,
氧化所致,
②是_______ 。
(4)已知无色无味的气体为混合物且含有相同的元素,现对溶液II进行一系列分离提纯(元素化合价保持不变),可得到某金属元素的氧化物Z 4.0g,写出杂质Y与盐酸反应的化学方程式_______ 。
(5)将Z与 、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成
、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成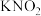 。该反应中的氧化剂和还原剂的物质的量之比
。该反应中的氧化剂和还原剂的物质的量之比_______ 。
 (摩尔质量=406
(摩尔质量=406 )与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液I和II中滴入KSCN溶液,前者无现象,后者显血红色。所有数据均已折算为标准状况。
)与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液I和II中滴入KSCN溶液,前者无现象,后者显血红色。所有数据均已折算为标准状况。
请回答:
(1)写出Y中除氧以外的元素符号
(2)写出溶液I中加入适量的
 发生的离子方程式
发生的离子方程式(3)如果往溶液II中继续加入
 ,发现有气泡产生,有观点认为:
,发现有气泡产生,有观点认为:①是Y中的某元素离子将
 氧化所致,
氧化所致,②是
(4)已知无色无味的气体为混合物且含有相同的元素,现对溶液II进行一系列分离提纯(元素化合价保持不变),可得到某金属元素的氧化物Z 4.0g,写出杂质Y与盐酸反应的化学方程式
(5)将Z与
 、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成
、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成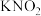 。该反应中的氧化剂和还原剂的物质的量之比
。该反应中的氧化剂和还原剂的物质的量之比
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氟是一种卤族元素,但它与其他卤素在单质和化合物的制备与性质上存在较明显的差异。
(1)研究发现, 能将
能将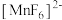 的盐转化为
的盐转化为 转化成稳定离子
转化成稳定离子 的盐。而
的盐。而 很不稳定,受热易分解为
很不稳定,受热易分解为 和
和 。根据以上研究写出以
。根据以上研究写出以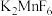 和
和 为原料,在
为原料,在 的温度下制备
的温度下制备 的化学方程式:
的化学方程式:___________ 。
(2)现代工业以电解熔融的氟氢化钾 和氟化氢
和氟化氢 混合物制备氟单质,电解制氟装置如图所示。
混合物制备氟单质,电解制氟装置如图所示。

①已知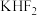 是一种酸式盐,写出阴极_上发生的电极反应式:
是一种酸式盐,写出阴极_上发生的电极反应式:___________ 。
②电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是___________ 。
③已知 时,氢氟酸
时,氢氟酸 的电离平衡常数
的电离平衡常数 。某
。某 的氢氟酸溶液中,由水电离出的
的氢氟酸溶液中,由水电离出的
___________  ;若将
;若将 溶液与
溶液与 的
的 溶液等体积混合,则溶液中离子浓度大小关系为
溶液等体积混合,则溶液中离子浓度大小关系为___________ 。
(3)已知 时,
时, ,此温度下,若实验室中配制
,此温度下,若实验室中配制 溶液,为使配制过程中不出现浑浊,则至少需要加
溶液,为使配制过程中不出现浑浊,则至少需要加 的硫酸
的硫酸___________  (忽略加入硫酸的体积)。
(忽略加入硫酸的体积)。
(1)研究发现,
 能将
能将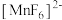 的盐转化为
的盐转化为 转化成稳定离子
转化成稳定离子 的盐。而
的盐。而 很不稳定,受热易分解为
很不稳定,受热易分解为 和
和 。根据以上研究写出以
。根据以上研究写出以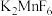 和
和 为原料,在
为原料,在 的温度下制备
的温度下制备 的化学方程式:
的化学方程式:(2)现代工业以电解熔融的氟氢化钾
 和氟化氢
和氟化氢 混合物制备氟单质,电解制氟装置如图所示。
混合物制备氟单质,电解制氟装置如图所示。
①已知
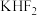 是一种酸式盐,写出阴极_上发生的电极反应式:
是一种酸式盐,写出阴极_上发生的电极反应式:②电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是
③已知
 时,氢氟酸
时,氢氟酸 的电离平衡常数
的电离平衡常数 。某
。某 的氢氟酸溶液中,由水电离出的
的氢氟酸溶液中,由水电离出的
 ;若将
;若将 溶液与
溶液与 的
的 溶液等体积混合,则溶液中离子浓度大小关系为
溶液等体积混合,则溶液中离子浓度大小关系为(3)已知
 时,
时, ,此温度下,若实验室中配制
,此温度下,若实验室中配制 溶液,为使配制过程中不出现浑浊,则至少需要加
溶液,为使配制过程中不出现浑浊,则至少需要加 的硫酸
的硫酸 (忽略加入硫酸的体积)。
(忽略加入硫酸的体积)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】CoO可用于制取催化剂,可以由含钴废料(主要成分为Co2O3,还含有少量SiO2、Fe2O3、Al2O3 和MgO)经过如下过程进行制取:
①写出“浸取”时Co2O3所发生反应的离子方程式:___________ 。
②“浸取”时含钴废料、硫酸和Na2SO3溶液混合的方式为___________ 。
(2)已知:
①氧化性Co3+>H2O2;
②Ksp(MgF2)=6.4×10-11;CoF2可溶于水;Fe3+、Al3+与F-可生成配合物难以沉淀;
③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的pH如下表所示:
补充完整由“浸取液”制取CoC2O4·2H2O的实验方案:取一定量的浸取液,___________ ,过滤,向滤液中滴加2 mol·L-1 (NH4)2C2O4溶液……得到CoC2O4·2H2O晶体(实验中须使用的试剂:2 mol·L-1的氨水、5%的H2O2溶液、K3[Fe(CN)6]溶液、1 mol·L-1的NH4F溶液)。
(3)已知:Ksp(CoC2O4)=4×10-8、Ka1(H2C2O4)=5×10-2、Ka2(H2C2O4)=5×10-5。
①反应Co2++H2C2O4 CoC2O4↓+2H+的平衡常数为
CoC2O4↓+2H+的平衡常数为___________ 。
②制取CoC2O4·2H2O时使用(NH4)2C2O4溶液而不是Na2C2O4溶液的原因是___________ 。
(4)为测定草酸钴样品的纯度,进行如下实验:
①取草酸钴样品3.000 g,加入100.00 mL 0.100 0 mol·L-1酸性KMnO4溶液,加热充分反应至不再有CO2气体产生(该条件下Co2+不被氧化,杂质不参与反应)。
②将溶液冷却,加水稀释定容至250 mL。
③取25.00 mL溶液,用0.100 0 mol·L-1 FeSO4溶液滴定过量的KMnO4,恰好完全反应时消耗18.00 mL FeSO4溶液。计算样品中CoC2O4·2H2O的质量分数,并写出计算过程___________ 。[已知:M(CoC2O4·2H2O)=183]

①写出“浸取”时Co2O3所发生反应的离子方程式:
②“浸取”时含钴废料、硫酸和Na2SO3溶液混合的方式为
(2)已知:
①氧化性Co3+>H2O2;
②Ksp(MgF2)=6.4×10-11;CoF2可溶于水;Fe3+、Al3+与F-可生成配合物难以沉淀;
③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Co2+ | Mg2+ | |
| 开始沉淀pH | 1.9 | 3.4 | 6.9 | 6.6 | 9.1 |
| 沉淀完全pH | 3.2 | 4.7 | 8.9 | 9.2 | 11.1 |
(3)已知:Ksp(CoC2O4)=4×10-8、Ka1(H2C2O4)=5×10-2、Ka2(H2C2O4)=5×10-5。
①反应Co2++H2C2O4
 CoC2O4↓+2H+的平衡常数为
CoC2O4↓+2H+的平衡常数为②制取CoC2O4·2H2O时使用(NH4)2C2O4溶液而不是Na2C2O4溶液的原因是
(4)为测定草酸钴样品的纯度,进行如下实验:
①取草酸钴样品3.000 g,加入100.00 mL 0.100 0 mol·L-1酸性KMnO4溶液,加热充分反应至不再有CO2气体产生(该条件下Co2+不被氧化,杂质不参与反应)。
②将溶液冷却,加水稀释定容至250 mL。
③取25.00 mL溶液,用0.100 0 mol·L-1 FeSO4溶液滴定过量的KMnO4,恰好完全反应时消耗18.00 mL FeSO4溶液。计算样品中CoC2O4·2H2O的质量分数,并写出计算过程
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】从铜氨废液{含[Cu(NH3)3•CO]+、[Cu(NH3)2]+、[Cu(NH3)4]2+、NH3、CH3COO-、CO 等}中回收铜的工艺流程如图。
等}中回收铜的工艺流程如图。
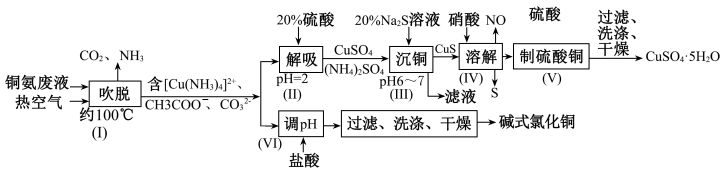
(1)步骤(I)“吹脱”的目的是____ 。(写一条即可);由步骤(II)可确定NH3与H+的结合能力比与Cu2+的____ (填“强”或“弱)。
(2)步骤(III)“沉铜”时,Na2S的用量比理论用量多,目的是____ 。
(3)步骤(IV)反应中,氧化产物与还原产物的物质的量之比为____ 。
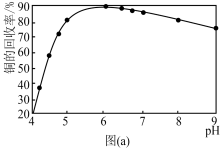
(4)步骤(VI)发生反应生成难溶Cu2(OH)3Cl的离子方程式为____ ,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为____ 。
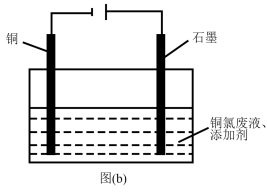
(5)“吹脱”后的铜氨废液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生反应的电极反应式为____ ;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率。从环境角度考虑,较好的是____ (填“NaCl”或“H2SO4”)。
 等}中回收铜的工艺流程如图。
等}中回收铜的工艺流程如图。
(1)步骤(I)“吹脱”的目的是
(2)步骤(III)“沉铜”时,Na2S的用量比理论用量多,目的是
(3)步骤(IV)反应中,氧化产物与还原产物的物质的量之比为
(4)步骤(VI)发生反应生成难溶Cu2(OH)3Cl的离子方程式为

(5)“吹脱”后的铜氨废液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生反应的电极反应式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】在未来能源领域-“人造太阳”计划中,磷酸二氢钾( )有重要作用,以氯磷灰石(主要成分为
)有重要作用,以氯磷灰石(主要成分为 ,还含有少量
,还含有少量 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:

已知:①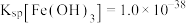
② 与
与 均难溶于水,
均难溶于水, 能溶于水。
能溶于水。
(1)“酸浸”时发生的化学反应为 (浓)
(浓) ,该反应体现了浓硫酸的
,该反应体现了浓硫酸的_______ 性和_______ 性。可提高酸浸反应速率的措施有_______ 。(写其中一条即可)
(2)反应Ⅱ的化学方程式为_______ 。
(3)滤渣的成分为_______ ,若c(离子) mol⋅L
mol⋅L 时表明沉淀完全,计算
时表明沉淀完全,计算 完全沉淀时的
完全沉淀时的
_______ 。
(4)以熔融碳酸钠燃料电池(图1)为电源, 可通过图2装置电解制备:
可通过图2装置电解制备:
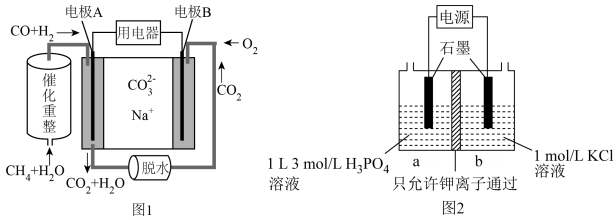
①燃料电池(图1)中电极A上 参与的电极反应式为
参与的电极反应式为_______ 。
②电解池中若通电前a、b两室溶液的质量相等,若有 个
个 通过交换膜,则两室溶液的质量差为
通过交换膜,则两室溶液的质量差为_______ g。
 )有重要作用,以氯磷灰石(主要成分为
)有重要作用,以氯磷灰石(主要成分为 ,还含有少量
,还含有少量 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
已知:①
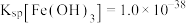
②
 与
与 均难溶于水,
均难溶于水, 能溶于水。
能溶于水。(1)“酸浸”时发生的化学反应为
 (浓)
(浓) ,该反应体现了浓硫酸的
,该反应体现了浓硫酸的(2)反应Ⅱ的化学方程式为
(3)滤渣的成分为
 mol⋅L
mol⋅L 时表明沉淀完全,计算
时表明沉淀完全,计算 完全沉淀时的
完全沉淀时的
(4)以熔融碳酸钠燃料电池(图1)为电源,
 可通过图2装置电解制备:
可通过图2装置电解制备:
①燃料电池(图1)中电极A上
 参与的电极反应式为
参与的电极反应式为②电解池中若通电前a、b两室溶液的质量相等,若有
 个
个 通过交换膜,则两室溶液的质量差为
通过交换膜,则两室溶液的质量差为
您最近一年使用:0次
【推荐3】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①写出氯化钠电解槽内发生反应的离子方程式:________________________ 。
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目:_____________ 。
(2)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:


请回答下列问题:
Pt(a)电极是电池的_______ 极,电极反应式为______________________ ;
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________________ 。
(1)ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①写出氯化钠电解槽内发生反应的离子方程式:
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目:
(2)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:


请回答下列问题:
Pt(a)电极是电池的
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】钌( )为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下:
)为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下:

(1)加碱浸取时,为提高钌的浸出率可采取的措施有_______ (任写两点)。
(2)操作X的名称为_______ 。
(3)“研磨预处理”是将研磨后的含钌废料在氢气还原炉中还原为单质钌,再进行“碱浸”获得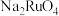 ,写出“碱浸”时生成
,写出“碱浸”时生成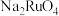 的离子方程式:
的离子方程式:_______ 。
(4)“滤渣”的主要成分为 ,加入草酸的作用是
,加入草酸的作用是_______ ,金属钌与草酸的质量比x和反应温度T对钌的回收率的影响如图所示,则回收钌较为适宜的条件是_______ 。

在酸性介质中,若使用 溶液代替草酸,可获得
溶液代替草酸,可获得 ,则反应中氧化剂和还原剂的物质的量之比为
,则反应中氧化剂和还原剂的物质的量之比为_______ 。
(5)“一系列操作”为_______ ,写出在“还原炉”中还原制得钌的化学方程式:_______ 。
 )为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下:
)为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下:
(1)加碱浸取时,为提高钌的浸出率可采取的措施有
(2)操作X的名称为
(3)“研磨预处理”是将研磨后的含钌废料在氢气还原炉中还原为单质钌,再进行“碱浸”获得
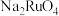 ,写出“碱浸”时生成
,写出“碱浸”时生成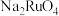 的离子方程式:
的离子方程式:(4)“滤渣”的主要成分为
 ,加入草酸的作用是
,加入草酸的作用是
在酸性介质中,若使用
 溶液代替草酸,可获得
溶液代替草酸,可获得 ,则反应中氧化剂和还原剂的物质的量之比为
,则反应中氧化剂和还原剂的物质的量之比为(5)“一系列操作”为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】钴酸锂电池广泛应用于笔记本电脑、手机等小型电子设备中。工业通过处理废旧钴酸锂电池正极材料(主要成分为LiCoO2,含少量金属Cu等)回收Co和Li。
(1)废电池预处理
钴酸锂电池工作时发生反应:LixC6+Li1-xCoO2 C6+LiCoO2将废旧钴酸锂电池在盐水中浸泡,使电池充分放电。该处理过程既可以保障后续操作的安全性,还可以达到
C6+LiCoO2将废旧钴酸锂电池在盐水中浸泡,使电池充分放电。该处理过程既可以保障后续操作的安全性,还可以达到___ 的目的。
(2)酸浸正极材料
①将预处理后的正极材料粉碎,加入3mol·L-1硫酸和30%H2O2的混合溶液。写出酸浸时生成Li2SO4和CoSO4的化学方程式:___ 。
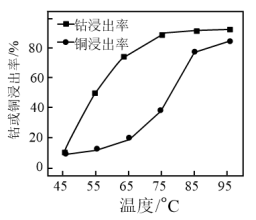
②其他条件相同,浸泡1h,不同温度下钴或铜的浸出率如图所示。从75℃~85℃,铜浸出率增大的幅度明显高于65℃~75℃增大的幅度,原因是___ 。
(3)沉钴,回收Co(OH)2
向0.100mol·L-1CoSO4溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH)2沉淀。继续滴加NaOH溶液至pH=___ 时,Co2+沉淀完全[c(Co2+)≤10-5mol·L-1]。
(4)测定Co(OH)2的含量
Co(OH)2在空气中易被氧化为CoOOH。在稀硫酸中加入0.1000gCo(OH)2样品,待样品完全溶解后加入1.000gKI固体。充分反应后,调节溶液pH=3~4。以淀粉作指示剂,用0.01000mol·L-1Na2S2O3标准溶液滴定至中点,消耗标准溶液25.00mL。
已知:Co3++I-→Co2++I2(未配平);I2+S2O →I-+S4O
→I-+S4O (未配平)
(未配平)
计算样品中Co(OH)2的质量分数(写出计算过程)___ 。
(1)废电池预处理
钴酸锂电池工作时发生反应:LixC6+Li1-xCoO2
 C6+LiCoO2将废旧钴酸锂电池在盐水中浸泡,使电池充分放电。该处理过程既可以保障后续操作的安全性,还可以达到
C6+LiCoO2将废旧钴酸锂电池在盐水中浸泡,使电池充分放电。该处理过程既可以保障后续操作的安全性,还可以达到(2)酸浸正极材料
①将预处理后的正极材料粉碎,加入3mol·L-1硫酸和30%H2O2的混合溶液。写出酸浸时生成Li2SO4和CoSO4的化学方程式:
②其他条件相同,浸泡1h,不同温度下钴或铜的浸出率如图所示。从75℃~85℃,铜浸出率增大的幅度明显高于65℃~75℃增大的幅度,原因是

(3)沉钴,回收Co(OH)2
向0.100mol·L-1CoSO4溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH)2沉淀。继续滴加NaOH溶液至pH=
(4)测定Co(OH)2的含量
Co(OH)2在空气中易被氧化为CoOOH。在稀硫酸中加入0.1000gCo(OH)2样品,待样品完全溶解后加入1.000gKI固体。充分反应后,调节溶液pH=3~4。以淀粉作指示剂,用0.01000mol·L-1Na2S2O3标准溶液滴定至中点,消耗标准溶液25.00mL。
已知:Co3++I-→Co2++I2(未配平);I2+S2O
 →I-+S4O
→I-+S4O (未配平)
(未配平)计算样品中Co(OH)2的质量分数(写出计算过程)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
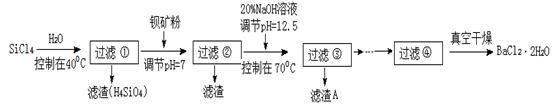
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为_________________________________________________ 。过滤操作需要的玻璃仪器有_________________________________ 。
(2)加钡矿粉调节pH=7的作用是________________________ 、_______________________ 。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________ 。
(4)BaCl2滤液经__________ 、_________ 、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_________ 吨。实际产量为9.70吨,相对误差为__________________ %。

已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为
(2)加钡矿粉调节pH=7的作用是
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
(4)BaCl2滤液经
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O
您最近一年使用:0次
【推荐1】磷酸亚铁锂(LiFePO4)是生产锂电池的重要材料。实验室中用下图装置制备LiFePO4:在仪器A中加入40mL蒸馏水、少量抗坏血酸,再加入0.01molH3PO4和0.01molFeSO4·7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH·H2O,继续搅拌5min。快速将反应液装入反应釜中,保持170℃恒温5h。
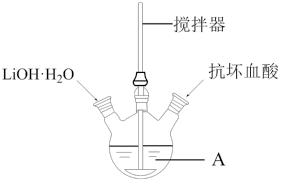
(1)仪器A的名称是_______ ;实验所用蒸馏水若未经煮沸直接使用,则可能发生反应的离子方程式为_______ 。
(2)实验中可用Na2SO3代替抗坏血酸,其原理是_______ (用离子方程式表示);不能用铁粉代替抗坏血酸的原因是_______ 。
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是将反应液冷却至室温,_______ 、用蒸馏水洗涤沉淀、_______ 。
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是_______ 。
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率为_______ %(保留小数点后1位)。

(1)仪器A的名称是
(2)实验中可用Na2SO3代替抗坏血酸,其原理是
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是将反应液冷却至室温,
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]。

已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)尾气吸收
由于加入的铁粉不纯,反应过程中会产生少量PH3气体,故需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu,则该反应的化学方程式为____ 。
(2)药品用量
将0.7g铁粉、10mL1mol·L-1H2SO4溶液加入烧瓶中反应。采取上述原料配比除铁粉不纯外,主要原因是___ 。
(3)制备(NH4)2Fe(SO4)2·6H2O
先制备FeSO4溶液:保持温度在70℃~80℃之间,至反应无明显气泡产生后,停止加热,趁热过滤,称量残余固体质量。向FeSO4溶液中加入一定质量的(NH4)2SO4固体,在70℃~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为____ 。
(4)产品检验
请补充完整测定产品中SO 含量的实验方案:准确称取0.4g样品,将样品溶于70mL水中,加入2mol·L-1的HCl溶液酸化,
含量的实验方案:准确称取0.4g样品,将样品溶于70mL水中,加入2mol·L-1的HCl溶液酸化,___ ,将沉淀移入坩埚,灼烧至恒重称量,记录数据。
(5)已知酸性高锰酸钾溶液可与Fe2+发生氧化还原反应。现称取4.198g(NH4)2Fe(SO4)2·6H2O产品(杂质只有FeSO4·7H2O)溶于稀硫酸中,然后用0.10mol·L-1的高锰酸钾溶液滴定,达到终点时消耗了22.00mL高锰酸钾溶液。
①滴定终点时的现象是____ 。
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为(结果保留四位有效数字)____ 。

已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)尾气吸收
由于加入的铁粉不纯,反应过程中会产生少量PH3气体,故需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu,则该反应的化学方程式为
(2)药品用量
将0.7g铁粉、10mL1mol·L-1H2SO4溶液加入烧瓶中反应。采取上述原料配比除铁粉不纯外,主要原因是
(3)制备(NH4)2Fe(SO4)2·6H2O
先制备FeSO4溶液:保持温度在70℃~80℃之间,至反应无明显气泡产生后,停止加热,趁热过滤,称量残余固体质量。向FeSO4溶液中加入一定质量的(NH4)2SO4固体,在70℃~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为
(4)产品检验
请补充完整测定产品中SO
 含量的实验方案:准确称取0.4g样品,将样品溶于70mL水中,加入2mol·L-1的HCl溶液酸化,
含量的实验方案:准确称取0.4g样品,将样品溶于70mL水中,加入2mol·L-1的HCl溶液酸化,(5)已知酸性高锰酸钾溶液可与Fe2+发生氧化还原反应。现称取4.198g(NH4)2Fe(SO4)2·6H2O产品(杂质只有FeSO4·7H2O)溶于稀硫酸中,然后用0.10mol·L-1的高锰酸钾溶液滴定,达到终点时消耗了22.00mL高锰酸钾溶液。
①滴定终点时的现象是
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为(结果保留四位有效数字)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
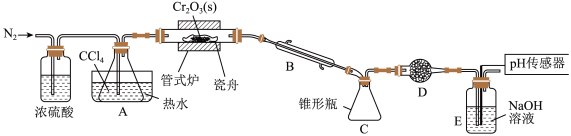
【推荐3】三氯化铬是有机金属化学中的重要原料,为紫色晶体,熔点为83 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到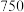 ℃时可制取
℃时可制取 ,同时还生成
,同时还生成 ,其装置图如下
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
已知: 沸点
沸点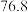 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。
Ⅰ.制备 :
:
(1)仪器 的名称是
的名称是______ 。
(2)装置 、
、 的作用分别是
的作用分别是______ 、______ 。
(3)实验前先通入一段时间 的目的是
的目的是______ 。
(4)制备 的化学方程式为
的化学方程式为______ 。
(5)判断反应结束的依据是______ 。
Ⅱ.测定 纯度:
纯度:
称取 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液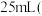 已知
已知 被
被 还原为
还原为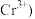 。
。
(6) 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为______ 。
(7)产品中 的纯度为
的纯度为______  杂质不参与反应
杂质不参与反应 。
。
 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到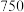 ℃时可制取
℃时可制取 ,同时还生成
,同时还生成 ,其装置图如下
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
已知:
 沸点
沸点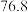 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。Ⅰ.制备
 :
:(1)仪器
 的名称是
的名称是(2)装置
 、
、 的作用分别是
的作用分别是(3)实验前先通入一段时间
 的目的是
的目的是(4)制备
 的化学方程式为
的化学方程式为(5)判断反应结束的依据是
Ⅱ.测定
 纯度:
纯度:称取
 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液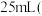 已知
已知 被
被 还原为
还原为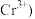 。
。(6)
 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为(7)产品中
 的纯度为
的纯度为 杂质不参与反应
杂质不参与反应 。
。
您最近一年使用:0次



