2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:____ ,其中电子占据的轨道数为_____ 个。
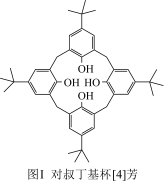
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为_____ ,羟基间的相互作用力为_____ 。
(3)不同大小的苯芳烃能识别某些离子,如:N3-、SCN−等。一定条件下,SCN−与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式_______ 。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:____ 。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于___ 晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_____ 。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为______ ,C60晶体密度的计算式为____ g·cm−3。(NA为阿伏伽德罗常数的值)
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:

(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为
(3)不同大小的苯芳烃能识别某些离子,如:N3-、SCN−等。一定条件下,SCN−与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为
更新时间:2019-03-25 10:11:30
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图_______________ 。
(2)B、C、D三元素第一电离能由大到小的顺序为________ (用元素符号表示)。
(3)BD 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为________ 杂化;CA 的空间构型为
的空间构型为__________ (用文字描述)。
(4)1mol BC-中含有π键的数目为______ NA。
(5)D、E元素最简单氢化物的稳定性______ >______ (填化学式),理由是____ 。
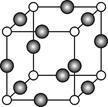
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是_____ ,C原子的配位数是_____ 。若相邻C原子和F原子间的距离为a cm,阿伏加德罗常数为NA,则该晶体的密度为______ g/cm3(用含a、NA的符号表示)。
(1)基态E原子的价电子排布图
(2)B、C、D三元素第一电离能由大到小的顺序为
(3)BD
 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为 的空间构型为
的空间构型为(4)1mol BC-中含有π键的数目为
(5)D、E元素最简单氢化物的稳定性
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁及其化合物在生产、生活中有重要应用。回答下列问题:
(1) 的价电子轨道表示式为
的价电子轨道表示式为___________ 。
(2) 和
和 可形成如图所示的配合物离子。其中铁的一个配体为茂环阴离子(
可形成如图所示的配合物离子。其中铁的一个配体为茂环阴离子( ),该配体以
),该配体以 电子参与配位。(-Ph表示苯基)
电子参与配位。(-Ph表示苯基)

①在该配合物结构中, 的配位数为
的配位数为___________ 。该配合物中碳原子的杂化方式共有___________ 种。
②N、S、O第一电离能由大到小的顺序为___________ 。
③ 表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大
表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为___________ 。
(3)普鲁士蓝晶体属立方晶系,晶胞棱长为apm。铁—氰骨架组成晶胞中的8个小立方体,Fe粒子在小立方体顶点, 在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳
在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。
在图中省略)。
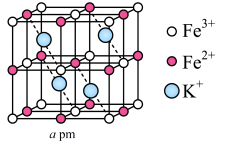
①该晶胞的化学式为___________ 。
②若所有铁粒子为等径小球,则 与
与 之间最近距离为
之间最近距离为___________ pm;该晶体的密度为___________  (阿伏加德罗常数为
(阿伏加德罗常数为 )。
)。
(1)
 的价电子轨道表示式为
的价电子轨道表示式为(2)
 和
和 可形成如图所示的配合物离子。其中铁的一个配体为茂环阴离子(
可形成如图所示的配合物离子。其中铁的一个配体为茂环阴离子( ),该配体以
),该配体以 电子参与配位。(-Ph表示苯基)
电子参与配位。(-Ph表示苯基)
①在该配合物结构中,
 的配位数为
的配位数为②N、S、O第一电离能由大到小的顺序为
③
 表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大
表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为(3)普鲁士蓝晶体属立方晶系,晶胞棱长为apm。铁—氰骨架组成晶胞中的8个小立方体,Fe粒子在小立方体顶点,
 在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳
在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。
在图中省略)。
①该晶胞的化学式为
②若所有铁粒子为等径小球,则
 与
与 之间最近距离为
之间最近距离为 (阿伏加德罗常数为
(阿伏加德罗常数为 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】现有U、V、W、X、Y、Z共6种短周期元素,其原子序数依次增大,部分信息如下表:
请用相应的化学用语回答下列问题:
(1)第一电离能介于X和Y之间的第三周期的元素共有___________ 种。
(2)基态 离子的电子占据最高能级的电子云轮廓图为
离子的电子占据最高能级的电子云轮廓图为___________ 形。
(3)V原子的外围电子排布图为___________ 。根据对角线规则,与X的化学性质最相似的邻族短周期元素是___________ (填元素名称)。
(4)元素R与Y的原子序数相差18,预测R的简单氢化物分子的立体构型为___________ ,其稳定性比Y的简单氢化物___________ (填“高”或“低”),其判断理由是___________ 从原子结构的角度分析)。
(5)V、W、Z的简单离子半径由大到小的顺序为___________ (用具体的离子符号表示)。
(6)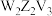 可以看成是
可以看成是 中的一个V原子被一个Z原子取代的产物,则
中的一个V原子被一个Z原子取代的产物,则 的VSEPR模型名称是
的VSEPR模型名称是___________ ,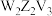 溶液与
溶液与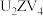 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为___________ 。
| U | 最高正价与最低负价的代数和为0,基态原子p能级上无电子 |
| V | 基态原子L层p能级电子数是L层s能级电子数的2倍 |
| W | 存在质量数为23,中子数为12的核素 |
| X | 基态原子的价电子排布为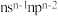 |
| Y | 单质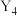 :正四面体结构,有剧毒,易自燃 :正四面体结构,有剧毒,易自燃 |
| Z |  能使品红溶液褪色,加热后品红能恢复红色 能使品红溶液褪色,加热后品红能恢复红色 |
(1)第一电离能介于X和Y之间的第三周期的元素共有
(2)基态
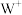 离子的电子占据最高能级的电子云轮廓图为
离子的电子占据最高能级的电子云轮廓图为(3)V原子的外围电子排布图为
(4)元素R与Y的原子序数相差18,预测R的简单氢化物分子的立体构型为
(5)V、W、Z的简单离子半径由大到小的顺序为
(6)
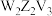 可以看成是
可以看成是 中的一个V原子被一个Z原子取代的产物,则
中的一个V原子被一个Z原子取代的产物,则 的VSEPR模型名称是
的VSEPR模型名称是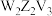 溶液与
溶液与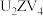 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为
您最近一年使用:0次
【推荐1】自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________ ,砷属于________ 区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价电子排布式为___________________________ 。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如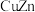 ,
,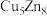 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能________ (填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是________ ,与Ti形成配位键的配体是________ , 该配合物中含有
该配合物中含有 键的数目为
键的数目为________ 。
(5) 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为:________ ;与 互为等电子体的分子有:
互为等电子体的分子有:___________________ (填分子式)。
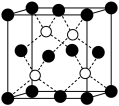
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________  (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
(1)请写出Fe的基态原子核外电子排布式
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能 |  |  |  |  |
| A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为
(3)锌化铜是一种金属互化物,其化学式有多种形式,如
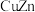 ,
,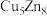 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能(4)用锌还原
 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是 该配合物中含有
该配合物中含有 键的数目为
键的数目为(5)
 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为: 互为等电子体的分子有:
互为等电子体的分子有:(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示
 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ= (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】云南师范大学杨智教授合成了一种以醚键桥联型双吡啶羧酸为配体的金属镍配合物(分子式为C12H10N2NiO7·2H2O)。本配合物具有一定的光催化效果,在光催化还原二氧化碳方面具有潜在的应用价值。

(1)基态Ni原子的电子排布式为___________ ,元素周期表中与镍位置相邻的某元素原子的最外层只有一个电子,则该元素位于元素周期表的___________ 区,此区元素的价电子层结构特点是(n-1)d_____ ns_____ 。
(2)该配合物的配位原子为___________ ,配位原子轨道杂化类型为___________ 。
(3)NH3、PH3、AsH3的沸点由高到低的顺序为___________ ,用物质结构理论加以解释:___________ 。NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是___________ 。
(4)NiO晶体的结构与NaCl相同,已知NiO晶体的密度约为6.7 g·cm-3,则可计算出Ni2+与最邻近的O2-的距离为___________ cm(写出计算式,无需化简)。

(1)基态Ni原子的电子排布式为
(2)该配合物的配位原子为
(3)NH3、PH3、AsH3的沸点由高到低的顺序为
(4)NiO晶体的结构与NaCl相同,已知NiO晶体的密度约为6.7 g·cm-3,则可计算出Ni2+与最邻近的O2-的距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】2022年2月我国科学家在《科学》杂志发表反型钙钛矿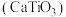 太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟了新方向。钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。回答下列问题:
太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟了新方向。钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。回答下列问题:
(1)某种钙钛矿晶胞结构如图,若●表示 ,则○表示
,则○表示___________ 原子;若以 为晶胞的顶点,则
为晶胞的顶点,则 位于晶胞的
位于晶胞的___________ 。

(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。等电子体的相似性质被广泛运用,请写出与
反应制得。等电子体的相似性质被广泛运用,请写出与 成等电子体的分子和离子(各一个)
成等电子体的分子和离子(各一个)___________ 。
(3) 能与甲胺
能与甲胺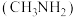 形成稳定的配合物
形成稳定的配合物 。
。
①甲胺中N原子的杂化方式为___________ 。
② 中
中 键角比
键角比 中
中 键角小,从结构角度解释原因
键角小,从结构角度解释原因___________ 。
(4) 的化学性质非常稳定,广泛用于涂料、橡胶和造纸等工业。金红石型
的化学性质非常稳定,广泛用于涂料、橡胶和造纸等工业。金红石型 的晶胞为长方体,晶胞参数如图所示。
的晶胞为长方体,晶胞参数如图所示。 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为___________  。
。

(5)硫酸氧钛晶体中阳离子为链状聚合形式的离子,部分结构如下图所示。该阳离子中Ti与O的原子个数之比为___________ 。该阳离子的化学式为___________ 。

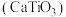 太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟了新方向。钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。回答下列问题:
太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟了新方向。钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。回答下列问题:(1)某种钙钛矿晶胞结构如图,若●表示
 ,则○表示
,则○表示 为晶胞的顶点,则
为晶胞的顶点,则 位于晶胞的
位于晶胞的
(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。等电子体的相似性质被广泛运用,请写出与
反应制得。等电子体的相似性质被广泛运用,请写出与 成等电子体的分子和离子(各一个)
成等电子体的分子和离子(各一个)(3)
 能与甲胺
能与甲胺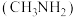 形成稳定的配合物
形成稳定的配合物 。
。①甲胺中N原子的杂化方式为
②
 中
中 键角比
键角比 中
中 键角小,从结构角度解释原因
键角小,从结构角度解释原因(4)
 的化学性质非常稳定,广泛用于涂料、橡胶和造纸等工业。金红石型
的化学性质非常稳定,广泛用于涂料、橡胶和造纸等工业。金红石型 的晶胞为长方体,晶胞参数如图所示。
的晶胞为长方体,晶胞参数如图所示。 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为 。
。
(5)硫酸氧钛晶体中阳离子为链状聚合形式的离子,部分结构如下图所示。该阳离子中Ti与O的原子个数之比为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________ ,VO43-的几何构型为________ 。
(2)2-巯基烟酸氧钒配合物(如图) 是副作用小的有效调节血糖的新型药物。
①基态S原子中原子核外未成对电子数为_______ ,该药物中S原子的杂化方式是_______ ,所含第二周期元素第一电离能按由大到小顺序的排列是___________ 。
②2-巯基烟酸如(图) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________ 。
(3)下列含硫物质中存在Π键的是_____ 。
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如左图所示,该晶胞的化学式为______ 。右图为该晶胞的俯视图,该晶胞的密度为________ g/cm3 (列出计算式即可)。
(1)基态钒原子的外围电子轨道表达式为
(2)2-巯基烟酸氧钒配合物(如图) 是副作用小的有效调节血糖的新型药物。

①基态S原子中原子核外未成对电子数为
②2-巯基烟酸如(图) 水溶性优于2-巯基烟酸氧钒配合物的原因是

(3)下列含硫物质中存在Π键的是
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如左图所示,该晶胞的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】锌是人体必需的微量元素,明朝《天工开物》中有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)基态Zn原子的价电子排布式为____________ ,在周期表中位置为________________ 。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除H外其余元素的第一电离能由大到小排序为________________________ 。
②在[Zn(NH3)4]SO4溶液中滴加NaOH溶液,未出现浑浊,其原因是___________________________ 。
③已知[Zn(NH3)4]2+的空间构型与SO42-相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________ 。
④以下作用力在[Zn(NH3)4]SO4晶体中存在的有________ 。
A.离子键 B.极性共价键 C.非极性共价键
D.配位键 E.范德华力 F.金属键
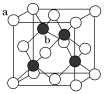
(3)ZnS晶胞结构如图(已知a为硫离子,b为锌离子)所示,ZnS晶体的熔点约为1 700 ℃。
①已知晶体密度为ρ g·cm-3,NA为阿伏加 德罗常数的值。则1个ZnS晶胞的体积为________ cm3。
②ZnO与ZnS结构相似,熔点为1 975 ℃,其熔点较高的原因是_____________________________ 。
(1)基态Zn原子的价电子排布式为
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除H外其余元素的第一电离能由大到小排序为
②在[Zn(NH3)4]SO4溶液中滴加NaOH溶液,未出现浑浊,其原因是
③已知[Zn(NH3)4]2+的空间构型与SO42-相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为
④以下作用力在[Zn(NH3)4]SO4晶体中存在的有
A.离子键 B.极性共价键 C.非极性共价键
D.配位键 E.范德华力 F.金属键
(3)ZnS晶胞结构如图(已知a为硫离子,b为锌离子)所示,ZnS晶体的熔点约为1 700 ℃。
①已知晶体密度为ρ g·cm-3,NA为阿伏加 德罗常数的值。则1个ZnS晶胞的体积为
②ZnO与ZnS结构相似,熔点为1 975 ℃,其熔点较高的原因是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】过渡金属元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)27Co的基态原子的核外价层电子中,成对电子与未成对电子的数目比是___________ 。
(2)有效原子序数规则(EAN)是指过渡金属的价电子数和它周围配体提供的电子数之和等于18,此时配合物能稳定存在。24Cr与CO形成的羰基配合物Cr(CO)x中,与Cr形成配位键的元素名称是___________ ,根据有效原子序数规则推断,x=___________ 。
(3)钡钛矿的晶胞结构如图,钡钛矿的化学式为___________ ,距Ba2+最近且等距离的O2-有______ 个,若以M处的Ba2+分数坐标为(0,0,0),则N处O2-的分数坐标为___________ 。

(1)27Co的基态原子的核外价层电子中,成对电子与未成对电子的数目比是
(2)有效原子序数规则(EAN)是指过渡金属的价电子数和它周围配体提供的电子数之和等于18,此时配合物能稳定存在。24Cr与CO形成的羰基配合物Cr(CO)x中,与Cr形成配位键的元素名称是
(3)钡钛矿的晶胞结构如图,钡钛矿的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】【化学——选修3:物质结构与性质】已知Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)金属铁的紧密堆积方式为_______________ ,其配位数为_____________________ 。
(2)HCN 分子的结构式为___________ ,与CN-互为等电子体的阴离子是_________________ 。
(3)K2CO3中阴离子的空间构型为_______________ ,CO2为_____________ 分子(填“极性”或“非极性”),H2O中O原子的杂化轨道类型为_______________ 。
(4)配合物K4Fe(CN)6的中心离子的电子排布式为__________________ 。
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为________________________ 。
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有_____ 个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为___________ (用NA 表示阿伏伽德罗常数的值。)
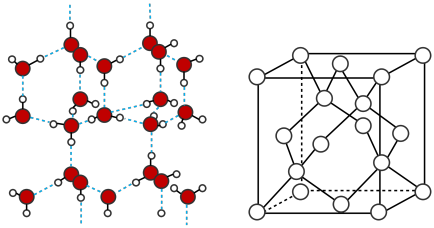
图1 图2
(1)金属铁的紧密堆积方式为
(2)HCN 分子的结构式为
(3)K2CO3中阴离子的空间构型为
(4)配合物K4Fe(CN)6的中心离子的电子排布式为
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有

图1 图2
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】B、N、F、Ga、As是新一代太阳能电池、半导体材料中含有的主要元素。回答下列问题:
(1)基态Ga原子的核外电子排布式是__________ ,基态Ga原子核外电子占据最高能级的电子云轮廓图为________ 。
(2)在第四周期中,与基态As原子核外未成对电子数目相同的元素为__________ 。
(3)NF3的立体构型为_______ 。N2F2分子中各原子都满足8电子结构,分子中σ键和π键的个数比为______ ,氮原子的杂化轨道类型为__________ 。
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因______ 。
(5)由B、N、F组成的某离子化合物中,B、N、F的原子个数比为1:1:8,其阴、阳离子互为等电子体,该化合物中的阳离子、阴离子符号分别为__________ 。
(6)GaAs晶体结构如图所示。
①图中As原子的坐标参数为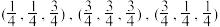 ,
,_______ 。
②已知晶胞中相邻且最近的Ga、As原子的核间距为acm,NA为阿伏加 德罗常数的值,晶体的密度为___________ g/cm3(填写表达式)。

(1)基态Ga原子的核外电子排布式是
(2)在第四周期中,与基态As原子核外未成对电子数目相同的元素为
(3)NF3的立体构型为
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因
(5)由B、N、F组成的某离子化合物中,B、N、F的原子个数比为1:1:8,其阴、阳离子互为等电子体,该化合物中的阳离子、阴离子符号分别为
(6)GaAs晶体结构如图所示。
①图中As原子的坐标参数为
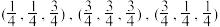 ,
,②已知晶胞中相邻且最近的Ga、As原子的核间距为acm,NA为阿伏加 德罗常数的值,晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】磷及含磷化合物是重要的化工原料,广泛应用于洗涤剂、农药、医药、水处理等行业回答下列问题:
(1)基态P原子的轨道表示式为___ (填字母)。
a.[Ne] b.[Ne]
b.[Ne] 
c.[Ne] d.[Ne]
d.[Ne] 
(2)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:

其中最小的环为___ 元环,每个环平均含有___ 个P原子。
(3)杀虫剂敌敌畏是有机磷化合物,其结构简式如图所示,其中C原子的杂化方式为____ ,甲基得一个电子后为CH3-,其空间构型为_____ 。

(4)磷化硼(BP)是一种超硬耐磨涂层材料,晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中。
①PH3、NH3、BP三种物质的熔沸点由大到小的顺序为_____ 。
②磷化硼晶胞结构如图所示,晶胞参数a=b=c=478pm,α=β=γ=90°,则磷化硼的密度是___ g·cm-3。(列出计算表达式,设阿伏加 德罗常数为NA)

(1)基态P原子的轨道表示式为
a.[Ne]
 b.[Ne]
b.[Ne] 
c.[Ne]
 d.[Ne]
d.[Ne] 
(2)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:

其中最小的环为
(3)杀虫剂敌敌畏是有机磷化合物,其结构简式如图所示,其中C原子的杂化方式为

(4)磷化硼(BP)是一种超硬耐磨涂层材料,晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中。
①PH3、NH3、BP三种物质的熔沸点由大到小的顺序为
②磷化硼晶胞结构如图所示,晶胞参数a=b=c=478pm,α=β=γ=90°,则磷化硼的密度是

您最近一年使用:0次



