(一)写出下列反应的化学方程式:
(1)实验室制乙烯__________________________________
(2)用甲苯制备TNT________________________________
(3)苯酚和浓溴水的反应_____________________________
(4)1,2-二溴乙烷与其足量氢氧化钠的乙醇溶液加热:____________________________
(5)乙醛与银氨溶液的反应____________________________
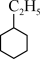
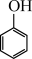
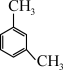
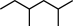
(二)(1)根据系统命名法, 的名称是
的名称是_________________  的名称是
的名称是_________________________________________________ ;
(2) 顺-2-丁烯的结构简式是________________
(3)已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,NaHYO3溶液中离子浓度从大到小的顺序是_________________________________
(4) 某同学取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是________ 。
(5)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=________ 。
(1)实验室制乙烯
(2)用甲苯制备TNT
(3)苯酚和浓溴水的反应
(4)1,2-二溴乙烷与其足量氢氧化钠的乙醇溶液加热:
(5)乙醛与银氨溶液的反应
(二)(1)根据系统命名法,
 的名称是
的名称是 的名称是
的名称是(2) 顺-2-丁烯的结构简式是
(3)已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,NaHYO3溶液中离子浓度从大到小的顺序是
(4) 某同学取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是
(5)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
更新时间:2019-04-01 16:43:55
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】向100mL NaOH溶液中通入一定量 充分反应后,向所得溶液中,逐滴滴加1mol/L的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
充分反应后,向所得溶液中,逐滴滴加1mol/L的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。 充分反应后,所得溶液的溶质为
充分反应后,所得溶液的溶质为___________ (填化学式)。
(2)已知25℃碳酸的 ,
, ,忽略
,忽略 和
和 浓度的变化,在滴加盐酸前,此时溶液pH=
浓度的变化,在滴加盐酸前,此时溶液pH=___________ 。
(3)关于该溶液的表达式正确的是___________。
 充分反应后,向所得溶液中,逐滴滴加1mol/L的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
充分反应后,向所得溶液中,逐滴滴加1mol/L的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
 充分反应后,所得溶液的溶质为
充分反应后,所得溶液的溶质为(2)已知25℃碳酸的
 ,
, ,忽略
,忽略 和
和 浓度的变化,在滴加盐酸前,此时溶液pH=
浓度的变化,在滴加盐酸前,此时溶液pH=(3)关于该溶液的表达式正确的是___________。
A. |
B. |
C. |
D. |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】平衡思想是化学研究的一个重要观念,在水溶液中存在多种平衡体系。
(1)①室温下,0.1 mol/L的醋酸在水中有1%发生电离,则该温度下CH3COOH的电离平衡常数Ka≈_______ 。
②在25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合(忽略混合时的溶液体积变化),反应平衡时溶液中c( )=c(Cl-),则溶液显
)=c(Cl-),则溶液显_______ (填“酸“碱”或“中”)性。
(2)已知,常温下几种物质的电离常数如下:
①三种相同物质的量浓度的Na2CO3、NaClO、NaHSO3的pH从小到大的排序是_______ 。
②下列说法正确的是_______ 。
A.Ca(ClO)2溶液中通入少量SO2:SO2 + H2O+Ca2++2ClO- = CaSO3↓+2HClO
B.常温下,将SO2通入氨水中,当c(OH−)降至1.0×10-7mol/L时,溶液中的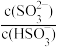 =0.6
=0.6
C.等物质的量浓度的NaHSO3与Na2SO3混合液中,3c(Na+)=2c( )+2c(
)+2c( )+2c(H2SO3)
)+2c(H2SO3)
D.Na2CO3溶液中加入少量水,则溶液中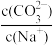 将减小
将减小
③根据表中数据,计算常温下0.03 mol/L NaClO溶液的pH≈_______ 。
④现有常温下0.1mol·L-1的(NH4)2CO3溶液,溶液中各微粒浓度之间的关系式错误的是_______ (填字母)。
A.c( )+c(H+)=c(
)+c(H+)=c( )+c(OH-)+c(
)+c(OH-)+c( )
)
B.c( )+c(NH3·H2O)=2c(
)+c(NH3·H2O)=2c( )+2c(
)+2c( )+2c(H2CO3)
)+2c(H2CO3)
C.c( )+c(
)+c( )+c(H2CO3)=0.1mol·L-1
)+c(H2CO3)=0.1mol·L-1
D.c(H+)+c( )+c(H2CO3)=c(OH-)+c(NH3·H2O)
)+c(H2CO3)=c(OH-)+c(NH3·H2O)
(1)①室温下,0.1 mol/L的醋酸在水中有1%发生电离,则该温度下CH3COOH的电离平衡常数Ka≈
②在25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合(忽略混合时的溶液体积变化),反应平衡时溶液中c(
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显(2)已知,常温下几种物质的电离常数如下:
| 化学式 | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=3.0×10-8 | Ka1=1.4×10-2 Ka2=6.0×10-8 |
①三种相同物质的量浓度的Na2CO3、NaClO、NaHSO3的pH从小到大的排序是
②下列说法正确的是
A.Ca(ClO)2溶液中通入少量SO2:SO2 + H2O+Ca2++2ClO- = CaSO3↓+2HClO
B.常温下,将SO2通入氨水中,当c(OH−)降至1.0×10-7mol/L时,溶液中的
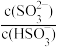 =0.6
=0.6C.等物质的量浓度的NaHSO3与Na2SO3混合液中,3c(Na+)=2c(
 )+2c(
)+2c( )+2c(H2SO3)
)+2c(H2SO3)D.Na2CO3溶液中加入少量水,则溶液中
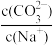 将减小
将减小③根据表中数据,计算常温下0.03 mol/L NaClO溶液的pH≈
④现有常温下0.1mol·L-1的(NH4)2CO3溶液,溶液中各微粒浓度之间的关系式错误的是
A.c(
 )+c(H+)=c(
)+c(H+)=c( )+c(OH-)+c(
)+c(OH-)+c( )
)B.c(
 )+c(NH3·H2O)=2c(
)+c(NH3·H2O)=2c( )+2c(
)+2c( )+2c(H2CO3)
)+2c(H2CO3) C.c(
 )+c(
)+c( )+c(H2CO3)=0.1mol·L-1
)+c(H2CO3)=0.1mol·L-1D.c(H+)+c(
 )+c(H2CO3)=c(OH-)+c(NH3·H2O)
)+c(H2CO3)=c(OH-)+c(NH3·H2O)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是______ .
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡______ (填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH) 的比值将______ (填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)______ V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是______ .
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(5)常温下,取甲溶液稀释100倍,其pH=______ ;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______ .
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10﹣5 | 4.3×10﹣7 | 3.0×10﹣8 |
| K2 | ﹣﹣ | 5.6×10﹣11 | ﹣﹣ |
下列四种离子结合H+能力最强的是
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(5)常温下,取甲溶液稀释100倍,其pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】(1)按系统命名法填写下面有机物的名称: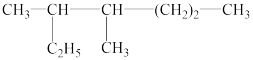
_________________
(2)2,6-二甲基-4-乙基辛烷的结构简式是______________________ ,1 mol该烃完全燃烧需消耗氧气________ mol。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子对。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为________ 。
②符合该条件的单烯烃的分子式为________ 。
(4)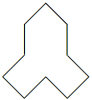 分子式为
分子式为________ ,按碳的骨架分,该有机物属于________ 。(填字母序号)
a. 环状化合物 b. 脂环烃 c. 芳香化合物 d. 苯的同系物
(5)2,2-二甲基丙烷的习惯命名为________ 。
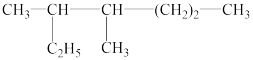
(2)2,6-二甲基-4-乙基辛烷的结构简式是
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子对。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为
②符合该条件的单烯烃的分子式为
(4)
 分子式为
分子式为a. 环状化合物 b. 脂环烃 c. 芳香化合物 d. 苯的同系物
(5)2,2-二甲基丙烷的习惯命名为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题:
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g,该烃可能的结构简式为___________ 。
(2)某链状烷烃的相对分子质量为114,该烷烃的分子式为___________ 。
(3)在常温常压下有 、
、 、
、 和
和 四种气态烃。取等物质的量的四种气态烃,分别在足量的氧气中燃烧,消耗氧气最多的是
四种气态烃。取等物质的量的四种气态烃,分别在足量的氧气中燃烧,消耗氧气最多的是___________ (填分子式)。
(4)下列物质中,可以通过乙烯加成反应得到的是___________ (填序号)。
A. B.
B.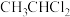 C.
C.
(5) 的名称是:___________
的名称是:___________
(6)下列各图均能表示甲烷的分子结构,其中更能反映其真实存在状况的是:___________
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g,该烃可能的结构简式为
(2)某链状烷烃的相对分子质量为114,该烷烃的分子式为
(3)在常温常压下有
 、
、 、
、 和
和 四种气态烃。取等物质的量的四种气态烃,分别在足量的氧气中燃烧,消耗氧气最多的是
四种气态烃。取等物质的量的四种气态烃,分别在足量的氧气中燃烧,消耗氧气最多的是(4)下列物质中,可以通过乙烯加成反应得到的是
A.
 B.
B.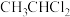 C.
C.
(5)
 的名称是:___________
的名称是:___________| A.2,3,3-三甲基戊烷 | B.3,3,4-三甲基戊烷 |
| C.2,3-二甲基2乙基丁烷 | D.2,3-二甲基-3-乙基丁烷 |
A.分子结构示意图 | B.电子式 |
C.球棍模型 | D.空间填充模型 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】用系统命名法写出下列物质的名称或结构简式。
(1)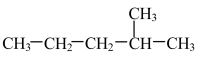 :
:_______ 。
(2) :
:_______ 。
(3)2-甲基-1-戊烯:_______ 。
(4)3-甲基-1-丁炔:_______ 。
(5)2,4,6-三硝基甲苯:_______ 。
(1)
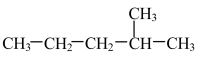 :
:(2)
 :
:(3)2-甲基-1-戊烯:
(4)3-甲基-1-丁炔:
(5)2,4,6-三硝基甲苯:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)写出下列物质名称(系统命名法)或结构简式:
①CH2=C(CH3)CH=CH2:___________________ ;
②BrCH2—CH2Br:___________________ ;
③乙二酸乙二酯:___________________ 。
(2)甘油醛(化学式为C3H6O3)为最简单的醛糖,结构如下图所示。
①请用“*”在图中标出手性碳原子__________ ;
②甘油醛在一定条件下可以和其它物质反应生成不含手性碳的有机物,用化学反应方程式表示该反应过程:___ ;
③写出甘油醛发生银镜反应的方程式:___________________ 。
①CH2=C(CH3)CH=CH2:
②BrCH2—CH2Br:
③乙二酸乙二酯:
(2)甘油醛(化学式为C3H6O3)为最简单的醛糖,结构如下图所示。

①请用“*”在图中标出手性碳原子
②甘油醛在一定条件下可以和其它物质反应生成不含手性碳的有机物,用化学反应方程式表示该反应过程:
③写出甘油醛发生银镜反应的方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】按要求填空:
(1)某有机物的结构简式为 ,该有机物中含氧官能团有:
,该有机物中含氧官能团有:_______ 、_______ 、_______ 、_______ 。(写官能团名称)
(2)有机物 的系统名称是
的系统名称是_______ ,将其在催化剂存在下完全氢化,所得烷烃的系统名称是_______ 。
(3)下图是某一有机物的红外光谱图,该有机物的相对分子质量为74,则其结构简式为_______ 。

(4)苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下:
 (
( 、
、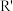 表示烷基或氢原子)
表示烷基或氢原子)
现有苯的同系物甲和乙,分子式都是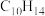 。甲不能被酸性高锰酸钾溶液氧化为芳香酸,甲的结构简式是
。甲不能被酸性高锰酸钾溶液氧化为芳香酸,甲的结构简式是_______ 。
(1)某有机物的结构简式为
 ,该有机物中含氧官能团有:
,该有机物中含氧官能团有:(2)有机物
 的系统名称是
的系统名称是(3)下图是某一有机物的红外光谱图,该有机物的相对分子质量为74,则其结构简式为

(4)苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下:
 (
( 、
、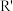 表示烷基或氢原子)
表示烷基或氢原子)现有苯的同系物甲和乙,分子式都是
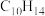 。甲不能被酸性高锰酸钾溶液氧化为芳香酸,甲的结构简式是
。甲不能被酸性高锰酸钾溶液氧化为芳香酸,甲的结构简式是
您最近一年使用:0次
【推荐1】苯是一种重要的化工原料,也是一种重要的溶剂,请回答下列问题:
(1)下图是某些有机物的填充模型,其中表示苯的是___________(填字母)。
(2)把苯加入盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,苯在上层,体现了苯的哪些性质___________ ,出现红棕色液体的一层在___________ (选填“上”或“下”)层,接下来要将两层液体分开的仪器是___________ 。把苯加入盛有少量酸性高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中___________ (选填“有”或“没有”)碳碳双键。
(3)对于苯曾有人提出两种立体结构(如图),就该两种立体结构回答下列有关问题:
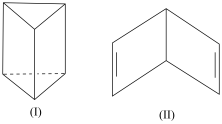
若苯的结构为(Ⅱ), 则下列说法正确的是___________ (选填字母)。
A.能使酸性高锰酸钾溶液褪色
B.燃烧时产生浓烟
C.能使溴水褪色
(4)苯最简单的同系物A___________ (填能或不能)使酸性高锰酸钾溶液褪色,体现了苯环对侧链性质的影响;图中的装置是A和浓硝酸浓硫酸加热到一定温度的反应,反应方程式___________ ,反应类型___________ 。小试管中的仪器是___________ 。

(1)下图是某些有机物的填充模型,其中表示苯的是___________(填字母)。
A.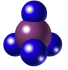 | B.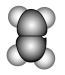 | C.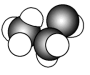 | D. |
(2)把苯加入盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,苯在上层,体现了苯的哪些性质
(3)对于苯曾有人提出两种立体结构(如图),就该两种立体结构回答下列有关问题:

若苯的结构为(Ⅱ), 则下列说法正确的是
A.能使酸性高锰酸钾溶液褪色
B.燃烧时产生浓烟
C.能使溴水褪色
(4)苯最简单的同系物A

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)用下列各组物质序号填空:
①O2和O3 ; ②12C、13C、14C; ③C2H6和C5H12; ④C3H6和C5H10; ⑤14N、14C ⑥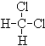 和
和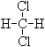 ;⑦CH3(CH2)3CH3和
;⑦CH3(CH2)3CH3和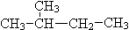
互为同位素的是_____ ;互为同素异形体的是_____ ;互为同系物的是_____ ;互为同分异构体的是_____ ;属于同一物质的是______ 。
(2)除去溴苯中的溴:试剂是:_____ ,反应的化学方程式为__________
(3)一定质量的乙醇在氧气不足时燃烧,得到CO、CO2和H2O质量共为27.6g,若H2O的质量为10.8g,则CO2的质量为______ g
(4)2gC2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,则C2H2燃烧热的热化学方程式:______ 。
①O2和O3 ; ②12C、13C、14C; ③C2H6和C5H12; ④C3H6和C5H10; ⑤14N、14C ⑥
 和
和 ;⑦CH3(CH2)3CH3和
;⑦CH3(CH2)3CH3和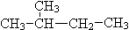
互为同位素的是
(2)除去溴苯中的溴:试剂是:
(3)一定质量的乙醇在氧气不足时燃烧,得到CO、CO2和H2O质量共为27.6g,若H2O的质量为10.8g,则CO2的质量为
(4)2gC2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,则C2H2燃烧热的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某烷烃的结构简式为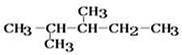
(1)用系统命名法命名该烃:______________________ 。
(2)若该烷烃是由烯烃加氢得到的,则原烯烃的结构有____ 种(不包括立体异构,下同)。
(3)若该烷烃是由炔烃加氢得到的,则原炔烃的结构有____ 种。
(4)该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有____ 种。
(5)写出由苯丙烯( )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:_____________ 。
(6)写出由甲苯制取TNT的反应方程式:_______________ 。
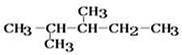
(1)用系统命名法命名该烃:
(2)若该烷烃是由烯烃加氢得到的,则原烯烃的结构有
(3)若该烷烃是由炔烃加氢得到的,则原炔烃的结构有
(4)该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有
(5)写出由苯丙烯(
 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:(6)写出由甲苯制取TNT的反应方程式:
您最近一年使用:0次