二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰(CH3COO)3Mn]可用于制造离子电池的负极材料。合成方程式如下:
2H2C2O4+SiC14+2LiBF4==2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40 CH3COOH
(1)基态Mn原子的核外电子排布式为_________ 。
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是___________ ,1mol草酸分子中含有 键的数目为
键的数目为_______________ 。
(3)与SiF4互为等电子体的两种阴离子的化学式为_________________ 。
(4)CH3COOH易溶于水,除了它是极性分子外,还因为___________________ 。
(5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是_______________ 。

(6)硼氢化钠的晶胞结构如图所示,该晶胞中Na+的配位数为___________ ,若硼氢化钠晶体的密度为d g/cm3,NA表示阿伏伽德罗常数的值,则a=______ (用含d、NA的代数式表示);若硼氢化钠晶胞上、下底心处的Na+被Li+取代,则得到晶体的化学式为___________________ 。
2H2C2O4+SiC14+2LiBF4==2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40 CH3COOH
(1)基态Mn原子的核外电子排布式为
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是
 键的数目为
键的数目为(3)与SiF4互为等电子体的两种阴离子的化学式为
(4)CH3COOH易溶于水,除了它是极性分子外,还因为
(5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是

(6)硼氢化钠的晶胞结构如图所示,该晶胞中Na+的配位数为
更新时间:2019-04-08 17:19:08
|
相似题推荐
【推荐1】Ⅰ.氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。
(2)氟氧化物O2F2、OF2的结构已经确定。
①依据数据推测O—O键的稳定性:O2F2___________ H2O2(填“>”或“<”)。
②OF2中F-O-F的键角小于H2O中H-O-H的键角,解释原因:___________ 。
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H···Y)中三原子在一条直线上时,作用力最强。测定结果表明,(HF)n固体中HF分子排列成锯齿形。画出含2个HF的重复单元结构:___________ 。
②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
Ⅱ.金属冶炼过程中一种用有机化合物从水溶液中提取 的流程如下:
的流程如下: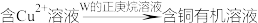
(4)有机化合物W的结构简式为:___________ 种,N、O杂化轨道类型分别为___________ 、___________ 。
(5)W可与 形成化合物Q,其结构如下所示:
形成化合物Q,其结构如下所示: 的价电子排布式为
的价电子排布式为___________ 。
②氢键对Q在水中溶解性的影响是___________ (填“增大”或“减小”)。
(1)基态F原子的核外电子排布式为
(2)氟氧化物O2F2、OF2的结构已经确定。
| O2F2 | H2O2 | |
| O—O键长/pm | 121 | 148 |
②OF2中F-O-F的键角小于H2O中H-O-H的键角,解释原因:
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H···Y)中三原子在一条直线上时,作用力最强。测定结果表明,(HF)n固体中HF分子排列成锯齿形。画出含2个HF的重复单元结构:
②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出该过程的离子方程式:
Ⅱ.金属冶炼过程中一种用有机化合物从水溶液中提取
 的流程如下:
的流程如下: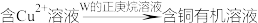
(4)有机化合物W的结构简式为:
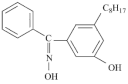
(5)W可与
 形成化合物Q,其结构如下所示:
形成化合物Q,其结构如下所示: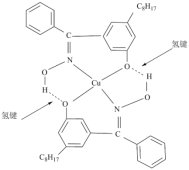
 的价电子排布式为
的价电子排布式为②氢键对Q在水中溶解性的影响是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】科学研究发现铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,因此受到研究人员的广泛关注。γ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去____ 轨道电子,Fe3+价层电子排布图为____ 。
(2)氨气中N的杂化类型是_____ ,NH3中H−N−H的键角比NH 中H−N−H的键角
中H−N−H的键角____ (填“大”或“小”)。
(3)羰基铁粉[Fe(CO)5]中铁元素的配位数是____ ,配位原子为____ 。
(4)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为____ 。
(5)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为____ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为____ nm(用含d和NA的代数式表示)。

(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
 中H−N−H的键角
中H−N−H的键角(3)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(4)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(5)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
【推荐3】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,
(1)请写出基态Cu原子的外围电子排布式____________ 。焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了 _________ 而变为激发态。
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式

请分析1个松脂酸铜中π键的个数_____ ;加 “*”碳原子的杂化方式为 ______ 。
(3)下图是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号)______________ ;与X等距离且最近的X原子个数为____
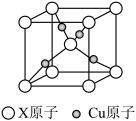
(4)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型______ ,比较第一电离能:S _____ O(填“>”或“<”)
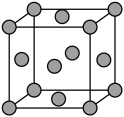
(5)黄铜合金可以表示为Cu3Zn,为面心立方晶胞,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果)____________ nm。
(1)请写出基态Cu原子的外围电子排布式
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式

请分析1个松脂酸铜中π键的个数
(3)下图是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号)

(4)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型
(5)黄铜合金可以表示为Cu3Zn,为面心立方晶胞,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果)

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】蛋白质是构成生物体的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为_______ (用元素符号表示)。
(2)NH3的空间结构是_______ 形
(3)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为____ ; 中的硫原子杂化方式为
中的硫原子杂化方式为____ ;
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:
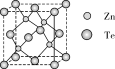
与Te原子距离最近的Te原子有_______ 个;若晶胞边长为apm,则晶体密度为_______ g/cm3(用含NA的式子表示,已知相对质量:Zn-65、Te-128)。
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为
(2)NH3的空间结构是
(3)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为
 中的硫原子杂化方式为
中的硫原子杂化方式为(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:

与Te原子距离最近的Te原子有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铁元素在地壳中含量丰富,应用广泛:回答以下问题:
(1)基态Fe的价电子排布式为_____ ,其中未成对电子数目为_____ 。
(2)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。

①该双核阳离子中,Fe原子的配位数为_____ ,配体H2O的空间构型为_____ ,其键角_____ 109°28ˊ(填“大于”、“小于”或“等于”)。
②用KSCN可检验溶液中Fe3+的存在,lmol中SCN-中含有的π键数目为_____ NA。
(3)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是_____ 。
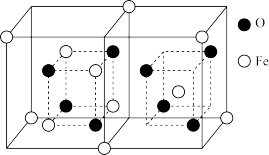
(4)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为_____ 。
(1)基态Fe的价电子排布式为
(2)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。

①该双核阳离子中,Fe原子的配位数为
②用KSCN可检验溶液中Fe3+的存在,lmol中SCN-中含有的π键数目为
(3)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是
(4)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铜、镁、钙、锡及其化合物有许多用途。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为___________ ,S、O、 N三种元素的第一电离能由大到小的顺序为___________ 。
(2)CuSO4中阴离子的空间构型为___________ ,向盛CuSO4溶液的试管中逐滴加入氨水直至过量,可观察到的现象是___________ ,写出该过程涉及的总离子方程式___________ 。
(3)叶绿素的结构示意图(部分)如图所示,其中存在___________ (填标号)。
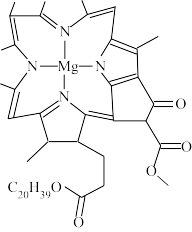
a.非极性共价键 b.离子键 c.配位键 d.σ键 e.π键 f.氢键
(4)碳酸盐的热分解示意图如图所示:

热分解温度: CaCO3___________ (填 “高于”或“低于”)SrCO3,原因是___________ 。
(5)磷青铜晶体的晶胞结构如图所示。若晶体的密度为a g·cm−3, P与最近的Cu原子的核间距为___________ nm (用NA表示阿伏加德罗常数的值)。

(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为
(2)CuSO4中阴离子的空间构型为
(3)叶绿素的结构示意图(部分)如图所示,其中存在

a.非极性共价键 b.离子键 c.配位键 d.σ键 e.π键 f.氢键
(4)碳酸盐的热分解示意图如图所示:

热分解温度: CaCO3
(5)磷青铜晶体的晶胞结构如图所示。若晶体的密度为a g·cm−3, P与最近的Cu原子的核间距为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】快离子导体是一类具有优良离子导电能力的固体电解质,研究得最多的是Ag、Cu、 Li、Na、F、O等的快离子导体。
(1)Cu-e-=Cu+的过程中,失去的电子是基态Cu中_______ 轨道上的电子。
(2)N、O、F的第一电离能从小到大的顺序为_______ (用元素符号表示);NH3、H2O、HF的沸点由低到高的顺序为_______ (用化学式表示)。
(3)“棕色环”现象是检验溶液中NO 的一种方法。向含有NO
的一种方法。向含有NO 溶液的试管中加入FeSO4,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为[Fe(NO)(H2O)5 ]SO4。
溶液的试管中加入FeSO4,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为[Fe(NO)(H2O)5 ]SO4。
①NO 中N元素采取
中N元素采取_______ 杂化,其立体构型为_______ (填名称)。
②[Fe(NO)(H2O)5]SO4中一种配体实际上是NO+,则其中Fe元素的化合价为_______ ;写出NO+的一种等电子体的化学式_______ 。
(4)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为_______ 。SiCl4可发生水解反应,机理如图:
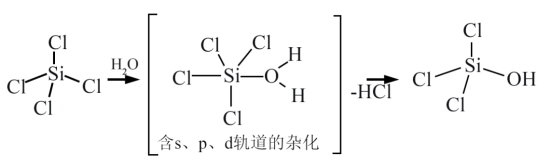
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为_______ (填标号)。
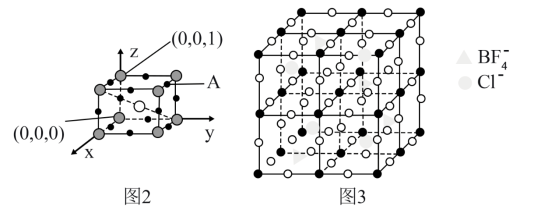
(5)Li3SBF4是潜在的快离子导体,其晶胞结构如图,A原子的坐标为_______ ;若在运算建立该晶体的模型过程中,晶胞中部分BF 被Cl- 取代后得到的晶胞结构如图3所示,则得到的晶体的化学式为
被Cl- 取代后得到的晶胞结构如图3所示,则得到的晶体的化学式为_______ 。
(1)Cu-e-=Cu+的过程中,失去的电子是基态Cu中
(2)N、O、F的第一电离能从小到大的顺序为
(3)“棕色环”现象是检验溶液中NO
 的一种方法。向含有NO
的一种方法。向含有NO 溶液的试管中加入FeSO4,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为[Fe(NO)(H2O)5 ]SO4。
溶液的试管中加入FeSO4,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为[Fe(NO)(H2O)5 ]SO4。①NO
 中N元素采取
中N元素采取②[Fe(NO)(H2O)5]SO4中一种配体实际上是NO+,则其中Fe元素的化合价为
(4)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(5)Li3SBF4是潜在的快离子导体,其晶胞结构如图,A原子的坐标为
 被Cl- 取代后得到的晶胞结构如图3所示,则得到的晶体的化学式为
被Cl- 取代后得到的晶胞结构如图3所示,则得到的晶体的化学式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害,工业上用于合成除草剂、杀草丹、燕麦敌、杀虫剂巴丹等。其结构与 类似。工业上一般通过
类似。工业上一般通过 或者CO与
或者CO与 反应制取COS,发生的相关反应如下:
反应制取COS,发生的相关反应如下:
i.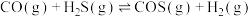
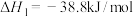
ii.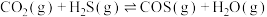
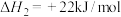
iii.

(1)
_______ 。
(2)COS的中心原子的杂化方式为_______ 。
(3)在一定温度下,将4molCO和 通入一固定容积的密闭容器中发生上述反应i。
通入一固定容积的密闭容器中发生上述反应i。
①能证明上述反应达到平衡的标志是_______ (填字母)。
A.CO和 的转化率相等 B.
的转化率相等 B. 的体积分数不再变化
的体积分数不再变化
C.混合气体的密度不再变化 D.CO、 、COS、
、COS、 浓度之比为1:1:1:1
浓度之比为1:1:1:1
②上述反应达到平衡后,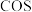 所占的体积分数为12.5%,则该反应的平衡常数为
所占的体积分数为12.5%,则该反应的平衡常数为_______ (保留两位有效数字)。若此时再向体系中加入0.5molCO和 ,平衡将
,平衡将_______ (填“向正反应方向”“向逆反应方向”或“不”)移动;理由是_______ 。
(4)将4molCO和 通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点
通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点_______ (填“是”或“不是”)平衡状态,判断的理由是_______ 。 、1molCO和
、1molCO和 通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、
通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、 和
和 平衡时的转化率如图所示,
平衡时的转化率如图所示, 转化率先减小后增大的原因是
转化率先减小后增大的原因是_______ 。
 类似。工业上一般通过
类似。工业上一般通过 或者CO与
或者CO与 反应制取COS,发生的相关反应如下:
反应制取COS,发生的相关反应如下:i.
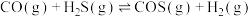
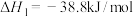
ii.
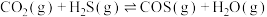
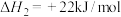
iii.


(1)

(2)COS的中心原子的杂化方式为
(3)在一定温度下,将4molCO和
 通入一固定容积的密闭容器中发生上述反应i。
通入一固定容积的密闭容器中发生上述反应i。①能证明上述反应达到平衡的标志是
A.CO和
 的转化率相等 B.
的转化率相等 B. 的体积分数不再变化
的体积分数不再变化C.混合气体的密度不再变化 D.CO、
 、COS、
、COS、 浓度之比为1:1:1:1
浓度之比为1:1:1:1②上述反应达到平衡后,
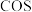 所占的体积分数为12.5%,则该反应的平衡常数为
所占的体积分数为12.5%,则该反应的平衡常数为 ,平衡将
,平衡将(4)将4molCO和
 通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点
通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点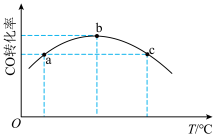
 、1molCO和
、1molCO和 通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、
通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、 和
和 平衡时的转化率如图所示,
平衡时的转化率如图所示, 转化率先减小后增大的原因是
转化率先减小后增大的原因是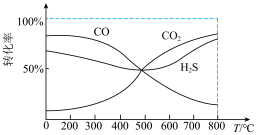
您最近一年使用:0次
【推荐3】氮化硅是一种重要的结构陶瓷材料,具有优良性能。
(1)基态氮原子的电子排布式为___________ ,基态硅原子未成对电子数是___________ ,碳、氮硅的电负性由大到小的顺序是___________ 。
(2)碳热还原法制氮化硅是在氮气中用碳还原SiO2,写出该反应的化学方程式:______________________ 。氮化硅一般不与酸反应,但能与氢氟酸反应,写出氮化硅与过量氢氟酸反应的化学方程式:______________________ 。
(3)三氯硅烷( SiHCl3)也可用于制备氮化硅,三氯硅烷分子的空间构型为___________ ,其分子中硅原子的杂化轨道类型为___________ 。
(4)氮化硅与碳化硅、氮化硼等作用可产生结合材料,改善性能。氮化硅、碳化硅的化学性质都很稳定,其原因是_________________________________ 。
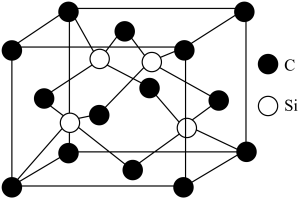
(5)碳化硅立方晶系晶胞如图所示。C-Si-C键的夹角是___________ ,其晶体类型是___________ ,若立方晶系的碳化硅密度为ρg·cm-3,NA表示阿伏伽德罗常数的值,则晶胞的棱长为___________ 。
(1)基态氮原子的电子排布式为
(2)碳热还原法制氮化硅是在氮气中用碳还原SiO2,写出该反应的化学方程式:
(3)三氯硅烷( SiHCl3)也可用于制备氮化硅,三氯硅烷分子的空间构型为
(4)氮化硅与碳化硅、氮化硼等作用可产生结合材料,改善性能。氮化硅、碳化硅的化学性质都很稳定,其原因是
(5)碳化硅立方晶系晶胞如图所示。C-Si-C键的夹角是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】科学家预测21世纪中叶将进入“氢能经济”时代,下列物质都是具有广阔应用前景的储氢材料。回答下列问题:
(1)Zr(锆)在元素周期表中位于第五周期,与钛同族,基态Zr的价层电子排布式为_______ 。
(2)亚氨基锂(Li2NH) 所含元素第一电离能最小的是____ ,电负性最大的是_____ (填元素符号)。
(3)咔唑( )的沸点比芴(
)的沸点比芴( )高的主要原因是
)高的主要原因是________ 。
(4)①NH3BH3 (氨硼烷,熔点104℃)与乙烷互为等电子体。NH3BH3的晶体类型为____ 。其中B的杂化类型为____ ,可通过_________ 测定该分子的立体构型。
②NH3BH3可通过环硼氨烷、CH4与H2O进行合成,键角: CH4______ H2O (填“> "或“<"),原因是________ 。
(5)MgH2晶体属四方品系,结构如图,晶胞参数a =b= 450pm, c= 30lpm,原子坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。

①Mg2+的半径为72pm,则H+的半径为______ pm (列出计算表达式)
②用NA表示阿伏加 德罗常数,MgH2晶体中氢的密度是标准状况下氢气密度的_____ 倍(列出计算表达式,氢气密度为0.089g·L-1)。
(1)Zr(锆)在元素周期表中位于第五周期,与钛同族,基态Zr的价层电子排布式为
(2)亚氨基锂(Li2NH) 所含元素第一电离能最小的是
(3)咔唑(
 )的沸点比芴(
)的沸点比芴( )高的主要原因是
)高的主要原因是(4)①NH3BH3 (氨硼烷,熔点104℃)与乙烷互为等电子体。NH3BH3的晶体类型为
②NH3BH3可通过环硼氨烷、CH4与H2O进行合成,键角: CH4
(5)MgH2晶体属四方品系,结构如图,晶胞参数a =b= 450pm, c= 30lpm,原子坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。

①Mg2+的半径为72pm,则H+的半径为
②用NA表示阿伏加 德罗常数,MgH2晶体中氢的密度是标准状况下氢气密度的
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】钙钛矿的化学成分为CaTiO3,常含钠、铈、铁、铌等。回答下列问题:
(1)基态钛原子的外围电子排布式为_______ 。基态氧原子核外电子占据的能量最高能级的电子云轮廓图是_______ 。
(2)纳米氧化铁常作火箭推进剂NH4ClO4分解的催化剂。 中氯原子的杂化类型是
中氯原子的杂化类型是_____ ,与 互为等电子体的分子有
互为等电子体的分子有_____ (填一种);氯的含氧酸根离子还有 、
、 、ClO-,其中立体构型为三角锥形的离子是
、ClO-,其中立体构型为三角锥形的离子是_______ (填离子符号)。
(3)工业上,冶炼钛的原理为:
TiO2+2Cl2+2C TiCl4+2CO,TiCl4+2Mg
TiCl4+2CO,TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
①Mg的第一电离能大于Al,其原因是_______ 。
②已知四氯化钛在通常情况下是无色液体,熔点为-25 ℃,沸点为136 ℃。四氯化钛的晶体类型是_______ 。
(4)钛的氧化物和氧化钙反应生成CaTiO3,钛的氧化物晶胞如图1所示,CaTiO3晶胞如图2所示。

钛的氧化物的化学式为_____ ;在钛酸钙晶胞中,Ca2+和周围_____ 个O2-等距离且最近。
(5)钠晶胞如图3所示。已知钠离子半径为r nm,则钠晶胞原子空间利用率为____ ;钠晶体的密度为____ g·cm-3(NA表示阿伏加德罗常数的值)。
(1)基态钛原子的外围电子排布式为
(2)纳米氧化铁常作火箭推进剂NH4ClO4分解的催化剂。
 中氯原子的杂化类型是
中氯原子的杂化类型是 互为等电子体的分子有
互为等电子体的分子有 、
、 、ClO-,其中立体构型为三角锥形的离子是
、ClO-,其中立体构型为三角锥形的离子是(3)工业上,冶炼钛的原理为:
TiO2+2Cl2+2C
 TiCl4+2CO,TiCl4+2Mg
TiCl4+2CO,TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2①Mg的第一电离能大于Al,其原因是
②已知四氯化钛在通常情况下是无色液体,熔点为-25 ℃,沸点为136 ℃。四氯化钛的晶体类型是
(4)钛的氧化物和氧化钙反应生成CaTiO3,钛的氧化物晶胞如图1所示,CaTiO3晶胞如图2所示。

钛的氧化物的化学式为
(5)钠晶胞如图3所示。已知钠离子半径为r nm,则钠晶胞原子空间利用率为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】富马酸亚铁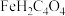 ,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物。其制备的离子方程式为:
,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物。其制备的离子方程式为:

(1) 的核外电子排布式为
的核外电子排布式为_____ 。
(2)富马酸中 原子以
原子以_____ 杂化轨道与 原子形成σ键。
原子形成σ键。
(3)富马酸是无色晶体,在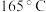 升华,易溶于有机溶剂,其晶体类型为
升华,易溶于有机溶剂,其晶体类型为_____ 。
(4)检验 是否氧化变质,最常用的试剂是
是否氧化变质,最常用的试剂是 。若溶液中有
。若溶液中有 ,加入
,加入 后可观察到的现象是
后可观察到的现象是_____ 。理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸( )的沸点,原因是
)的沸点,原因是_____ 。
(5) 在常温条件下是良好的绝缘体,
在常温条件下是良好的绝缘体, 在高温高压下会金属化,可以作为制富马酸亚铁的原料,
在高温高压下会金属化,可以作为制富马酸亚铁的原料, 晶体的结构如图1所示,其晶胞边长为
晶体的结构如图1所示,其晶胞边长为 ,则
,则 晶体的密度为
晶体的密度为_____  (阿伏加德罗常数的值为
(阿伏加德罗常数的值为 )。
)。

(6)人工制备的 晶体中常存在缺陷(如图2):
晶体中常存在缺陷(如图2):

一个 空缺,另有两个
空缺,另有两个 被两个
被两个 所取代,其结果晶体仍呈电中性,但化合物中
所取代,其结果晶体仍呈电中性,但化合物中 和
和 的比值却发生了变化。已知某氧化铁样品组成
的比值却发生了变化。已知某氧化铁样品组成 ,该晶体中
,该晶体中 与
与 的离子个数之比为
的离子个数之比为_____ 。
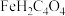 ,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物。其制备的离子方程式为:
,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物。其制备的离子方程式为:
(1)
 的核外电子排布式为
的核外电子排布式为(2)富马酸中
 原子以
原子以 原子形成σ键。
原子形成σ键。(3)富马酸是无色晶体,在
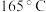 升华,易溶于有机溶剂,其晶体类型为
升华,易溶于有机溶剂,其晶体类型为(4)检验
 是否氧化变质,最常用的试剂是
是否氧化变质,最常用的试剂是 。若溶液中有
。若溶液中有 ,加入
,加入 后可观察到的现象是
后可观察到的现象是 )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸( )的沸点,原因是
)的沸点,原因是(5)
 在常温条件下是良好的绝缘体,
在常温条件下是良好的绝缘体, 在高温高压下会金属化,可以作为制富马酸亚铁的原料,
在高温高压下会金属化,可以作为制富马酸亚铁的原料, 晶体的结构如图1所示,其晶胞边长为
晶体的结构如图1所示,其晶胞边长为 ,则
,则 晶体的密度为
晶体的密度为 (阿伏加德罗常数的值为
(阿伏加德罗常数的值为 )。
)。
(6)人工制备的
 晶体中常存在缺陷(如图2):
晶体中常存在缺陷(如图2):
一个
 空缺,另有两个
空缺,另有两个 被两个
被两个 所取代,其结果晶体仍呈电中性,但化合物中
所取代,其结果晶体仍呈电中性,但化合物中 和
和 的比值却发生了变化。已知某氧化铁样品组成
的比值却发生了变化。已知某氧化铁样品组成 ,该晶体中
,该晶体中 与
与 的离子个数之比为
的离子个数之比为
您最近一年使用:0次



