金是一种用途广泛的贵重金属。某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:
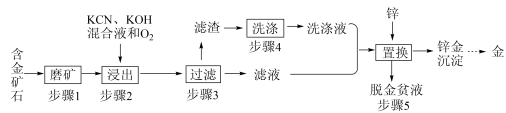
资料:
① Zn + O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2
② Zn2+(aq) Zn(CN)2(s)
Zn(CN)2(s)  Zn(CN)42-(aq)
Zn(CN)42-(aq)
(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) ∆H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) ∆H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的∆H =_______ 。
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是___________ 。

(3)步骤4的目的是_________________ 。
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是________ (填字母序号)。
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为_______________ 。

资料:
① Zn +
 O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2② Zn2+(aq)
 Zn(CN)2(s)
Zn(CN)2(s)  Zn(CN)42-(aq)
Zn(CN)42-(aq)(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) ∆H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) ∆H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的∆H =
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是

(3)步骤4的目的是
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为
2019·北京海淀·一模 查看更多[2]
更新时间:2019-03-27 15:10:07
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】已知下列热化学方程式:
①H2(g)+1/2O2 (g)=H2O (l) △H=-285 kJ/mol
②H2(g) +1/2O2 (g)=H2O(g) △H=-241.8 kJ/mol
③C (s)+1/2O2 (g)=CO(g) △H=-110.5 kJ/mol
④ C (s) +O2 (g)=CO2(g) △H=-393.5 kJ/mol
回答下列问题:
(1)H2的燃烧热为________ ;C的燃烧热为________ 。
(2)燃烧1 g H2生成液态水,放出的热量为________ 。
(3)写出CO燃烧热的热化学方程式__________________________ 。
①H2(g)+1/2O2 (g)=H2O (l) △H=-285 kJ/mol
②H2(g) +1/2O2 (g)=H2O(g) △H=-241.8 kJ/mol
③C (s)+1/2O2 (g)=CO(g) △H=-110.5 kJ/mol
④ C (s) +O2 (g)=CO2(g) △H=-393.5 kJ/mol
回答下列问题:
(1)H2的燃烧热为
(2)燃烧1 g H2生成液态水,放出的热量为
(3)写出CO燃烧热的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Cu2O是一种半导体材料,同时纳米级Cu2O又具有优良的催化性能。
(1)用炭粉在高温条件下还原CuO可得到Cu2O,已知:
2Cu(s)+ O2(g)=Cu2O(s) △H=−169kJ/mol
O2(g)=Cu2O(s) △H=−169kJ/mol
C(s)+ O2(g)=CO(g) △H=−110.5kJ/mol
O2(g)=CO(g) △H=−110.5kJ/mol
Cu(s)+ O2(g)=CuO(s) △H=−157kJ/mol
O2(g)=CuO(s) △H=−157kJ/mol
则该反应的热化学方程式为_______________ 。
(2)利用电解装置也可以制取Cu2O。

①铜是_______ 极,其电极反应式为_______ 。
②电池的总反应为_______ 。
③石墨电极附近的pH_______ 。(增大、减小、不变)
④当电路中有0.1mol电子通过时,生成Cu2O_______ g。
(1)用炭粉在高温条件下还原CuO可得到Cu2O,已知:
2Cu(s)+
 O2(g)=Cu2O(s) △H=−169kJ/mol
O2(g)=Cu2O(s) △H=−169kJ/molC(s)+
 O2(g)=CO(g) △H=−110.5kJ/mol
O2(g)=CO(g) △H=−110.5kJ/mol Cu(s)+
 O2(g)=CuO(s) △H=−157kJ/mol
O2(g)=CuO(s) △H=−157kJ/mol则该反应的热化学方程式为
(2)利用电解装置也可以制取Cu2O。

①铜是
②电池的总反应为
③石墨电极附近的pH
④当电路中有0.1mol电子通过时,生成Cu2O
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】I.以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)=2NH3(g) ΔH1=-92.4 kJ·mol-1
②NH3(g)+ CO2(g)=
CO2(g)= NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1
NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·mol-1
(1)则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______ 。
II.一定条件下,在容积为5L的密闭容器中,发生反应A(g)+2B(g) 2C(g),已知达平衡后,降低温度,A的体积分数减小。
2C(g),已知达平衡后,降低温度,A的体积分数减小。
(2)该反应的反应速率v随时间t的关系如图乙所示。
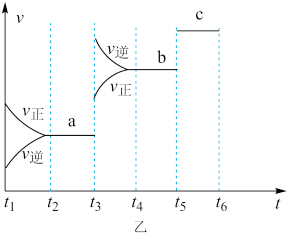
①根据图乙判断,在t3时刻改变的外界条件是_______ 。
②a、b、c对应的平衡状态中,C的体积分数最大的是状态_______ 。
③各阶段的平衡常数如表所示:
K1、K2、K3之间的大小关系为_______ (用“>”“<”或“=”连接)。
III.在密闭容器中充入一定量的H2S,发生反应:2H2S(g) 2H2(g)+S2(g) ΔH,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
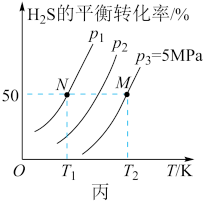
(3)ΔH_______ (填“>”“<”“=”)0。
(4)图丙中压强(p1、p2、p3)的大小顺序为_______ 。
(5)图丙中M点对应的平衡常数Kp=_______ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(6)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有_______ 。
①N2(g)+3H2(g)=2NH3(g) ΔH1=-92.4 kJ·mol-1
②NH3(g)+
 CO2(g)=
CO2(g)= NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1
NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1③NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·mol-1
(1)则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为
II.一定条件下,在容积为5L的密闭容器中,发生反应A(g)+2B(g)
 2C(g),已知达平衡后,降低温度,A的体积分数减小。
2C(g),已知达平衡后,降低温度,A的体积分数减小。(2)该反应的反应速率v随时间t的关系如图乙所示。

①根据图乙判断,在t3时刻改变的外界条件是
②a、b、c对应的平衡状态中,C的体积分数最大的是状态
③各阶段的平衡常数如表所示:
| t2~t3 | t4~t5 | t5~t6 |
| K1 | K2 | K3 |
K1、K2、K3之间的大小关系为
III.在密闭容器中充入一定量的H2S,发生反应:2H2S(g)
 2H2(g)+S2(g) ΔH,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
(3)ΔH
(4)图丙中压强(p1、p2、p3)的大小顺序为
(5)图丙中M点对应的平衡常数Kp=
(6)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是________ 。
(2)圆底烧瓶中所发生反应的离子方程式为___________ 。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是___________ 。
(4)利用该化学反应,试简述测定反应速率的其他方法:________ (写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2Na2S2O3= Na2S4O6+2NaI,其中Na2S2O3溶液均足量)
(5)表中Vx=______ mL,T1、T2、T3的大小关系是_________ 。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是
(2)圆底烧瓶中所发生反应的离子方程式为
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是
(4)利用该化学反应,试简述测定反应速率的其他方法:
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2Na2S2O3= Na2S4O6+2NaI,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某实验小组采用下列实验探究外界条件对化学反应速率及其化学平衡的影响。按要求回答下列问题:
I.室温下,向盛有5mL0.005mol/LFeCl3溶液的试管中加入5mL0.01mol/L的KSCN溶液,溶液变为___ 色。发生反应的离子方程式为___ 。
现将上述溶液均分为两份置于甲、乙两支试管中;
(1)向甲试管中加入4滴饱和FeCl3溶液,平衡___ (填“正向移动”、“逆向移动”或“不移动”);溶液中的Fe3+浓度c(Fe3+)___ (填“增大”、“减小”或“不变”,下同),重新达到平衡时Fe3+转化率___ ,该条件下反应的平衡常数___ 。
(2)向乙试管中加入KCl固体,平衡___ (填“正向移动”、“逆向移动”或“不移动”)。
II.该实验小组还利用0.1mol·L-1Na2S2O3溶液和0.1mol·L-1H2SO4溶液为反应物,探究外界条件对化学反应速率的影响,实验记录如表。请结合表中信息,回答有关问题:
(3)该反应的离子方程式为___ 。
(4)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是___ (填实验序号,下同);
②实验Ⅱ和III探究的是___ (填外部因素)对化学反应速率的影响,其中实验III中a=___ 。
I.室温下,向盛有5mL0.005mol/LFeCl3溶液的试管中加入5mL0.01mol/L的KSCN溶液,溶液变为
现将上述溶液均分为两份置于甲、乙两支试管中;
(1)向甲试管中加入4滴饱和FeCl3溶液,平衡
(2)向乙试管中加入KCl固体,平衡
II.该实验小组还利用0.1mol·L-1Na2S2O3溶液和0.1mol·L-1H2SO4溶液为反应物,探究外界条件对化学反应速率的影响,实验记录如表。请结合表中信息,回答有关问题:
| 实验序号 | 反应温度 | V(Na2S2O3) | V(H2SO4) | V(H2O) | 出现沉淀所需的时间 |
| Ⅰ | 0℃ | 5mL | 5mL | 10mL | 12s |
| Ⅱ | 30℃ | 5mL | 10mL | 5mL | 8s |
| Ⅲ | 30℃ | 5mL | 7mL | amL | 10s |
| Ⅳ | 30℃ | 5mL | 5mL | 10mL | 4s |
(4)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是
②实验Ⅱ和III探究的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】一种以废旧镍氢电池[含 、NiOOH、Co、
、NiOOH、Co、 等]为原料,制取Ni/C纳米复合材料同时获得钴氧化物的工艺流程图如下:
等]为原料,制取Ni/C纳米复合材料同时获得钴氧化物的工艺流程图如下:

已知:ⅰ.Ni在水溶液中通常只以 的形式存在。
的形式存在。
ⅱ.常温下有关氢氧化物开始沉淀和沉淀完全的pH如下表:
ⅲ.在溶液中存在氨的条件下, 可转化为
可转化为 ,
, 是一种优良的配体。
是一种优良的配体。
(1)浸出过程中能加快反应速率的措施有_________ (至少写出两种)。
(2)浸出过程中 与NiOOH反应的离子方程式是
与NiOOH反应的离子方程式是_________ 。研究表明 用量为5mL/g时,
用量为5mL/g时, 浓度与镍、钴浸出率关系如图所示:
浓度与镍、钴浸出率关系如图所示:

镍、钴浸出过程中 最佳浓度为
最佳浓度为_________ mol∙L−1。
(3)滤液1中加入 的目的是
的目的是_________ ;用氨水调节pH至5~7的目的是_________ 。
(4)滤液2中加入 的作用有:沉淀
的作用有:沉淀 、
、_________ 、_________ 。
(5)取滤渣1的煅烧产物2.41g溶于100mL盐酸(此时溶液中Co以 形式存在),用火焰原子吸收光谱法测得该溶液中
形式存在),用火焰原子吸收光谱法测得该溶液中 浓度为0.3 mol∙L−1,则
浓度为0.3 mol∙L−1,则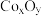 化学式是
化学式是_________ 。
 、NiOOH、Co、
、NiOOH、Co、 等]为原料,制取Ni/C纳米复合材料同时获得钴氧化物的工艺流程图如下:
等]为原料,制取Ni/C纳米复合材料同时获得钴氧化物的工艺流程图如下:
已知:ⅰ.Ni在水溶液中通常只以
 的形式存在。
的形式存在。ⅱ.常温下有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | 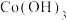 |  |  |
| 开始沉淀的pH | \ | 7.1 | 7.7 |
| 沉淀完全的pH | 1.1 | 9.1 | 9.2 |
ⅲ.在溶液中存在氨的条件下,
 可转化为
可转化为 ,
, 是一种优良的配体。
是一种优良的配体。(1)浸出过程中能加快反应速率的措施有
(2)浸出过程中
 与NiOOH反应的离子方程式是
与NiOOH反应的离子方程式是 用量为5mL/g时,
用量为5mL/g时, 浓度与镍、钴浸出率关系如图所示:
浓度与镍、钴浸出率关系如图所示:
镍、钴浸出过程中
 最佳浓度为
最佳浓度为(3)滤液1中加入
 的目的是
的目的是(4)滤液2中加入
 的作用有:沉淀
的作用有:沉淀 、
、(5)取滤渣1的煅烧产物2.41g溶于100mL盐酸(此时溶液中Co以
 形式存在),用火焰原子吸收光谱法测得该溶液中
形式存在),用火焰原子吸收光谱法测得该溶液中 浓度为0.3 mol∙L−1,则
浓度为0.3 mol∙L−1,则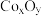 化学式是
化学式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室里需要纯净的NaCl溶液,但现在只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。

(已知:NH4HCO3 NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
如果此方案正确,回答下列问题:
(1)操作①可选择的主要仪器是____________ 、____________ 。
(2)操作②不用硝酸钡溶液,其理由是__________________________________________ 。
(3)进行操作②后,如何判断SO42− 已除尽,方法是_________________________ 。
(4)操作③的目的是________________ 。
(5)操作④的目的是__________________________________________________ 。

(已知:NH4HCO3
 NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)如果此方案正确,回答下列问题:
(1)操作①可选择的主要仪器是
(2)操作②不用硝酸钡溶液,其理由是
(3)进行操作②后,如何判断SO42− 已除尽,方法是
(4)操作③的目的是
(5)操作④的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。

(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为___________ 。检验溶液中的Fe3+所用试剂是___________ ,其现象是___________ 。
(2)步骤④的实验操作名称是___________ ,该实验操作用到的玻璃仪器有___________ 。
(3)步骤⑤的化学方程式是___________ 。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰(MnSO4),则反应的离子方程式为___________ 。
(5)若用惰性电极对生产过程中的废液进行电解实验,阳极反应式___________ 。

(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为
(2)步骤④的实验操作名称是
(3)步骤⑤的化学方程式是
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰(MnSO4),则反应的离子方程式为
(5)若用惰性电极对生产过程中的废液进行电解实验,阳极反应式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硫酸镍广泛应用于电镀、催化、医药等行业中,具有很高的经济价值。一种用含镍废催化剂(主要含 、C,还含有铝、铁的单质及氧化物,和少量有机物)为原料制备
、C,还含有铝、铁的单质及氧化物,和少量有机物)为原料制备 的工艺流程如下:
的工艺流程如下:
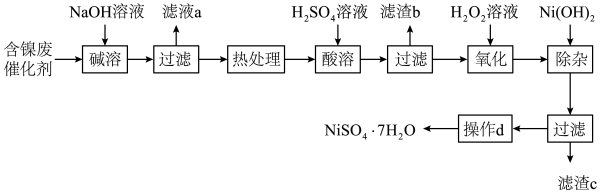
部分阳离子以氢氧化物形式沉淀时的 如下:
如下:
回答下列问题:
(1)滤液a中溶质的主要成分除 外,还含有
外,还含有_________________ (填化学式)。
(2)酸溶前需进行“热处理”的主要目的是____________ ;滤渣b主要成分是________ (填化学式)。
(3)加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_______ ;简述加入 除杂的原理
除杂的原理_______ 。
(4)操作d为________ 、过滤、洗涤、干燥;产品晶体中有时会混有少量 ,其原因可能是
,其原因可能是__________ 。(写出一点即可)
(5)取ag上述流程制得的硫酸镍晶体样品溶于蒸馏水中,在不断搅拌下缓慢加入足量丁二酮肟溶液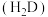 ,再加入
,再加入 溶液调节溶液的
溶液调节溶液的 在8~9,充分反应后,过滤、洗涤、烘干、称量得到红色固体质量为bg。发生反应的方程式为
在8~9,充分反应后,过滤、洗涤、烘干、称量得到红色固体质量为bg。发生反应的方程式为 (红色)
(红色) ,已知
,已知 相对分子质量为M,列式计算样品纯度为
相对分子质量为M,列式计算样品纯度为_________ 。
 、C,还含有铝、铁的单质及氧化物,和少量有机物)为原料制备
、C,还含有铝、铁的单质及氧化物,和少量有机物)为原料制备 的工艺流程如下:
的工艺流程如下:
部分阳离子以氢氧化物形式沉淀时的
 如下:
如下:| 沉淀物 | 开始沉淀时的 | 完全沉淀时的 |
 | 2.7 | 3.2 |
 | 7.6 | 9.7 |
 | 7.1 | 9.2 |
回答下列问题:
(1)滤液a中溶质的主要成分除
 外,还含有
外,还含有(2)酸溶前需进行“热处理”的主要目的是
(3)加入
 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为 除杂的原理
除杂的原理(4)操作d为
 ,其原因可能是
,其原因可能是(5)取ag上述流程制得的硫酸镍晶体样品溶于蒸馏水中,在不断搅拌下缓慢加入足量丁二酮肟溶液
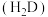 ,再加入
,再加入 溶液调节溶液的
溶液调节溶液的 在8~9,充分反应后,过滤、洗涤、烘干、称量得到红色固体质量为bg。发生反应的方程式为
在8~9,充分反应后,过滤、洗涤、烘干、称量得到红色固体质量为bg。发生反应的方程式为 (红色)
(红色) ,已知
,已知 相对分子质量为M,列式计算样品纯度为
相对分子质量为M,列式计算样品纯度为
您最近一年使用:0次



