以氮化镓(GaN)为首的第三代半导体材料适合于制作高温、高频、抗辐射及大功率器件,通常也称为高温半导体材料。回答下列问题:
(1)基态Ga原子价层电子的电子排布图为______ ;第二周期中,第一电离能介于N和B之间的元素有______ 种。
(2)HCN分子中σ键与π键的数目之比为______ ,其中σ键的对称方式为______ 。与CN-互为等电子体的一种分子为______ 。
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子与CO2互为等电子体,阴离子中心原子的杂化轨道类型为______ 。NF3的空间构型为______ 。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因______ 。
(5)GaN晶胞结构如图1所示。已知六棱柱底边边长为a cm,阿伏伽德罗常数的值为NA。
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为______ ;
②从GaN晶体中“分割”出的平行六面体如图2。若该平行六面体的体积为 a3cm3,GaN晶体的密度为
a3cm3,GaN晶体的密度为______ g/cm3(用a、NA表示)。
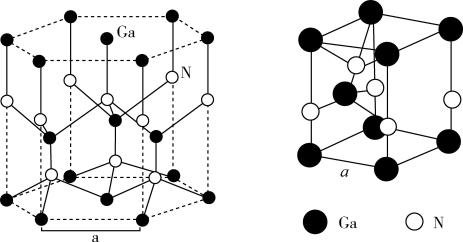
图1 图2
(1)基态Ga原子价层电子的电子排布图为
(2)HCN分子中σ键与π键的数目之比为
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子与CO2互为等电子体,阴离子中心原子的杂化轨道类型为
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如图1所示。已知六棱柱底边边长为a cm,阿伏伽德罗常数的值为NA。
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为
②从GaN晶体中“分割”出的平行六面体如图2。若该平行六面体的体积为
 a3cm3,GaN晶体的密度为
a3cm3,GaN晶体的密度为
图1 图2
更新时间:2019-04-13 09:49:32
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为__ ,该电子层具有的原子轨道数为__ 。
②LiBH4由Li+和BH4-构成,BH4-的立体构型是__ ,B原子的杂化轨道类型是___ 。
③Li、B元素的电负性由小到大的顺序为___ 。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__ H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是__ 族元素。
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“ ”分别标明B与N的相对位置
”分别标明B与N的相对位置___ 。

(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为__ ,NaH的理论密度是__ g·cm-3(保留3个有效数字)。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为
②LiBH4由Li+和BH4-构成,BH4-的立体构型是
③Li、B元素的电负性由小到大的顺序为
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“
 ”分别标明B与N的相对位置
”分别标明B与N的相对位置
(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】UO2与铀氮化物是重要的核燃料,已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑;回答下列问题:
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑;回答下列问题:
(1)反应所得气态化合物中属于非极性分子的是_______ (填化学式)。
(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是________ (填标号)。

a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(3)依据VSEPR理论推测 的空间构型为
的空间构型为_________ 。分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ),则
),则 中的大π键应表示为
中的大π键应表示为_____ 。
(4)UO2可用于制备UF4:2UO2+5NH4HF2 2UF4·2NH4F+3NH3↑+4H2O,其中
2UF4·2NH4F+3NH3↑+4H2O,其中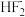 的结构表示为[F—H…F]-,反应中断裂的化学键有
的结构表示为[F—H…F]-,反应中断裂的化学键有_______ (填标号)。
a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
(5)铀氮化物的某两种晶胞如图所示:

①晶胞a中铀元素的化合价为__________ ,与U距离相等且最近的U有_______ 个。
②已知晶胞b的密度为dg/cm3,U原子的半径为r1cm,N原子的半径为为r2cm,设NA为阿伏加 德罗常数的值,则该晶胞的空间利用率为___________ (列出计算式)。
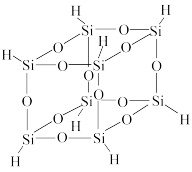
(6)氢基倍半硅氧烷的分子结构如图所示,该分子的分子式为______
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑;回答下列问题:
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑;回答下列问题:(1)反应所得气态化合物中属于非极性分子的是
(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是

a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(3)依据VSEPR理论推测
 的空间构型为
的空间构型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ),则
),则 中的大π键应表示为
中的大π键应表示为(4)UO2可用于制备UF4:2UO2+5NH4HF2
 2UF4·2NH4F+3NH3↑+4H2O,其中
2UF4·2NH4F+3NH3↑+4H2O,其中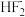 的结构表示为[F—H…F]-,反应中断裂的化学键有
的结构表示为[F—H…F]-,反应中断裂的化学键有a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
(5)铀氮化物的某两种晶胞如图所示:

①晶胞a中铀元素的化合价为
②已知晶胞b的密度为dg/cm3,U原子的半径为r1cm,N原子的半径为为r2cm,设NA为阿伏加 德罗常数的值,则该晶胞的空间利用率为
(6)氢基倍半硅氧烷的分子结构如图所示,该分子的分子式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态Ni2+的价层电子轨道表达式为___________ ,C、N、O的第一电离能从小到大的顺序为___________ 。
(2)N、P可形成一些复杂离子,如(CH3)3NH+、NO 、PCl
、PCl 等。(CH3)3NH+ 中N原子的杂化类型为
等。(CH3)3NH+ 中N原子的杂化类型为___________ ,NO 的空间构型为
的空间构型为___________ 。
(3)Fe、Ni易与CO形成配合物,Fe(CO)5中σ键与π键个数比为___________ ,Ni(CO)4熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,Ni(CO)4为___________ 晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
① 熔点FeO___________ NiO(填“>”、“<”或“=”)。
② FeO 晶胞如下图,Fe2+的配位数为___________ 。

③ FeO在氧气中加热,部分Fe2+被氧化为Fe3+,晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为a cm,密度为⍴g·cm-3,则x=___________ 。
(1)基态Ni2+的价层电子轨道表达式为
(2)N、P可形成一些复杂离子,如(CH3)3NH+、NO
 、PCl
、PCl 等。(CH3)3NH+ 中N原子的杂化类型为
等。(CH3)3NH+ 中N原子的杂化类型为 的空间构型为
的空间构型为(3)Fe、Ni易与CO形成配合物,Fe(CO)5中σ键与π键个数比为
(4)FeO、NiO的晶体类型与结构和NaCl相同。
① 熔点FeO
② FeO 晶胞如下图,Fe2+的配位数为

③ FeO在氧气中加热,部分Fe2+被氧化为Fe3+,晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为a cm,密度为⍴g·cm-3,则x=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】铜是人类知道最早的金属之一,也是广泛使用的第一种金属。回答下列问题:
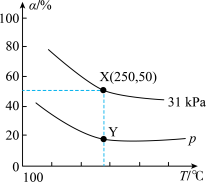
(1)镍白铜(铜镍合金)可用于制作仿银饰品。第二电离能I2(Cu)___________ (填“>”或“<”)I2(Ni),其原因为___________ 。
(2)向[Cu(NH3)2]Cl溶液中通入乙炔(C2H2)气体,可生成红棕色沉淀Cu2C2。
①C2H2分子中σ键与π键的数目之比为___________ ;碳原子的杂化方式为___________ ;
②写出与Cu2C2中阴离子C 互为等电子体的一种分子:
互为等电子体的一种分子:___________ 。
(3)在弱碱性环境中,EDTA( )易与Cu2+形成如图所示配离子,常用于Cu2+的定量测定。
)易与Cu2+形成如图所示配离子,常用于Cu2+的定量测定。
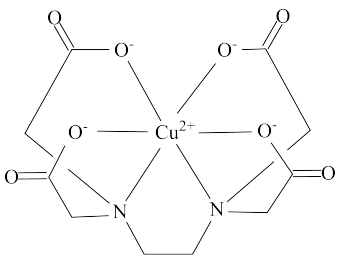
①1mol该配离子中配体数目为___________ (阿伏加德罗常数的值为NA)。
②EDTA能溶于水的原因为___________ 。
(4)铜与氧构成的某种化合物的立方晶胞如图甲所示,图乙是沿晶胞对角面取得的截图,晶胞中所有原子均在对角面上。该化合物的化学式为___________ ,若Cu原子之间最短距离为dpm,阿伏加德罗常数的值为NA,该晶体的密度为___________ g•cm-3(列出计算式即可)。

(1)镍白铜(铜镍合金)可用于制作仿银饰品。第二电离能I2(Cu)
(2)向[Cu(NH3)2]Cl溶液中通入乙炔(C2H2)气体,可生成红棕色沉淀Cu2C2。
①C2H2分子中σ键与π键的数目之比为
②写出与Cu2C2中阴离子C
 互为等电子体的一种分子:
互为等电子体的一种分子:(3)在弱碱性环境中,EDTA(
 )易与Cu2+形成如图所示配离子,常用于Cu2+的定量测定。
)易与Cu2+形成如图所示配离子,常用于Cu2+的定量测定。
①1mol该配离子中配体数目为
②EDTA能溶于水的原因为
(4)铜与氧构成的某种化合物的立方晶胞如图甲所示,图乙是沿晶胞对角面取得的截图,晶胞中所有原子均在对角面上。该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】钠、铁、铜、锌的单质及其化合物在生产、生活中有着广泛的应用。回答下列相关问题:
(1)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如图所示,则A的化学式是_______ 。
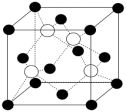
(2)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色[Cu(NH3)4]SO4·H2O沉淀。
①写出上述实验前两步反应的离子方程式_______ ,_______ 。
②与NH3分子互为等电子体的一种阳离子是_______ 。
③在晶体[Cu(NH3)4]SO4·H2O中,中心原子是sp3杂化的原子有_______ (写元素符号)。 其晶体结构中存在的化学键有_______ 。
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
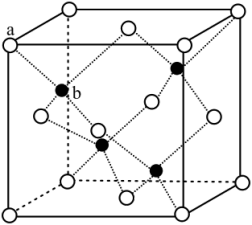
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置的Fe或者b位置的Fe,形成 替代型产物Fe(x-n)CunNy。FexNy转化为两种
替代型产物Fe(x-n)CunNy。FexNy转化为两种 替代型产物的能量变化如2所示,其中更稳定的
替代型产物的能量变化如2所示,其中更稳定的 替代型产物的化学式为
替代型产物的化学式为_______ 。
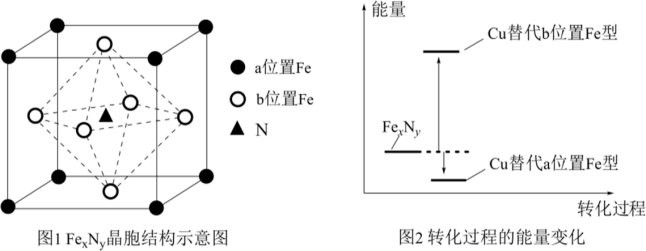
(4)Zn在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0pm,密度为_______ g·cm-3(列式并计算),a位置S2-与b位置Zn2+之间的距离为_______ pm。
(1)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如图所示,则A的化学式是

(2)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色[Cu(NH3)4]SO4·H2O沉淀。
①写出上述实验前两步反应的离子方程式
②与NH3分子互为等电子体的一种阳离子是
③在晶体[Cu(NH3)4]SO4·H2O中,中心原子是sp3杂化的原子有
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置的Fe或者b位置的Fe,形成
 替代型产物Fe(x-n)CunNy。FexNy转化为两种
替代型产物Fe(x-n)CunNy。FexNy转化为两种 替代型产物的能量变化如2所示,其中更稳定的
替代型产物的能量变化如2所示,其中更稳定的 替代型产物的化学式为
替代型产物的化学式为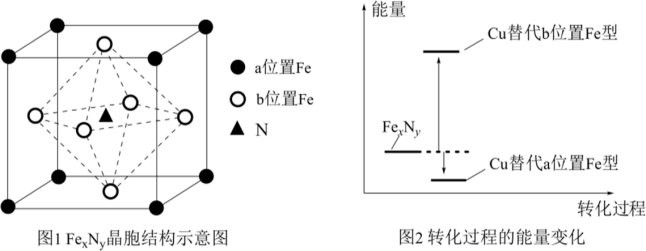
(4)Zn在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0pm,密度为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】近日,科学家开发新型催化剂实现 对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:
对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:
反应l:
反应2:
(1) 的空间构型为
的空间构型为___________ 。
(2)在特定温度下,由稳定态单质生成lmol化合物的焓变叫该物质在此温度下的标准生成焓( )。稳定态单质的标准生成焓为0kJ/mol,下表为几种化合物在298K的标准生成焓数据:
)。稳定态单质的标准生成焓为0kJ/mol,下表为几种化合物在298K的标准生成焓数据:

___________ kJ/mol。
(3)某温度下,向恒压密闭容器中充入 和
和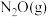 ,发生上述反应1和反应2,测得平衡体系中
,发生上述反应1和反应2,测得平衡体系中 的体积分数与起始投料比
的体积分数与起始投料比 的关系如下图所示,
的关系如下图所示, 体积分数最大值小于50%的原因是
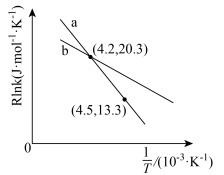
体积分数最大值小于50%的原因是___________ 。 (R、C为常数,T为热力学温度,k为速率常数,
(R、C为常数,T为热力学温度,k为速率常数, 为活化能)。测得反应1在不同条件下,Rlnk与温度的倒数关系如图所示,在a条件下,该反应的活化能
为活化能)。测得反应1在不同条件下,Rlnk与温度的倒数关系如图所示,在a条件下,该反应的活化能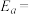
___________ kJ/mol,当改变外界条件时,实验数据如图中的曲线b所示,则实验改变的外界条件可能是___________ 。 ,发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如上图所示,X点时丁酮的选择性为
,发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如上图所示,X点时丁酮的选择性为 ,
,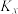 是以物质的量分数表示的平衡常数,则反应2在Y点的物质的量分数平衡常数
是以物质的量分数表示的平衡常数,则反应2在Y点的物质的量分数平衡常数
___________ (用分数表示)。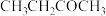 的选择性
的选择性 ]
]
(6)以熔融碳酸盐(如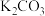 )为电解质,丁烯(
)为电解质,丁烯( )/空气燃料电池的能量转化率较高。电池总反应为
)/空气燃料电池的能量转化率较高。电池总反应为 ,则负极的电极方程式为
,则负极的电极方程式为___________ 。
 对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:
对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:反应l:

反应2:

(1)
 的空间构型为
的空间构型为(2)在特定温度下,由稳定态单质生成lmol化合物的焓变叫该物质在此温度下的标准生成焓(
 )。稳定态单质的标准生成焓为0kJ/mol,下表为几种化合物在298K的标准生成焓数据:
)。稳定态单质的标准生成焓为0kJ/mol,下表为几种化合物在298K的标准生成焓数据:| 物质 |  | 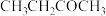 |  |  |
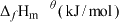 | a | b | c | d |

(3)某温度下,向恒压密闭容器中充入
 和
和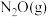 ,发生上述反应1和反应2,测得平衡体系中
,发生上述反应1和反应2,测得平衡体系中 的体积分数与起始投料比
的体积分数与起始投料比 的关系如下图所示,
的关系如下图所示, 体积分数最大值小于50%的原因是
体积分数最大值小于50%的原因是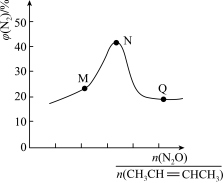
 (R、C为常数,T为热力学温度,k为速率常数,
(R、C为常数,T为热力学温度,k为速率常数, 为活化能)。测得反应1在不同条件下,Rlnk与温度的倒数关系如图所示,在a条件下,该反应的活化能
为活化能)。测得反应1在不同条件下,Rlnk与温度的倒数关系如图所示,在a条件下,该反应的活化能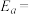
 ,发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如上图所示,X点时丁酮的选择性为
,发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如上图所示,X点时丁酮的选择性为 ,
,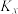 是以物质的量分数表示的平衡常数,则反应2在Y点的物质的量分数平衡常数
是以物质的量分数表示的平衡常数,则反应2在Y点的物质的量分数平衡常数
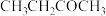 的选择性
的选择性 ]
](6)以熔融碳酸盐(如
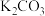 )为电解质,丁烯(
)为电解质,丁烯( )/空气燃料电池的能量转化率较高。电池总反应为
)/空气燃料电池的能量转化率较高。电池总反应为 ,则负极的电极方程式为
,则负极的电极方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼原子的价电子排布图为____________ 。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________ 。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B__________ N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的杂化类型为________ 。
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是________ ;写出制备反应的化学方程式:____________ 。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。

①磷化硼晶体属于______________ 晶体(填晶体类型),____________ (填“是”或“否”)含有配位键。
②晶体中P原子的配位数为____________ 。
③已知BP的晶胞边长为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度为____________ g·cm-3(用含a、NA的式子表示)。
(1)硼原子的价电子排布图为
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。

①磷化硼晶体属于
②晶体中P原子的配位数为
③已知BP的晶胞边长为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】铁氧体是一种磁性材料,具有广泛的应用。
(1)铁元素位于元素周期表的_________ 区,其基态原子有___________ 种能量不同的电子。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是________ ,醋酸钠中碳原子的杂化类型是_______ 。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解, 的结构式为
的结构式为___________ (标出配位键),与 互为等电子体的分子有
互为等电子体的分子有____________ (任写一种)。铵盐大多不稳定,NH4F、NH4I中,较易分解的是_______________ 。
(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。
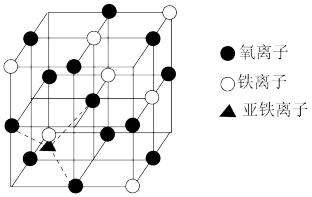
①晶胞中亚铁离子处于氧离子围成的_______________ (填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为______ 。
③解释Fe3O4晶体能导电的原因_________ ;若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为_____________ g·cm-3(阿伏加 德罗常数用NA表示)。
(1)铁元素位于元素周期表的
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,
 的结构式为
的结构式为 互为等电子体的分子有
互为等电子体的分子有(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。

①晶胞中亚铁离子处于氧离子围成的
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为
③解释Fe3O4晶体能导电的原因
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置______ 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______ (填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=______ 。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有_______________ 。
(3)k3[Fe(CN)6]溶液可用于检验____ (填离子符号)。CN-中碳原子杂化轨道类型为____ ,C、N、O三元素的第一电离能由大到小的顺序为___ (用元素符号表示)。
(4)铜晶体铜碳原子的堆积方式如图所示。

①基态铜原子的核外电子排布式为___________ 。
②每个铜原子周围距离最近的铜原子数目_______ 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
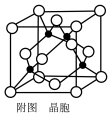
①该晶体的化学式为___________ 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于____ (填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为
cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_____ pm(只写计算式)。
(1)铁在元素周期表中的位置
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
 Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有(3)k3[Fe(CN)6]溶液可用于检验
(4)铜晶体铜碳原子的堆积方式如图所示。

①基态铜原子的核外电子排布式为
②每个铜原子周围距离最近的铜原子数目
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于
③已知该晶体的密度为ρg
 cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为
cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为
您最近一年使用:0次
【推荐1】A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ·mol―1):
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显_______ 价,D显_______ 价;
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含___ 个σ键,___ 个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是________________________
(4)E能与AB形成配合物,其中E提供______________ ,AB提供_________ 。
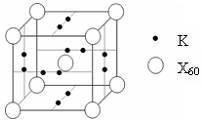
(5)下列晶胞中,阳离子与阴离子的个数为_______________
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是
| 单键 | 双键 | 叁键 | ||
| AB | 键能(kJ·mol―1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ·mol―1) | 154.8 | 418.4 | 941.7 |
(4)E能与AB形成配合物,其中E提供
(5)下列晶胞中,阳离子与阴离子的个数为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】公元前,人们曾用硼砂制造玻璃和焊接黄金。现如今硼及其化合物在新材料、功能生产等方面用途依然很广。请回答下列问题:
(1)硼元素的基态原子的价电子排布为___________ ,同周期元素中,未成对电子数与B相同的有___________ (填元素符号);第一电离能在B与N之间的第二周期主族元素有___________ 种。
(2)硼的最简单氢化物-乙硼烷分子中存在两个氢桥键(3中心2电子键),球棍模型如图,由它制取硼氢化锂的反应为 。
。

①乙硼烷分子中硼原子的杂化轨道类型为___________ 。写出一种与 具有相同空间构型的阳离子的化学式为
具有相同空间构型的阳离子的化学式为___________ 。
②根据以上反应判断,其中涉及的元素的电负性从小到大的顺序为___________ (用元素符号表示)。
③硼的最简单氢化物是 而不是
而不是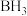 ,其原因是
,其原因是___________ 。
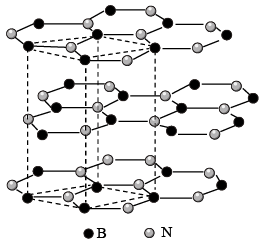
(3)六方氮化硼( )的晶体结构与石墨相似,如图所示。同层
)的晶体结构与石墨相似,如图所示。同层 原子与
原子与 原子最小核间距为
原子最小核间距为 ,相邻层间的距离为
,相邻层间的距离为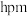 ,该晶体的密度计算式为
,该晶体的密度计算式为___________  (用含d、h、NA的代数式表示)。
(用含d、h、NA的代数式表示)。
(1)硼元素的基态原子的价电子排布为
(2)硼的最简单氢化物-乙硼烷分子中存在两个氢桥键(3中心2电子键),球棍模型如图,由它制取硼氢化锂的反应为
 。
。
①乙硼烷分子中硼原子的杂化轨道类型为
 具有相同空间构型的阳离子的化学式为
具有相同空间构型的阳离子的化学式为②根据以上反应判断,其中涉及的元素的电负性从小到大的顺序为
③硼的最简单氢化物是
 而不是
而不是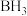 ,其原因是
,其原因是(3)六方氮化硼(
 )的晶体结构与石墨相似,如图所示。同层
)的晶体结构与石墨相似,如图所示。同层 原子与
原子与 原子最小核间距为
原子最小核间距为 ,相邻层间的距离为
,相邻层间的距离为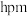 ,该晶体的密度计算式为
,该晶体的密度计算式为 (用含d、h、NA的代数式表示)。
(用含d、h、NA的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】铝试剂:(NH4)3C19H8(OH)3(COO)3,其商品名为阿罗明拿,可用来鉴定溶液中的铝离子。请回答下列问题:
(1)碳原子价层电子的电子排布图_______ 。
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是____________ ;氮元素的第一电离能呈现异常的原因是____ 。
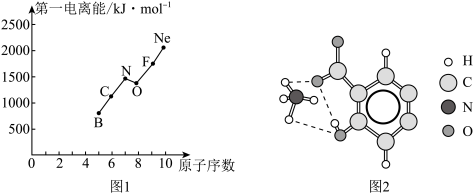
(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为_________ ,不同之处为_________ 。(填标号)
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为_______ 个。分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________ 。
③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、____________ 、____________ 。
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为______________ (NA表示阿伏加 德罗常数的值)。
(1)碳原子价层电子的电子排布图
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是

(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为
您最近一年使用:0次



