下图是无机物 A~J在一定条件下的转化关系(部分产物及反应条件未列出)。其中C为红棕色气体;H和I是两种常见的金属单质;过量I与 D溶液反应生成A。
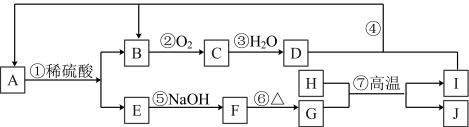
请填写下列空白:
(1)H元素在周期表中的位置是________ ;写出①的离子反应方程式:_________ ;检验E溶液中阳离子的最佳试剂为________ 。
(2)这类反应常用于冶炼高熔点的金属。用MnO2冶炼金属锰的反应中氧化剂与还原剂的物质的量之比为__________ 。
(3)SCR技术处理机动车尾气时,在催化条件下利用氨气与C反应,生成无污染的物质。发生反应的化学方程式为__________ 。
(4)F与NaClO、NaOH溶液反应,可制得一种“绿色”高效净水剂K2FeO4。每生成1molFeO42-时转移____________ mol电子。

请填写下列空白:
(1)H元素在周期表中的位置是
(2)这类反应常用于冶炼高熔点的金属。用MnO2冶炼金属锰的反应中氧化剂与还原剂的物质的量之比为
(3)SCR技术处理机动车尾气时,在催化条件下利用氨气与C反应,生成无污染的物质。发生反应的化学方程式为
(4)F与NaClO、NaOH溶液反应,可制得一种“绿色”高效净水剂K2FeO4。每生成1molFeO42-时转移
更新时间:2019-04-20 14:48:01
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)一定条件下,将SO2通入TeOSO4溶液中,反应一段时间后过滤、洗涤得到粗Te。
①SO2还原TeOSO4溶液得到Te的反应中,n(TeOSO4):n(SO2)=___________ 。
②洗涤沉淀的具体操作为___________ 。
③过程中须控制反应温度为80℃,适宜的加热方式为___________ ;
(2)工业上采用H2催化还原SO2,不仅可以消除SO2污染,还可得到有价值的单质S。反应分两步完成,第一步反应为3H2+SO2 H2S+2H2O,第二步反应方程式为
H2S+2H2O,第二步反应方程式为___________ 。
(3)工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2。
①在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中含有Cl-等阴离子,则脱硫反应的离子方程式为___________ 。
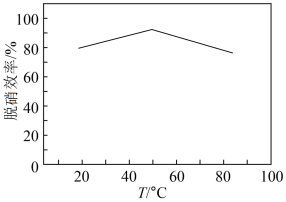
②测得脱硫效率(即SO2的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是___________ 。
(4)ZnO水悬浊液吸收SO2。已知:室温下,ZnSO4微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、 、
、 的物质的量分数随pH的分布如图1所示。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是
的物质的量分数随pH的分布如图1所示。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是___________ (填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为___________ 。

(1)一定条件下,将SO2通入TeOSO4溶液中,反应一段时间后过滤、洗涤得到粗Te。
①SO2还原TeOSO4溶液得到Te的反应中,n(TeOSO4):n(SO2)=
②洗涤沉淀的具体操作为
③过程中须控制反应温度为80℃,适宜的加热方式为
(2)工业上采用H2催化还原SO2,不仅可以消除SO2污染,还可得到有价值的单质S。反应分两步完成,第一步反应为3H2+SO2
 H2S+2H2O,第二步反应方程式为
H2S+2H2O,第二步反应方程式为(3)工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2。
①在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中含有Cl-等阴离子,则脱硫反应的离子方程式为
②测得脱硫效率(即SO2的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是

(4)ZnO水悬浊液吸收SO2。已知:室温下,ZnSO4微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、
 、
、 的物质的量分数随pH的分布如图1所示。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是
的物质的量分数随pH的分布如图1所示。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】制备锌印刷电路板是用稀硝酸腐蚀锌板产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,在实验室里,用“烂板液”制取ZnSO4∙7HO的过程如图所示:
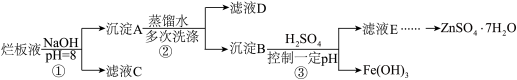
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是___ 。
(2)若步骤①的pH>12,则Zn(OH) 2溶解生成偏锌酸钠(Na2ZnO2),Zn(OH) 2溶解的离子方程式为___ 。
(3)滤液D中除了含有OH-离子外,还含有的阴离子有___ (填离子符号)。
(4)25℃时,若滤液E的pH=4,c(Zn2+)=2mol·L−1,(Fe3+)=2.6×10-9mo·L−1试求出Fe(OH)3的溶度积常数___ (只写结果)。
(5)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ∆H=a kJ mol·L−1
Fe3+(aq)+3OH-(aq) ∆H=a kJ mol·L−1
②H2O(l) H+(aq)+OH-(aq) ∆H=bkJ·mol·L−1
H+(aq)+OH-(aq) ∆H=bkJ·mol·L−1
请写出Fe3+发生水解反应的热化学方程式:___ 。
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K=___ (用含Kw、Ksp的代数式表示)。

(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是
(2)若步骤①的pH>12,则Zn(OH) 2溶解生成偏锌酸钠(Na2ZnO2),Zn(OH) 2溶解的离子方程式为
(3)滤液D中除了含有OH-离子外,还含有的阴离子有
(4)25℃时,若滤液E的pH=4,c(Zn2+)=2mol·L−1,(Fe3+)=2.6×10-9mo·L−1试求出Fe(OH)3的溶度积常数
(5)已知:①Fe(OH)3(s)
 Fe3+(aq)+3OH-(aq) ∆H=a kJ mol·L−1
Fe3+(aq)+3OH-(aq) ∆H=a kJ mol·L−1②H2O(l)
 H+(aq)+OH-(aq) ∆H=bkJ·mol·L−1
H+(aq)+OH-(aq) ∆H=bkJ·mol·L−1请写出Fe3+发生水解反应的热化学方程式:
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:

(1)连接上述仪器的正确顺序(填各接口处的字母):_______ 。
(2)装置中,饱和食盐水的作用是_______ 。
(3)①气体发生装置中进行反应的化学方程式:_______ ;氧化剂和还原剂的物质的量之比:_______ ;
②NaOH溶液中发生反应的离子方程式:_______ 。
(4)实验室用下列方法制取氯气 :
①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应;
②用87 g 二氧化锰与足量浓盐酸反应
若不考虑氯化氢的挥发,则反应后所得氯气的物质的量_______。

(1)连接上述仪器的正确顺序(填各接口处的字母):
(2)装置中,饱和食盐水的作用是
(3)①气体发生装置中进行反应的化学方程式:
②NaOH溶液中发生反应的离子方程式:
(4)实验室用下列方法制取氯气 :
①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应;
②用87 g 二氧化锰与足量浓盐酸反应
若不考虑氯化氢的挥发,则反应后所得氯气的物质的量_______。
| A.①比②多 | B.②比①多 | C.两种方法一样多 | D.无法比较 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】铁、铝的混合物进行如下实验:
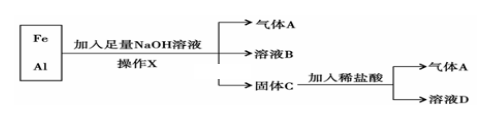
(1)操作X的名称是________________ ;
(2)气体A是___________ (填化学式);
(3)溶液B中阴离子除OH- 外还有__________ (填离子符号),溶液D中存在的金属离子为_________ (填离子符号);
(4)加入足量NaOH溶液时发生反应的离子方程式为:_________ ;加入稀盐酸发生反应的离子方程式为:___________________________________________ ;
(5)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:___________ 。

(1)操作X的名称是
(2)气体A是
(3)溶液B中阴离子除OH- 外还有
(4)加入足量NaOH溶液时发生反应的离子方程式为:
(5)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T 为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,M为红褐色。
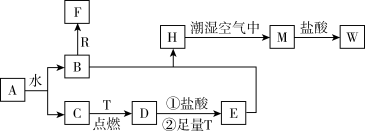
请回答下列问题:
(1)A的电子式是___________ ,R元素在元素周期表中位置为___________ ,D的俗称是___________ 。
(2)A与水反应的离子方程式为___________ 。
(3)检验W 溶液中金属阳离子的操作方法是___________ 。
(4)H转化为M的化学方程式为___________ 。
(5)B生成F反应的离子方程式为___________ 。
(6)向一定量T和D的混合物中加入200mL 1mol/L的盐酸,固体恰好完全溶解,且产生氢气448mL(标准状况下),所得溶液只有一种溶质,则混合物中两种物质的物质的量之比为___________ 。

请回答下列问题:
(1)A的电子式是
(2)A与水反应的离子方程式为
(3)检验W 溶液中金属阳离子的操作方法是
(4)H转化为M的化学方程式为
(5)B生成F反应的离子方程式为
(6)向一定量T和D的混合物中加入200mL 1mol/L的盐酸,固体恰好完全溶解,且产生氢气448mL(标准状况下),所得溶液只有一种溶质,则混合物中两种物质的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】研究性学习小组对某工厂排出的烟道气(主要成分为NO、NO2、N2、粉尘和少量水蒸气)进行处理,实验装置如图:
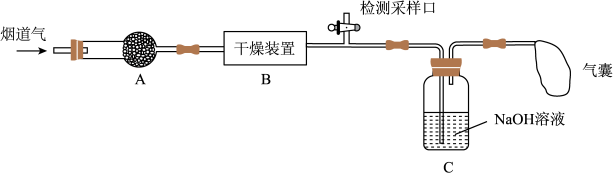
已知:NO、NO2能与NaOH溶液发生如下反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+ NaNO3+H2O;但NO不能单独与NaOH溶液反应。
(1)实验时在装置A的干燥管中放置一团棉花,吸收粉尘。装置B的干燥装置中应盛放的试剂为____ (填字母)。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4•5H2O)
(2)气体在被装置C中的NaOH溶液吸收前,需在检测采样口测定气体中NO和NO2的含量。为确保NO和NO2气体能够被NaOH溶液完全吸收,则需控制参加反应的NO和NO2物质的量比值为____ (填字母)。
a.≥1 b.=1 c.≤1
(3)若进入装置C的气体中NO和NO2物质的量比值不符合(2)中要求,则气囊中除含有N2外,可能含有少量NO气体。甲同学设计了喷淋吸收塔装置(如图所示),用NaClO溶液来进一步处理NO气体。
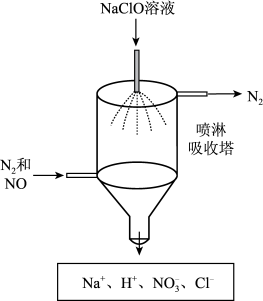
①NaClO溶液吸收NO时发生反应的离子方程式为____ 。
②该装置的优点是____ 。
(4)装置C的吸收液中NO 、NO
、NO 直接排放也会造成水体污染。乙同学设计了以下实验将溶液中
直接排放也会造成水体污染。乙同学设计了以下实验将溶液中 、NO
、NO 转化为N2,实现氮的脱除,具体步骤如下:
转化为N2,实现氮的脱除,具体步骤如下:
①向装置C的吸收液中加入适量H2O2溶液,充分反应后,蒸发浓缩,得到c(NO )为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO
)为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO 氧化为NO
氧化为NO 的离子方程式:
的离子方程式:____ 。
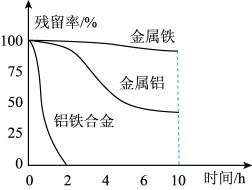
②量取三份50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中将溶液甲中的NO 还原为N2,从而实现脱氮,溶液中NO
还原为N2,从而实现脱氮,溶液中NO 的残留率(残留率=
的残留率(残留率=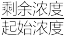 ×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是____ 。

已知:NO、NO2能与NaOH溶液发生如下反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+ NaNO3+H2O;但NO不能单独与NaOH溶液反应。
(1)实验时在装置A的干燥管中放置一团棉花,吸收粉尘。装置B的干燥装置中应盛放的试剂为
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4•5H2O)
(2)气体在被装置C中的NaOH溶液吸收前,需在检测采样口测定气体中NO和NO2的含量。为确保NO和NO2气体能够被NaOH溶液完全吸收,则需控制参加反应的NO和NO2物质的量比值为
a.≥1 b.=1 c.≤1
(3)若进入装置C的气体中NO和NO2物质的量比值不符合(2)中要求,则气囊中除含有N2外,可能含有少量NO气体。甲同学设计了喷淋吸收塔装置(如图所示),用NaClO溶液来进一步处理NO气体。

①NaClO溶液吸收NO时发生反应的离子方程式为
②该装置的优点是
(4)装置C的吸收液中NO
 、NO
、NO 直接排放也会造成水体污染。乙同学设计了以下实验将溶液中
直接排放也会造成水体污染。乙同学设计了以下实验将溶液中 、NO
、NO 转化为N2,实现氮的脱除,具体步骤如下:
转化为N2,实现氮的脱除,具体步骤如下:①向装置C的吸收液中加入适量H2O2溶液,充分反应后,蒸发浓缩,得到c(NO
 )为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO
)为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO 氧化为NO
氧化为NO 的离子方程式:
的离子方程式:②量取三份50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中将溶液甲中的NO
 还原为N2,从而实现脱氮,溶液中NO
还原为N2,从而实现脱氮,溶液中NO 的残留率(残留率=
的残留率(残留率= ×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】已知氮元素及其化合物的转化关系如图所示,回答下列问题。
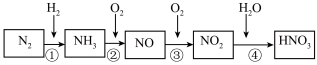
(1)①~④各步转化中,属于氮的固定的是_____ (填序号)。
(2)实验室制备少量氨气时,常用浓氨水滴到生石灰固体的方法制取。
①该方法制备的原理是_____ 。
②干燥氨气不可选用的试剂是_____ (填字母)。
a.浓硫酸 b.碱石灰 c.氯化钙固体 d.氢氧化钠固体
(3)工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
①水吸收法。用水直接吸收NO2存在明显的缺陷,需通入适量的氧气加以改进,用化学方程式说明通入适量氧气的优势______ 。
②NaOH溶液吸收法。发生的反应有:2NaOH+NO2+NO=2NaNO2+H2O,NaOH+NO2=______ +NaNO2+H2O(填化学式,不需要配平方程式)。
③用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:

(α表示尾气里NO、NO2中NO2的含量)
i.根据图和题中相关信息可得知_____ (填字母)。
a.NaOH溶液浓度越大,氮氧化物的吸收率越大
b.NO2含量越大,氮氧化物的吸收率越大
c.吸收后的尾气中含量较多的气体是NO
ii.标准状况下,当α等于50%时,用一定量尾气与足量NaOH溶液做喷泉实验,求实验后得到的NaNO2溶液的物质的量浓度_____ (保留两位有效数字)。

(1)①~④各步转化中,属于氮的固定的是
(2)实验室制备少量氨气时,常用浓氨水滴到生石灰固体的方法制取。
①该方法制备的原理是
②干燥氨气不可选用的试剂是
a.浓硫酸 b.碱石灰 c.氯化钙固体 d.氢氧化钠固体
(3)工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
①水吸收法。用水直接吸收NO2存在明显的缺陷,需通入适量的氧气加以改进,用化学方程式说明通入适量氧气的优势
②NaOH溶液吸收法。发生的反应有:2NaOH+NO2+NO=2NaNO2+H2O,NaOH+NO2=
③用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:

(α表示尾气里NO、NO2中NO2的含量)
i.根据图和题中相关信息可得知
a.NaOH溶液浓度越大,氮氧化物的吸收率越大
b.NO2含量越大,氮氧化物的吸收率越大
c.吸收后的尾气中含量较多的气体是NO
ii.标准状况下,当α等于50%时,用一定量尾气与足量NaOH溶液做喷泉实验,求实验后得到的NaNO2溶液的物质的量浓度
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】“价—类”二维图是以物质的类别为横坐标,以某种元素的化合价为纵坐标,在二维平面内绘制的含有该元素物质的图像,该图是高中化学学习元素化合物知识的重要工具。氮及其部分化合物的“价—类”二维图如图所示:

(1)以上①~⑤的转化过程,其中属于氮的固定的是_______ (填写编号)
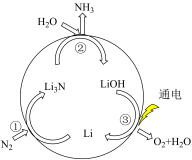
(2)固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图所示。下列叙述正确的是_______。
(3)NO、 对环境有污染,可用NaOH溶液吸收。用不同浓度的NaOH溶液吸收
对环境有污染,可用NaOH溶液吸收。用不同浓度的NaOH溶液吸收 含量不同的尾气,关系如图:
含量不同的尾气,关系如图:
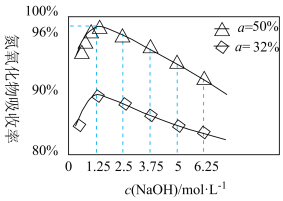
(α表示尾气里NO、 中
中 的含量)
的含量)
①用NaOH溶液吸收氮氧化物的最佳条件为:
_______ ,
_______ 。
②从图上可知, 含量越大,氮氧化物的吸收率越大。当
含量越大,氮氧化物的吸收率越大。当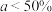 时,加入
时,加入 能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是_______
(4)从物质类别角度分析,硝酸属于酸,具有酸的通性;从氮元素化合价的角度分析,硝酸具有氧化性。与下列物质反应既能体现硝酸酸性又能体现硝酸氧化性的是_______ 。
A. B.Cu C.C
B.Cu C.C
(5)对于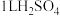 和
和 的混合溶液,若
的混合溶液,若 和
和 物质的量浓度存在如下关系:
物质的量浓度存在如下关系: ,理论上最多能溶解铜的物质的量为
,理论上最多能溶解铜的物质的量为_______ 。

(1)以上①~⑤的转化过程,其中属于氮的固定的是
(2)固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图所示。下列叙述正确的是_______。

| A.转化过程中所涉及的元素均呈现了两种价态 |
| B.反应①②③均为氧化还原反应 |
C.Li是催化剂,只有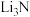 是中间产物 是中间产物 |
D.整个过程的总反应可表示为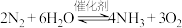 |
 对环境有污染,可用NaOH溶液吸收。用不同浓度的NaOH溶液吸收
对环境有污染,可用NaOH溶液吸收。用不同浓度的NaOH溶液吸收 含量不同的尾气,关系如图:
含量不同的尾气,关系如图:
(α表示尾气里NO、
 中
中 的含量)
的含量)①用NaOH溶液吸收氮氧化物的最佳条件为:


②从图上可知,
 含量越大,氮氧化物的吸收率越大。当
含量越大,氮氧化物的吸收率越大。当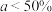 时,加入
时,加入 能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是(4)从物质类别角度分析,硝酸属于酸,具有酸的通性;从氮元素化合价的角度分析,硝酸具有氧化性。与下列物质反应既能体现硝酸酸性又能体现硝酸氧化性的是
A.
 B.Cu C.C
B.Cu C.C(5)对于
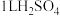 和
和 的混合溶液,若
的混合溶液,若 和
和 物质的量浓度存在如下关系:
物质的量浓度存在如下关系: ,理论上最多能溶解铜的物质的量为
,理论上最多能溶解铜的物质的量为
您最近一年使用:0次




