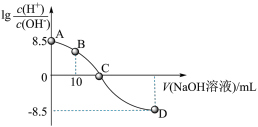
25℃时,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 0.100 mol·L-1的HNO2溶液, 与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
 与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
| A.25 ℃时,0.100 mol·L-1的HNO2溶液的pH=2.75 |
| B.B点对应的溶液中,2c(H+)+c(HNO2)=c(NO2-)+2c(OH-) |
| C.C点对应的溶液的pH=7,加入NaOH溶液的体积为20.00 mL |
| D.滴定过程中从A到D点溶液中水的电离程度先增大后减小 |
更新时间:2019-04-26 10:24:29
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】用0.1000mol/LNa2SO4标准溶液滴定20.00mLBaCl2溶液,测得溶液电导率σ及-lgc(Ba2+)随滴入Na2SO4标准溶液的体积V(Na2SO4)的变化关系如图所示。下列说法不正确的是


| A.BaCl2溶液的浓度为0.1000mol/L |
| B.Ksp(BaSO4)=10-10 |
| C.等浓度的Na+比Ba2+导电能力差 |
| D.滴定前用于盛装BaCl2溶液的锥形瓶(已用蒸馏水洗净)不需要再用待测液润洗 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】室温下,用0.100mol/L NaOH溶液滴定20.00 mL  溶液。滴定过程中含A微粒的分布分数(
溶液。滴定过程中含A微粒的分布分数( )和pH随NaOH溶液体积变化如图所示。下列说法正确的是
)和pH随NaOH溶液体积变化如图所示。下列说法正确的是

 溶液。滴定过程中含A微粒的分布分数(
溶液。滴定过程中含A微粒的分布分数( )和pH随NaOH溶液体积变化如图所示。下列说法正确的是
)和pH随NaOH溶液体积变化如图所示。下列说法正确的是
A.原 溶液的物质的量浓度为0.125mol/L 溶液的物质的量浓度为0.125mol/L |
B.pH=7时,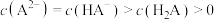 |
C.加入NaOH溶液越多, 越高,水的电离程度越大 越高,水的电离程度越大 |
D. |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下,现有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
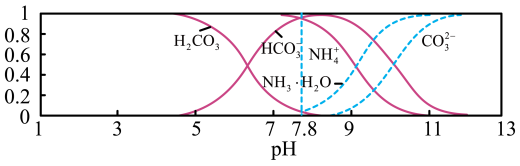

| A.常温下Kb(NH3·H2O)> Kal(H2CO3) |
| B.向pH =6.5的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3一浓度都逐渐减小 |
| C.NH4HCO3溶液中存在下列守恒关系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO32-)+c( H2 CO3) |
| D.当溶液的pH =9时,溶液中存在下列关系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO32-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】室温下,向1.00L0.100mol/LNH4HCO3溶液中加入NaOH稀溶液,溶液中主要型体的分布系数[比如A2-的分布系数δ(A2-)= ]以及pH随n(NaOH)变化如图。下列说法
]以及pH随n(NaOH)变化如图。下列说法不正确 的是

 ]以及pH随n(NaOH)变化如图。下列说法
]以及pH随n(NaOH)变化如图。下列说法
A.0.100mol/LNH4HCO3溶液中 >1,水的电离受到促进 >1,水的电离受到促进 |
B.加入NaOH稀溶液过程中,溶液满足关系式c(NH )+c(NH3•H2O)=c(CO )+c(NH3•H2O)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
| C.Ka2(H2CO3)Kb(NH3•H2O)>Kw |
D.加入少量NaOH时,OH-主要先与NH 反应 反应 |
您最近一年使用:0次


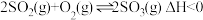 中
中 的平衡转化率随温度、压强的变化曲线,说明X代表温度,Y代表压强,且
的平衡转化率随温度、压强的变化曲线,说明X代表温度,Y代表压强,且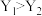
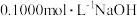 溶液滴定
溶液滴定 溶液的滴定曲线,说明Q点表示酸碱中和滴定终点
溶液的滴定曲线,说明Q点表示酸碱中和滴定终点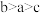
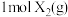 、
、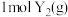 反应生成
反应生成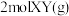 的能量变化曲线,说明反应物所含化学键的键能总和小于生成物所含化学键的键能总和
的能量变化曲线,说明反应物所含化学键的键能总和小于生成物所含化学键的键能总和

