铁为日常生活中常见的金属,有着广泛的用途。回答下列问题:

(1)基态铁原子的价电子轨道表示式为________________ 。
(2)Fe和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为___ 。
(3)已知配合物Fe(CO)x,在常温下呈液态,熔点为-20.5℃,沸点103℃,易溶于非极性溶剂。据此可判断晶体Fe(CO)x的晶体类型是_________________ 。
(4)Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。晶体Fe3O4的晶胞如图所示:

①晶胞中亚铁离子处于氧离子围成的_________ (填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为_______ 。
③解释Fe3O4晶体能导电的原因:_________________________ 。
④若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为_________ g/cm3。(阿伏伽德罗常数用NA表示)

(1)基态铁原子的价电子轨道表示式为
(2)Fe和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为
(3)已知配合物Fe(CO)x,在常温下呈液态,熔点为-20.5℃,沸点103℃,易溶于非极性溶剂。据此可判断晶体Fe(CO)x的晶体类型是
(4)Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。晶体Fe3O4的晶胞如图所示:

①晶胞中亚铁离子处于氧离子围成的
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为
③解释Fe3O4晶体能导电的原因:
④若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为
更新时间:2019-05-14 14:39:32
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、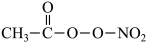 (PAN)等二次污染物。
(PAN)等二次污染物。
① 1 mol PAN中含有的σ键数目为________ 。PAN中四种元素的第一电离能由大到小的顺序为________________ 。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中的中心离子的配位数为________ ,中心离子的核外电子排布式为________________________ 。
③ 相同压强下,乙醇的沸点比CH3OCH3________ (填“高”或“低”),其原因是_____________ 。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及________ (填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为________ ,阴离子的中心原子轨道采用________ 杂化。
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=____________ (填数字)。

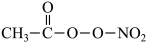 (PAN)等二次污染物。
(PAN)等二次污染物。① 1 mol PAN中含有的σ键数目为
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中的中心离子的配位数为
③ 相同压强下,乙醇的沸点比CH3OCH3
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】NH3具有易液化、含氢密度高、应用广泛等优点,NH3的合成及应用一直是科学研究的重要课题。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_______ 。
②实际生产中采用铁的氧化物Fe2O3、FeO,使用前用H2和N2的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
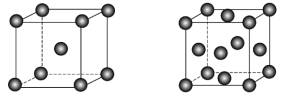
i.两种晶胞所含铁原子个数比为_______ 。
ii.图1晶胞的棱长为apm(1pm=1×10-10cm),则其密度ρ=_______ g·cm-3。
③我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是_______ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_______ 。
②NaHCO3分解得Na2CO3, 空间结构为
空间结构为_______ 。
(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
①NH3BH3存在配位键,提供空轨道的是_______ 。
②比较熔点:NH3BH3_______ CH3CH3(填“>”或“<”)。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为
②实际生产中采用铁的氧化物Fe2O3、FeO,使用前用H2和N2的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:

i.两种晶胞所含铁原子个数比为
ii.图1晶胞的棱长为apm(1pm=1×10-10cm),则其密度ρ=
③我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3,
 空间结构为
空间结构为(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
| 元素 | H | B | N |
| 电负性 | 2.1 | 2.0 | 3.0 |
①NH3BH3存在配位键,提供空轨道的是
②比较熔点:NH3BH3
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】镍铜合金是由 镍、
镍、 铜、
铜、 铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐腐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。
铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐腐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。
(1)基态 和基态
和基态 的未成对电子数之比为
的未成对电子数之比为___________ 。
(2) 与
与 的第二电离能较大的是
的第二电离能较大的是___________ (填化学式),主要原因是___________ 。
(3)某种铜的氧化物的立方晶胞结构如图所示,其中 原子位于小正方体的体心。
原子位于小正方体的体心。
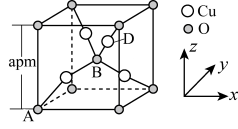
①该铜的氧化物的化学式为___________ ;该晶体结构与 晶体相似,用
晶体相似,用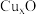 四面体占据
四面体占据 晶体中的
晶体中的 所占位置,则
所占位置,则 所占位置由
所占位置由___________ (填元素符号)原子占据。已知: 的分数坐标依次为
的分数坐标依次为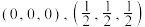 ,则
,则 的分数坐标为
的分数坐标为___________ 。
②已知:该晶体的晶胞边长为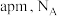 是阿伏加德罗常数的值,则晶胞中
是阿伏加德罗常数的值,则晶胞中 原子的最短距离为
原子的最短距离为___________  ,晶体的密度为
,晶体的密度为___________ (填含 的表达式)
的表达式) 。
。
 镍、
镍、 铜、
铜、 铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐腐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。
铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐腐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。(1)基态
 和基态
和基态 的未成对电子数之比为
的未成对电子数之比为(2)
 与
与 的第二电离能较大的是
的第二电离能较大的是(3)某种铜的氧化物的立方晶胞结构如图所示,其中
 原子位于小正方体的体心。
原子位于小正方体的体心。
①该铜的氧化物的化学式为
 晶体相似,用
晶体相似,用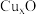 四面体占据
四面体占据 晶体中的
晶体中的 所占位置,则
所占位置,则 所占位置由
所占位置由 的分数坐标依次为
的分数坐标依次为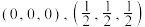 ,则
,则 的分数坐标为
的分数坐标为②已知:该晶体的晶胞边长为
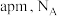 是阿伏加德罗常数的值,则晶胞中
是阿伏加德罗常数的值,则晶胞中 原子的最短距离为
原子的最短距离为 ,晶体的密度为
,晶体的密度为 的表达式)
的表达式) 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】铜、钛、钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为__________ ,未成对电子数为________________ 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①与BH4-互为等电子体的阳离子的化学式为_____ 。
②H、B、Ti原子的第一电离能由小到大的顺序为_____ 。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。

化合物乙的分子中采取sp3杂化方式的原子个数为_____ 。
(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___ 。阳离子的立体构型是________________ 。
(5)铜与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为_____ ,HSCN结构有两种,已知硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S),其原因是_______ 。
(1)钴元素基态原子的电子排布式为
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①与BH4-互为等电子体的阳离子的化学式为
②H、B、Ti原子的第一电离能由小到大的顺序为
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。

化合物乙的分子中采取sp3杂化方式的原子个数为
(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为
(5)铜与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】已知X、Y、Z、M、N是原子序数依次增大的前四周期元素,其中Y是地壳中含量第二的元素,X、Y、Z是核外未成对电子数均为2的非金属元素,ZX3的空间结构为平面三角形,M的价层电子数为6,N与Z同族。请回答下列问题:
(1)X为____ (填元素名称,下同),Y为____ ,Z为____ 。
(2)M在元素周期表的位置是____ ,基态N原子的价层电子排布式为____ 。
(3)X、Y、Z的第一电离能由大到小的顺序为____ (填元素符号)。
(4)Z与N的最简单氢化物的稳定性比较:____ (写化学式),原因为____ 。
(5)YX2的晶体类型为____ ,其熔点____ (填“高于”或“低于”)NX2。
(1)X为
(2)M在元素周期表的位置是
(3)X、Y、Z的第一电离能由大到小的顺序为
(4)Z与N的最简单氢化物的稳定性比较:
(5)YX2的晶体类型为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】三氯化铬( )在工业上主要用作媒染剂和催化剂,实验室模拟工业上以
)在工业上主要用作媒染剂和催化剂,实验室模拟工业上以 为原料制备
为原料制备 。
。
(1)制备 。取一定质量的
。取一定质量的 和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。
①Cr原子的外围电子排布式为___________ 。
②上述反应的化学方程式为___________ 。
③上述反应中的乙醇与投料的 物质的量比例大约为
物质的量比例大约为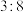 ,原因是
,原因是___________ 。
(2)测定 的质量分数。
的质量分数。
I.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
II.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬元素完全以
;再加入过量KI固体加塞摇匀,使铬元素完全以 的形式存在。
的形式存在。
III.加入1mL淀粉溶液,用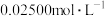 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。
已知反应:
 (未配平)
(未配平)
 (未配平)
(未配平)
①滴定终点的现象是___________ 。
②计算 的质量分数(写出计算过程)
的质量分数(写出计算过程)___________ 。
 )在工业上主要用作媒染剂和催化剂,实验室模拟工业上以
)在工业上主要用作媒染剂和催化剂,实验室模拟工业上以 为原料制备
为原料制备 。
。(1)制备
 。取一定质量的
。取一定质量的 和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。①Cr原子的外围电子排布式为
②上述反应的化学方程式为
③上述反应中的乙醇与投料的
 物质的量比例大约为
物质的量比例大约为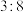 ,原因是
,原因是(2)测定
 的质量分数。
的质量分数。I.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
II.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的
 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬元素完全以
;再加入过量KI固体加塞摇匀,使铬元素完全以 的形式存在。
的形式存在。III.加入1mL淀粉溶液,用
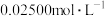 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。已知反应:
 (未配平)
(未配平) (未配平)
(未配平)①滴定终点的现象是
②计算
 的质量分数(写出计算过程)
的质量分数(写出计算过程)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】翡翠是一类名贵的装饰品,其主要成分为硅酸铝钠(NaAlSi2O6),常含微量Cr、Ni、Mn等元素。回答下列问题:
某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为_______ 。知该晶体密度为ρg·cm-3。晶体中Cr原子和N的最近核间距为_______ pm(NA表示阿伏加德罗常数值)。
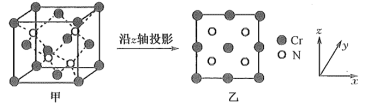
某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________ ;B元素原子中的未成对电子数为_______________________ 。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是______ ;A与B形成的AB2-的空间构型为___________________________ 。
(3)A、B、C三种元素的第一电离能从大到小的顺序为_______________________ (用元素符号表示)。
(4)基态F3+的核外电子排布式是_____________________ ;F3+与SCN-络合得到多种配合物,其中配位数为5的配合物的化学式为__________________ ;化合物FD3是棕色固体、易潮解,100℃左右时升华,FD3的晶体类型是__________________________ 。
(5)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为__________________________ 。
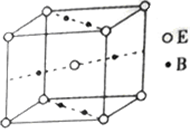
(1)A元素单质的结构式为
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是
(3)A、B、C三种元素的第一电离能从大到小的顺序为
(4)基态F3+的核外电子排布式是
(5)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用[Cu(NH3)2]Ac [醋酸二氨合铜(Ⅰ)]溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3]Ac
[Cu(NH3)3]Ac
⑴配合物[Cu(NH3)2]Ac中,中心离子的基态价电子排布式为_______ 。
(2)醋酸根离子中碳原子轨道杂化类型为__________ 。
(3)1mol 配离子[Cu(NH3)3CO]+中σ键和π键的数目之比为______ 。
(4)NH3的空间构型是___ (用文字描述):与CO互为等电子体的阴离子可以是____ 。
(要求:由题中涉及的元素原子构成,用电子式表示)。
(5)铜的化合物种类很多,下图是某铜的氯化物的晶胞结构,该氯化物能溶于浓氨水可得无色溶液(配合物中配位数为2),请完成有关反应的离子方程式:______ 。
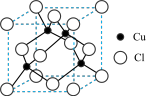
 [Cu(NH3)3]Ac
[Cu(NH3)3]Ac⑴配合物[Cu(NH3)2]Ac中,中心离子的基态价电子排布式为
(2)醋酸根离子中碳原子轨道杂化类型为
(3)1mol 配离子[Cu(NH3)3CO]+中σ键和π键的数目之比为
(4)NH3的空间构型是
(要求:由题中涉及的元素原子构成,用电子式表示)。
(5)铜的化合物种类很多,下图是某铜的氯化物的晶胞结构,该氯化物能溶于浓氨水可得无色溶液(配合物中配位数为2),请完成有关反应的离子方程式:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】五种元素A、B、C、D、E,其中A元素形成的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍;D在B的下一周期,在同周期元素中,D形成的简单离子半径最小;E是形成化合物种类最多的元素。
(1)A、E形成的化合物E2A4分子中σ键和π键数目之比为_______ ,B、C、E三种元素的第一电离能由大到小的顺序为_______ 。
(2)与PH3相比,BA3易液化的主要原因是_______ 。
(3)BC 离子的立体构型为
离子的立体构型为_______ ,BC 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为_______ 。
(4)化合物DB是人工合成的半导体材料,它的晶胞结构如图所示,其中最近两个D原子的核间距为a cm。该晶体的密度为_______ g·cm-3 (NA表示阿伏加德罗常数的值)。
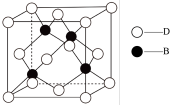
(1)A、E形成的化合物E2A4分子中σ键和π键数目之比为
(2)与PH3相比,BA3易液化的主要原因是
(3)BC
 离子的立体构型为
离子的立体构型为 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为(4)化合物DB是人工合成的半导体材料,它的晶胞结构如图所示,其中最近两个D原子的核间距为a cm。该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_______ ,3d能级上的未成对的电子数为_______ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_______ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ 。
③氨的沸点_______ (“高于”或“低于”)膦(PH3),原因是_______ ;氨是_______ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______ 。
(3)元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是_______ 。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_______ 。
②若合金的密度为dg/cm3,晶胞参数a=_______ nm。
(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
③氨的沸点
(3)元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为
②若合金的密度为dg/cm3,晶胞参数a=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】化学创造美好生活。磷酸锌是一种绿色环保涂料,实验室用锌灰(含 等)为原料制备
等)为原料制备 。(难溶于水)的流程如下,回答下列问题:
。(难溶于水)的流程如下,回答下列问题:
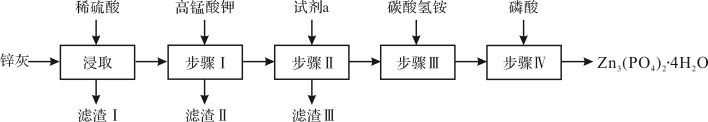
已知:
①本实验条件下高锰酸钾的还原产物为 。
。
② 。
。
(1)滤渣I的主要成分为___________ 。
(2)步骤的主要目的是除去铁元素,需先将溶液的 调至5.0,再滴加
调至5.0,再滴加 溶液,滴加时的离子方程式为
溶液,滴加时的离子方程式为___________ 。
(3)步骤Ⅱ的主要目的是除去铜元素,试剂a为___________ (填化学式)。
(4)步骤Ⅲ在加热条件下生成一种温室气体和沉淀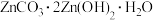 ,其离子方程式为
,其离子方程式为___________ 。
(5)步骤IV反应结束后,得到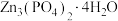 的操作包括
的操作包括___________ 、___________ 和干燥。
(6)锌的某种氧化物的立方晶胞结构如下图所示,晶胞参数为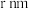 。
。
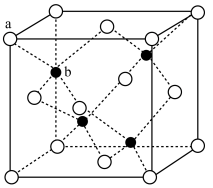 (晶胞中a为氧,b为锌)
(晶胞中a为氧,b为锌)
①写出基态 原子的价层电子排布式
原子的价层电子排布式___________ 。
② 和O之间最短的距离为
和O之间最短的距离为___________  。
。
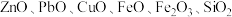 等)为原料制备
等)为原料制备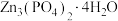 。(难溶于水)的流程如下,回答下列问题:
。(难溶于水)的流程如下,回答下列问题:
已知:
①本实验条件下高锰酸钾的还原产物为
 。
。②
 。
。(1)滤渣I的主要成分为
(2)步骤的主要目的是除去铁元素,需先将溶液的
 调至5.0,再滴加
调至5.0,再滴加 溶液,滴加时的离子方程式为
溶液,滴加时的离子方程式为(3)步骤Ⅱ的主要目的是除去铜元素,试剂a为
(4)步骤Ⅲ在加热条件下生成一种温室气体和沉淀
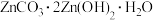 ,其离子方程式为
,其离子方程式为(5)步骤IV反应结束后,得到
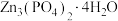 的操作包括
的操作包括(6)锌的某种氧化物的立方晶胞结构如下图所示,晶胞参数为
 。
。 (晶胞中a为氧,b为锌)
(晶胞中a为氧,b为锌)①写出基态
 原子的价层电子排布式
原子的价层电子排布式②
 和O之间最短的距离为
和O之间最短的距离为 。
。
您最近一年使用:0次



