(1)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83 kJ·mol− 1
Cl2(g) ΔH1=83 kJ·mol− 1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=− 20 kJ·mol− 1
Cl2(g) ΔH2=− 20 kJ·mol− 1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=− 121 kJ·mol− 1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol− 1。其中O2的电子式为__________
(2)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和H2,放出225KJ热量,该反应的热化学方程式为________________________ 。SiHCl3中含有的化学键类型为__________
(3)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g) ΔH1>0
SiHCl3(g)+HCl(g) ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3
则反应③的ΔH3______ (用ΔH1,ΔH2表示)。
(4)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式________________________
(5)氯化铵常用作焊接.如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:_______CuO+______NH4Cl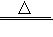 ______Cu+______CuCl2+______N2↑+______H2O
______Cu+______CuCl2+______N2↑+______H2O
①配平此氧化还原反应方程式___________________________
②此反应中若产生0.2mol的气体,则有__________ mol的电子转移.
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=83 kJ·mol− 1
Cl2(g) ΔH1=83 kJ·mol− 1CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=− 20 kJ·mol− 1
Cl2(g) ΔH2=− 20 kJ·mol− 1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=− 121 kJ·mol− 1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
(2)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和H2,放出225KJ热量,该反应的热化学方程式为
(3)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)
 SiHCl3(g)+HCl(g) ΔH1>0
SiHCl3(g)+HCl(g) ΔH1>0②3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0③2SiCl4(g)+H2(g)+Si(s)+HCl(g)
 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3则反应③的ΔH3
(4)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式
(5)氯化铵常用作焊接.如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:_______CuO+______NH4Cl
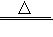 ______Cu+______CuCl2+______N2↑+______H2O
______Cu+______CuCl2+______N2↑+______H2O①配平此氧化还原反应方程式
②此反应中若产生0.2mol的气体,则有
更新时间:2019-07-25 20:56:27
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
(1)实验室制取 的离子方程式为
的离子方程式为___________ ,装置中管f的作用是___________
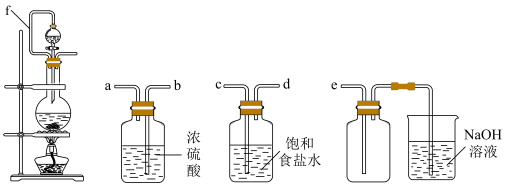
(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→___________ (填字母).
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸.小组同学探究不继续产生
和盐酸.小组同学探究不继续产生 的原因.
的原因.
查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱.
【提出猜想】
猜想1: 降低,氧化剂氧化性减弱.
降低,氧化剂氧化性减弱.
猜想2:______________________________ 减弱
猜想3: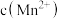 增大,氧化剂氧化性减弱.
增大,氧化剂氧化性减弱.
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为浓硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 .请写出该反应的方程式:
.请写出该反应的方程式:___________________________
(1)实验室制取
 的离子方程式为
的离子方程式为
(2)实验室制取干燥、纯净的
 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→(3)反应停止后,实验小组检验烧瓶中还有
 和盐酸.小组同学探究不继续产生
和盐酸.小组同学探究不继续产生 的原因.
的原因.查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱.
【提出猜想】
猜想1:
 降低,氧化剂氧化性减弱.
降低,氧化剂氧化性减弱.猜想2:
猜想3:
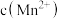 增大,氧化剂氧化性减弱.
增大,氧化剂氧化性减弱.【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸,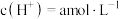 , , | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使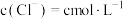 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使 | 猜想3正确 |
 固体和
固体和 混合加热也可制取
混合加热也可制取 .请写出该反应的方程式:
.请写出该反应的方程式:
您最近一年使用:0次
【推荐2】工业上回收利用某合金废料(主要含Fe、Al、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
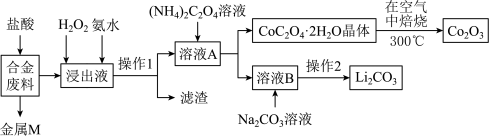
(1)金属M为______ ,操作1所用的玻璃仪器除烧杯外还有_______ 。
(2)加入H2O2的作用是_________ (用离子方程式表示),加入氨水的作用是_______ 。
(3)在空气中焙烧的化学方程式为___________ 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是_______ 。
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为___________ 。

(1)金属M为
(2)加入H2O2的作用是
(3)在空气中焙烧的化学方程式为
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】卤族元素化合物有着许多重要用途。
(1)溴离子的最外层电子排布式是_______ ;氯原子的核外电子云有_______ 种伸展方向。
(2)下列能说明氯的非金属性强于溴的事实是_______ (选填编号)。
a. 酸性强于
酸性强于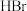
b.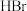 的分解温度低于
的分解温度低于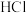
c.向溴化亚铁溶液中滴入少量氯水,溶液颜色变黄
d. 是非氧化还原反应
是非氧化还原反应
(3)光气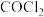 是一种重要的有机合成中间体,有强烈的毒性。已如其分子中所有原子均满足稳定结构,请写出它的电子式
是一种重要的有机合成中间体,有强烈的毒性。已如其分子中所有原子均满足稳定结构,请写出它的电子式_______ 。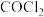 分子中氧元素显示
分子中氧元素显示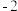 价,请从结构角度解释其原因
价,请从结构角度解释其原因_______ 。
(4)二氧化氯(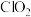 )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠溶液反应。已知在该反应中
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠溶液反应。已知在该反应中 甲醇失去
甲醇失去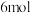 电子,请写出该反应的离子方程式
电子,请写出该反应的离子方程式_______ 。
(5)室温下,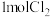 与含
与含 的溶液充分反应后,离子浓度由大到小的顺序为
的溶液充分反应后,离子浓度由大到小的顺序为_______ 。
(6)将氯气通入含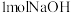 的溶液中,形成
的溶液中,形成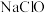 、
、 和
和 的混合溶液。随后用此溶液吸收标准状况下5.6L
的混合溶液。随后用此溶液吸收标准状况下5.6L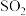 气体,恰好形成中性溶液。可知原溶液通入氯气
气体,恰好形成中性溶液。可知原溶液通入氯气_______ 
(1)溴离子的最外层电子排布式是
(2)下列能说明氯的非金属性强于溴的事实是
a.
 酸性强于
酸性强于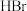
b.
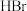 的分解温度低于
的分解温度低于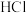
c.向溴化亚铁溶液中滴入少量氯水,溶液颜色变黄
d.
 是非氧化还原反应
是非氧化还原反应(3)光气
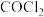 是一种重要的有机合成中间体,有强烈的毒性。已如其分子中所有原子均满足稳定结构,请写出它的电子式
是一种重要的有机合成中间体,有强烈的毒性。已如其分子中所有原子均满足稳定结构,请写出它的电子式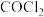 分子中氧元素显示
分子中氧元素显示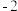 价,请从结构角度解释其原因
价,请从结构角度解释其原因(4)二氧化氯(
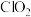 )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠溶液反应。已知在该反应中
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠溶液反应。已知在该反应中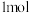 甲醇失去
甲醇失去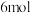 电子,请写出该反应的离子方程式
电子,请写出该反应的离子方程式(5)室温下,
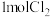 与含
与含 的溶液充分反应后,离子浓度由大到小的顺序为
的溶液充分反应后,离子浓度由大到小的顺序为(6)将氯气通入含
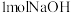 的溶液中,形成
的溶液中,形成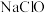 、
、 和
和 的混合溶液。随后用此溶液吸收标准状况下5.6L
的混合溶液。随后用此溶液吸收标准状况下5.6L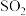 气体,恰好形成中性溶液。可知原溶液通入氯气
气体,恰好形成中性溶液。可知原溶液通入氯气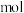
您最近一年使用:0次
【推荐1】世界能源消费依靠化学技术,作为燃料的H2通常来自水煤气。回答下列问题:
(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=akJ/mol②2C(s)+O2(g)=2CO(g)△H= -220 kJ/mol③2H2O(g)=2H2(g)+O2(g)△H=+480 kJ/mol,则a=_____ kJ/mol。
(2)某实验小组在实验室模拟反应C(s) +H2O (g)⇌CO (g) +H2(g)能够说明该反应达到平衡状态的是____ 。
a. v逆(H2O)=v正(CO)b.容器中物质的总质量不发生变化
c. n (H2O):n (H2)=1:1且不再改变d.恒容容器中混合气体密度不变
(3)一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O发生反应①,6min时生成0.7 gH2则6 min内以CO表示的平均反应速率为______ mol/L∙min-1(保留2位有效数字)。
(4)燃料气中CO需氧化为CO2与氢气进行分离,使用CuO/CeO2做催化剂,并向其中加入不同的酸(HIO3或H3PO4)后,CO的转化率随温度的变化如图所示。

①加入H3PO4__________ (填“促进”或,抑制”)CuO/CeO2的催化。
②CeO2可由草酸铈[Ce2(C2O4)3]在空气中灼烧制备,同时只产生一种气体,写出该反应的化学方程式_____ 。
③恒温恒压下,在温度为120°C,催化剂为CuO/CeO2・HIO3条件下反应,若起始时燃料气流速为1800mL∙min-1,其中CO的体积分数为0.68%,则反应0.5h后剩余气体中CO的体积为__ mL。
(5)有人将合成氨反应设计成原电池,装置如图所示。
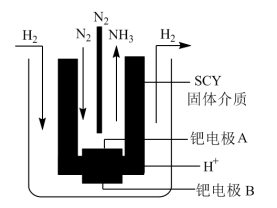
①正极反应式为_______ 。
②已知该原电池的标准电动势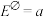 ,25°C时反应的平衡常数K与
,25°C时反应的平衡常数K与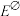 之间的关系为
之间的关系为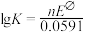 (n为原电池反应转移的电子数),则合成氨反应(N2+3H2
(n为原电池反应转移的电子数),则合成氨反应(N2+3H2 2NH3)的平衡常数K为
2NH3)的平衡常数K为______ (用含a的代数式表示,不需要化简)。
(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=akJ/mol②2C(s)+O2(g)=2CO(g)△H= -220 kJ/mol③2H2O(g)=2H2(g)+O2(g)△H=+480 kJ/mol,则a=
(2)某实验小组在实验室模拟反应C(s) +H2O (g)⇌CO (g) +H2(g)能够说明该反应达到平衡状态的是
a. v逆(H2O)=v正(CO)b.容器中物质的总质量不发生变化
c. n (H2O):n (H2)=1:1且不再改变d.恒容容器中混合气体密度不变
(3)一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O发生反应①,6min时生成0.7 gH2则6 min内以CO表示的平均反应速率为
(4)燃料气中CO需氧化为CO2与氢气进行分离,使用CuO/CeO2做催化剂,并向其中加入不同的酸(HIO3或H3PO4)后,CO的转化率随温度的变化如图所示。

①加入H3PO4
②CeO2可由草酸铈[Ce2(C2O4)3]在空气中灼烧制备,同时只产生一种气体,写出该反应的化学方程式
③恒温恒压下,在温度为120°C,催化剂为CuO/CeO2・HIO3条件下反应,若起始时燃料气流速为1800mL∙min-1,其中CO的体积分数为0.68%,则反应0.5h后剩余气体中CO的体积为
(5)有人将合成氨反应设计成原电池,装置如图所示。

①正极反应式为
②已知该原电池的标准电动势
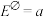 ,25°C时反应的平衡常数K与
,25°C时反应的平衡常数K与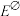 之间的关系为
之间的关系为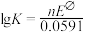 (n为原电池反应转移的电子数),则合成氨反应(N2+3H2
(n为原电池反应转移的电子数),则合成氨反应(N2+3H2 2NH3)的平衡常数K为
2NH3)的平衡常数K为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】在“碳达峰、碳中和”的目标引领下,对减少二氧化碳排放的相关技术研究正成为世界各国的前沿发展方向。
(1)利用 干重整反应可以对天然气资源综合利用,缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
干重整反应可以对天然气资源综合利用,缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
反应①: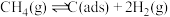 反应②:
反应②: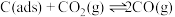
上述反应中 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:
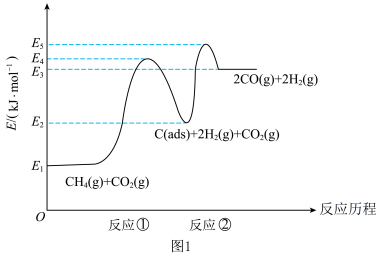
①反应①是_______ (填“慢反应”或“快反应”), 干重整反应的热化学方程式为
干重整反应的热化学方程式为_______ 。(选取图中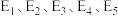 表示反应热)。
表示反应热)。
②在恒压条件下,等物质的量的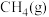 和
和 发生干重整反应时,各物质的平衡转化率随温度变化如图2所示。已知在干重整中还发生了副反应:
发生干重整反应时,各物质的平衡转化率随温度变化如图2所示。已知在干重整中还发生了副反应: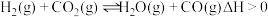 ,则表示
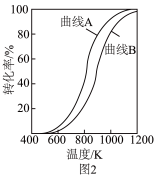
,则表示 平衡转化率的是曲线
平衡转化率的是曲线_______ (填“A”或“B”),判断的依据是_______ 。
③在恒压p、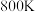 条件下,在密闭容器中充入等物质的量的
条件下,在密闭容器中充入等物质的量的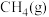 和
和 若图2中曲线A对应物质的平衡转化率为40%,曲线B对应物质的平衡转化率为20%,则以上反应平衡体系中
若图2中曲线A对应物质的平衡转化率为40%,曲线B对应物质的平衡转化率为20%,则以上反应平衡体系中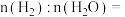
_______ 。则干重整反应的平衡常数
_______ (用平衡分压代替平衡浓度表示,分压=总压×物质的量分数,列出计算式,无需化简)。
(2)二氧化碳电还原反应提供了一种生产乙醇的方法,已知反应过程中在三种不同催化剂表面(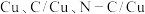 )的某个基元反应的能量变化如图所示(
)的某个基元反应的能量变化如图所示( 表示始态,
表示始态, 表示过渡态,
表示过渡态, 表示终态,*表示催化剂活性中心原子)。
表示终态,*表示催化剂活性中心原子)。
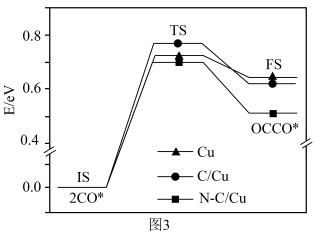
铜表面涂覆一层氮掺杂的碳 可以提高乙醇的选择性,其原因可能是
可以提高乙醇的选择性,其原因可能是_______ 。
(1)利用
 干重整反应可以对天然气资源综合利用,缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
干重整反应可以对天然气资源综合利用,缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:反应①:
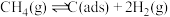 反应②:
反应②: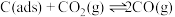
上述反应中
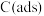 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:
①反应①是
 干重整反应的热化学方程式为
干重整反应的热化学方程式为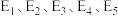 表示反应热)。
表示反应热)。②在恒压条件下,等物质的量的
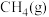 和
和 发生干重整反应时,各物质的平衡转化率随温度变化如图2所示。已知在干重整中还发生了副反应:
发生干重整反应时,各物质的平衡转化率随温度变化如图2所示。已知在干重整中还发生了副反应: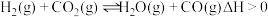 ,则表示
,则表示 平衡转化率的是曲线
平衡转化率的是曲线
③在恒压p、
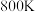 条件下,在密闭容器中充入等物质的量的
条件下,在密闭容器中充入等物质的量的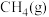 和
和 若图2中曲线A对应物质的平衡转化率为40%,曲线B对应物质的平衡转化率为20%,则以上反应平衡体系中
若图2中曲线A对应物质的平衡转化率为40%,曲线B对应物质的平衡转化率为20%,则以上反应平衡体系中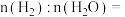

(2)二氧化碳电还原反应提供了一种生产乙醇的方法,已知反应过程中在三种不同催化剂表面(
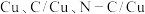 )的某个基元反应的能量变化如图所示(
)的某个基元反应的能量变化如图所示( 表示始态,
表示始态, 表示过渡态,
表示过渡态, 表示终态,*表示催化剂活性中心原子)。
表示终态,*表示催化剂活性中心原子)。
铜表面涂覆一层氮掺杂的碳
 可以提高乙醇的选择性,其原因可能是
可以提高乙醇的选择性,其原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】新能源是未来能源发展的方向,积极发展氢能是实现“碳达峰、碳中和”的重要举措。
(1)工业上常利用 合成二甲醚,其工艺流程如下:
合成二甲醚,其工艺流程如下: 直接加氢合成
直接加氢合成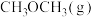 的热化学方程式:
的热化学方程式:___________ 。
(2) 通过加氢也可制得甲醇,其反应历程如图,下列说法正确的是
通过加氢也可制得甲醇,其反应历程如图,下列说法正确的是___________ (填序号)。 做催化剂,气体以一定的流速通过其表面,但对反应物的平衡转化率无影响
做催化剂,气体以一定的流速通过其表面,但对反应物的平衡转化率无影响
②该过程中,既有极性键和非极性键的断裂,也有极性键和非极性键的形成
③整个实验过程中原子的利用率达到了100%
④ 通过加氢制甲醇的反应式为
通过加氢制甲醇的反应式为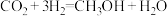
(3)将含有大量 的空气吹入
的空气吹入 溶液中,再把
溶液中,再把 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与 在催化剂作用下生成可再生能源甲醇,相关反应如下:
在催化剂作用下生成可再生能源甲醇,相关反应如下:
反应I:
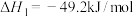
反应II:
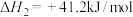
①现使用一种催化剂(CZZA/rGO),按 (总量为amol)投料于恒容密闭容器中进行反应,
(总量为amol)投料于恒容密闭容器中进行反应, 的平衡转化率和甲醇的选择率(甲醇的选择率为转化的
的平衡转化率和甲醇的选择率(甲醇的选择率为转化的 中生成甲醇的物质的量分数)随温度的变化趋势如图所示(忽略温度对催化剂的影响)。在513K达平衡时,反应体系内甲醇的物质的量为
中生成甲醇的物质的量分数)随温度的变化趋势如图所示(忽略温度对催化剂的影响)。在513K达平衡时,反应体系内甲醇的物质的量为___________ mol(列出计算式);随着温度的升高, 的平衡转化率增加,但甲醇的选择率降低,请分析其原因:
的平衡转化率增加,但甲醇的选择率降低,请分析其原因:___________ 。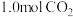 和
和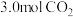 充入2L恒容密闭容器中,使其仅按反应I进行,在不同催化剂作用下,相同时间内
充入2L恒容密闭容器中,使其仅按反应I进行,在不同催化剂作用下,相同时间内 的转化率随温度变化如图示。下列说法错误的是
的转化率随温度变化如图示。下列说法错误的是___________ (填字母)。
B.b点 可能等于
可能等于
C.a点转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低
D. 与
与 的浓度比保持1∶3不再变化,说明该反应已达平衡状态
的浓度比保持1∶3不再变化,说明该反应已达平衡状态
③若将密闭容器恒定为1L,温度为180℃,起始时充入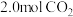 和
和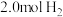 ,使其仅按反应II进行。已知:反应速率
,使其仅按反应II进行。已知:反应速率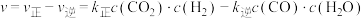 ,
, 平衡转化率为60%。该温度下
平衡转化率为60%。该温度下 与
与 的比值为
的比值为___________ (保留两位有效数字)。
(1)工业上常利用
 合成二甲醚,其工艺流程如下:
合成二甲醚,其工艺流程如下: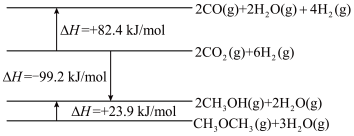
 直接加氢合成
直接加氢合成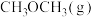 的热化学方程式:
的热化学方程式:(2)
 通过加氢也可制得甲醇,其反应历程如图,下列说法正确的是
通过加氢也可制得甲醇,其反应历程如图,下列说法正确的是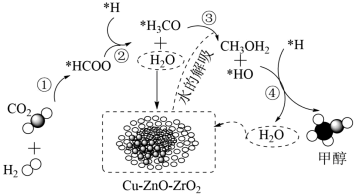
 做催化剂,气体以一定的流速通过其表面,但对反应物的平衡转化率无影响
做催化剂,气体以一定的流速通过其表面,但对反应物的平衡转化率无影响②该过程中,既有极性键和非极性键的断裂,也有极性键和非极性键的形成
③整个实验过程中原子的利用率达到了100%
④
 通过加氢制甲醇的反应式为
通过加氢制甲醇的反应式为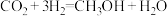
(3)将含有大量
 的空气吹入
的空气吹入 溶液中,再把
溶液中,再把 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与 在催化剂作用下生成可再生能源甲醇,相关反应如下:
在催化剂作用下生成可再生能源甲醇,相关反应如下:反应I:

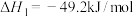
反应II:

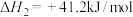
①现使用一种催化剂(CZZA/rGO),按
 (总量为amol)投料于恒容密闭容器中进行反应,
(总量为amol)投料于恒容密闭容器中进行反应, 的平衡转化率和甲醇的选择率(甲醇的选择率为转化的
的平衡转化率和甲醇的选择率(甲醇的选择率为转化的 中生成甲醇的物质的量分数)随温度的变化趋势如图所示(忽略温度对催化剂的影响)。在513K达平衡时,反应体系内甲醇的物质的量为
中生成甲醇的物质的量分数)随温度的变化趋势如图所示(忽略温度对催化剂的影响)。在513K达平衡时,反应体系内甲醇的物质的量为 的平衡转化率增加,但甲醇的选择率降低,请分析其原因:
的平衡转化率增加,但甲醇的选择率降低,请分析其原因:
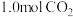 和
和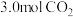 充入2L恒容密闭容器中,使其仅按反应I进行,在不同催化剂作用下,相同时间内
充入2L恒容密闭容器中,使其仅按反应I进行,在不同催化剂作用下,相同时间内 的转化率随温度变化如图示。下列说法错误的是
的转化率随温度变化如图示。下列说法错误的是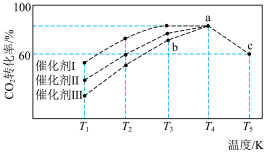
B.b点
 可能等于
可能等于
C.a点转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低
D.
 与
与 的浓度比保持1∶3不再变化,说明该反应已达平衡状态
的浓度比保持1∶3不再变化,说明该反应已达平衡状态③若将密闭容器恒定为1L,温度为180℃,起始时充入
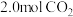 和
和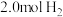 ,使其仅按反应II进行。已知:反应速率
,使其仅按反应II进行。已知:反应速率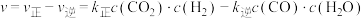 ,
, 平衡转化率为60%。该温度下
平衡转化率为60%。该温度下 与
与 的比值为
的比值为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
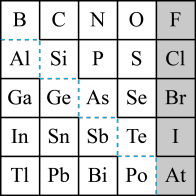
(1)元素Ga在元素周期表中的位置为:__________ (写明周期和族)。
(2)Sn的最高正价为______ ,Cl的最高价氧化物对应水化物的化学式为_____ ,As的气态氢化物为_____ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是_____ (填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4_____ H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O_____ H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找_____ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为_________ 。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。 下列说法正确的是_____ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。

(1)元素Ga在元素周期表中的位置为:
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
(4)可在图中分界线(虚线部分)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。 下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
| 实验步骤 | 实验现象与结论 |
| 在试管中加入 | 现象: 结论:非金属性C>Si |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。
(1)M与Y形成的化合物中含____ 键,属___ 分子(填“极性”或“非极性”)。
(2)N元素形成的单质分子中的化学键类型及数目是__ (填“σ键”或“π键”)。在化学反应中___ 易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为____ 。其中的化学键有_____ 。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式:_____ 。
| M | N | ||
| X | Y |
(2)N元素形成的单质分子中的化学键类型及数目是
(3)由N、Y的氢化物相互作用所生成的物质的电子式为
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】已知A、B、C、D、E、F是周期表中原子序数依次增大的前20号元素,A的原子核外只有一个电子,B、C原子的最外层电子数分别是其电子层数的2、3倍,D的原子半径是短周期元素中原子半径最大的,BE2可以用于除去试管内壁残留的E单质,F的焰色为砖红色。回答下列问题:
(1)元素B在周期表中的位置为___________ 。
(2)A、C、D三种元素形成的化合物中含有的化学键为___________ 。
(3)A2C的熔点比A2E更高,因为___________ 。
(4)写出下列两种物质的电子式:BE2:___________ ,FC2:___________ 。
(5)用电子式表示A2E的形成过程:___________ 。
(6)化合物D2E2C3俗称海波,常用作照相业定影剂。向D2E2C3溶液中加入稀H2SO4,产生淡黄色沉淀和刺激性气味气体的离子方程式为___________ 。
(1)元素B在周期表中的位置为
(2)A、C、D三种元素形成的化合物中含有的化学键为
(3)A2C的熔点比A2E更高,因为
(4)写出下列两种物质的电子式:BE2:
(5)用电子式表示A2E的形成过程:
(6)化合物D2E2C3俗称海波,常用作照相业定影剂。向D2E2C3溶液中加入稀H2SO4,产生淡黄色沉淀和刺激性气味气体的离子方程式为
您最近一年使用:0次



