(Ⅰ)已知在448℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g) H2(g)+I2(g)的平衡常数K2为
H2(g)+I2(g)的平衡常数K2为___ ;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___ 。
(2)该反应为___ 反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___ 。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)•C(H2)=c(CO)•c(H2O),判断此时温度为___ ℃。
 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g) H2(g)+I2(g)的平衡常数K2为
H2(g)+I2(g)的平衡常数K2为(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)•C(H2)=c(CO)•c(H2O),判断此时温度为
更新时间:2019-11-19 16:44:36
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】在一体积为1 L的密闭容器中,通入一定量的CO和H2O,在850 ℃ 发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH<0。CO和H2O浓度变化如图:
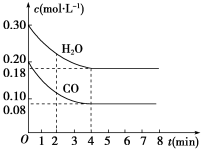
(1)0~4 min的平均反应速率v(CO)=_______ mol·(L·min)-1。
(2)850 ℃时,平衡常数K=_______ ,温度升高,平衡常数_______ (增大、不变或减小)
(3)850 ℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为_______ 。
(4)能判断该反应达到化学平衡状态的依据是_______ (填选项序号)。
a.v正(H2)=v逆(H2O) b.c(CO2)=c(CO)
c.容器中气体密度不变 d.1 mol H-H键断裂的同时断裂2 mol H-O键

(1)0~4 min的平均反应速率v(CO)=
(2)850 ℃时,平衡常数K=
(3)850 ℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为
(4)能判断该反应达到化学平衡状态的依据是
a.v正(H2)=v逆(H2O) b.c(CO2)=c(CO)
c.容器中气体密度不变 d.1 mol H-H键断裂的同时断裂2 mol H-O键
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181kJ·mol-1
(1)若某反应的平衡常数表达式为K=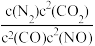 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_____ ;下列措施能够增大此反应中NO的转化率的是(填字母代号)______ 。
A.增大容器压强B.升高温度C.使用优质催化剂D.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
①0∼5min内,以CO2表示的该反应速率v(CO2)=_______ ,该条件下的平衡常数K=_____ 。
②第15min后,温度调整到T2,数据变化如上表所示,则T1____ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,则此时反应_____ 移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=____________ 。
(3)工业上可以用氨水除去反应C(s)+2NO(g) N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=_____ 。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181kJ·mol-1
(1)若某反应的平衡常数表达式为K=
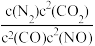 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:A.增大容器压强B.升高温度C.使用优质催化剂D.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0∼5min内,以CO2表示的该反应速率v(CO2)=
②第15min后,温度调整到T2,数据变化如上表所示,则T1
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,则此时反应
(3)工业上可以用氨水除去反应C(s)+2NO(g)
 N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答问题:
(1)Deacon发明的直接氧化法为:4HCl(g) + O2(g) 2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)
2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)_________ K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比的数据计算c(HCl):c(O2) = 1:1的数据计算K(400℃)=________________ (列出计算式即可)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2) 过低、过高的不利影响分别___________________________ 、____________________________ 。

(2)在一定温度的条件下,进一步提高HCl的转化率的方法是__________________________ 、___________________________________ 。(写出2种)
(1)Deacon发明的直接氧化法为:4HCl(g) + O2(g)
 2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)
2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)
(2)在一定温度的条件下,进一步提高HCl的转化率的方法是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】把二氧化碳“变废为宝”是实现碳达峰、碳中和的关键。
(1)体积为1 L的恒温密闭容器中,充入1 mol 和3 mol
和3 mol  ,在一定条件下反应:
,在一定条件下反应: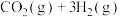
 。测得
。测得 和
和 的浓度变化随时间变化如图1所示。
的浓度变化随时间变化如图1所示。
___________ mol⋅L ⋅min
⋅min
(2)能说明上述反应达到平衡状态的是___________ 。(填字母)
a.混合气体的压强不随时间的变化而变化
b.单位时间内每生成1 mol ,同时生成3 mol
,同时生成3 mol 
c.反应中 和
和 的物质量浓度之比为1∶1
的物质量浓度之比为1∶1
(3)平衡时 的转化率为
的转化率为___________ 。
(4)我国学者提出的 催化加氢合成
催化加氢合成 的机理如图2(其中吸附在催化剂表面的物种用*标注)所示。下列说法正确的是
的机理如图2(其中吸附在催化剂表面的物种用*标注)所示。下列说法正确的是___________ 。(填字母) 的反应速率
的反应速率
b.反应机理表明 参与了
参与了 合成
合成 的反应
的反应
c.反应④中存在共价键的断裂和共价键的生成
(1)体积为1 L的恒温密闭容器中,充入1 mol
 和3 mol
和3 mol  ,在一定条件下反应:
,在一定条件下反应: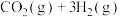
 。测得
。测得 和
和 的浓度变化随时间变化如图1所示。
的浓度变化随时间变化如图1所示。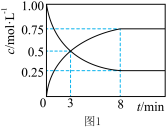

 ⋅min
⋅min
(2)能说明上述反应达到平衡状态的是
a.混合气体的压强不随时间的变化而变化
b.单位时间内每生成1 mol
 ,同时生成3 mol
,同时生成3 mol 
c.反应中
 和
和 的物质量浓度之比为1∶1
的物质量浓度之比为1∶1(3)平衡时
 的转化率为
的转化率为(4)我国学者提出的
 催化加氢合成
催化加氢合成 的机理如图2(其中吸附在催化剂表面的物种用*标注)所示。下列说法正确的是
的机理如图2(其中吸附在催化剂表面的物种用*标注)所示。下列说法正确的是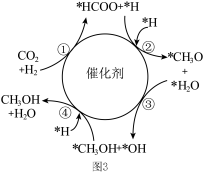
 的反应速率
的反应速率b.反应机理表明
 参与了
参与了 合成
合成 的反应
的反应c.反应④中存在共价键的断裂和共价键的生成
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气( 与
与 的混合气体)转化成甲醇,反应为
的混合气体)转化成甲醇,反应为 。
。
(1)CO的平衡转化率与温度,压强的关系如图所示:
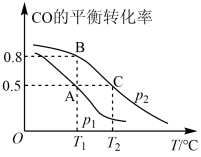
①p1、p2的大小关系是p1________ p2 (填“>、<或=”)。
②下列叙述能说明上述反应能达到化学平衡状态的是________ (填代号)。
a.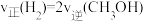
b. 的体积分数不再改变
的体积分数不再改变
c.混合气体的密度不再改变
d.同一时间内,消耗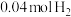 ,生成
,生成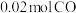
(2)在 ℃、p2压强时,往一容积为
℃、p2压强时,往一容积为 的密闭容器内,充入
的密闭容器内,充入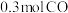 与
与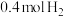 发生反应。
发生反应。
①此时的浓度平衡常数K=________ ;平衡后再加入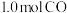 后重新到达平衡,则
后重新到达平衡,则 的转化率
的转化率________ (填“增大,不变或减小”); 与
与 的浓度比
的浓度比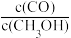
________ (填“增大,不变或减小”)。
②若 压强恒定为
压强恒定为 ,则平衡常数
,则平衡常数
________ ( 用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含
用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含 的最简表达式)。
的最简表达式)。
 与
与 的混合气体)转化成甲醇,反应为
的混合气体)转化成甲醇,反应为 。
。(1)CO的平衡转化率与温度,压强的关系如图所示:

①p1、p2的大小关系是p1
②下列叙述能说明上述反应能达到化学平衡状态的是
a.
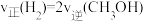
b.
 的体积分数不再改变
的体积分数不再改变c.混合气体的密度不再改变
d.同一时间内,消耗
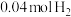 ,生成
,生成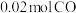
(2)在
 ℃、p2压强时,往一容积为
℃、p2压强时,往一容积为 的密闭容器内,充入
的密闭容器内,充入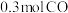 与
与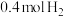 发生反应。
发生反应。①此时的浓度平衡常数K=
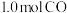 后重新到达平衡,则
后重新到达平衡,则 的转化率
的转化率 与
与 的浓度比
的浓度比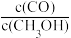
②若
 压强恒定为
压强恒定为 ,则平衡常数
,则平衡常数
 用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含
用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含 的最简表达式)。
的最简表达式)。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
①反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=
CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________ (用ΔH1和ΔH2表示),K=________ (用K1和K2表示)。
②能判断CO2(g)+H2(g) CO(g)+H2O(g)达到化学平衡状态的依据是
CO(g)+H2O(g)达到化学平衡状态的依据是____ (填字母)。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为________ ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为________ mol·L-1。
②下列措施中能使平衡时 增大的是
增大的是________ (填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
 FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:| 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
 CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=
CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=②能判断CO2(g)+H2(g)
 CO(g)+H2O(g)达到化学平衡状态的依据是
CO(g)+H2O(g)达到化学平衡状态的依据是A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
①该条件下反应的平衡常数为
②下列措施中能使平衡时
 增大的是
增大的是A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
(1)推导反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________ 。
(2)通过K值的计算,(1)中的反应是_________ 反应(填“吸热”或“放热”)。
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(g),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
①前2min,用CO表示的该化学反应的速率是:_______________________ 。
②在3~4min之间,反应处于___________ 状态(填“平衡”或“非平衡”)。
③第6min时,平衡向_________ 方向移动,可能的原因是______________________ 。
已知反应Fe(s)+CO2(g)
 FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
 FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:(2)通过K值的计算,(1)中的反应是
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(g),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
| 时间/min | CO2 | H2O | CO | H2 |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
②在3~4min之间,反应处于
③第6min时,平衡向
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:
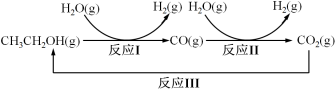
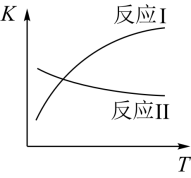
已知:反应I和反应II的平衡常数随温度变化曲线如图所示。
(1)反应I中,1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ。
①H2O的电子式是_______ 。
②反应I的热化学方程式是_______ 。
(2)反应II,在进气比[n(CO): n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
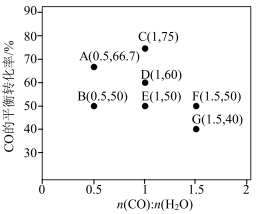
①图中D、E两点对应的反应温度分别为TD和TE.判断:TD_______ TE(填“<” “=”或“>”)。
②经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的_______ 相同。
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是_______ 。

已知:反应I和反应II的平衡常数随温度变化曲线如图所示。

(1)反应I中,1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ。
①H2O的电子式是
②反应I的热化学方程式是
(2)反应II,在进气比[n(CO): n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。

①图中D、E两点对应的反应温度分别为TD和TE.判断:TD
②经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是
您最近一年使用:0次
【推荐3】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为______ 。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)⇌2CO2(g)的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)a、b、c、d四点中,达到平衡状态的是______ 。
(3)已知c点时容器中O2浓度为0.02mol•L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=______ (用含x的代数式表示)。
(4)观察分析图,回答下列问题:
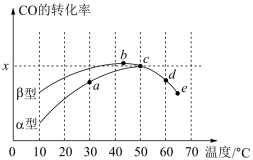
①CO转化反应的平衡常数K(a)______ K(c)。
②在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要______ (填“大”、“小”)。
③______ 点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)⇌2CO2(g)的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)a、b、c、d四点中,达到平衡状态的是
(3)已知c点时容器中O2浓度为0.02mol•L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=
(4)观察分析图,回答下列问题:

①CO转化反应的平衡常数K(a)
②在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要
③
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】某化学反应2 A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol∙L-1)随反应时间(min)的变化情况如下表所示。
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol∙L-1)随反应时间(min)的变化情况如下表所示。

根据上述数据,完成下列填空:
(1)在实验1中,反应在10~20 min时间内A的平均反应速率为___________ mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________ mol·L-1。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_____ vl(填“>”、“="或“<”)。
(4)比较实验4和实验1,可推测该反应是_______ (填“吸热”或“放热”)反应。
理由是_____________________________________________________________ 。
 B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol∙L-1)随反应时间(min)的变化情况如下表所示。
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol∙L-1)随反应时间(min)的变化情况如下表所示。
根据上述数据,完成下列填空:
(1)在实验1中,反应在10~20 min时间内A的平均反应速率为
(2)在实验2中,A的初始浓度c2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(4)比较实验4和实验1,可推测该反应是
理由是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在一固定容积的密闭容器中,进行如下化学反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。其化学平衡常数K和温度t的关系如下:
请回答:
(1)上述反应正向进行时,反应为_______ 热反应(填“放”或“吸”)。
(2)能判断该反应已经达到化学平衡状态的依据是_______ 。
a.容器内压强不变 b.v正(H2) = v逆(CO) c.CO2的质量分数不变
(3)温度为850℃时,可逆反应CO (g) + H2O (g)⇌CO2 (g) + H2 (g) 在固定容积的密闭容器中进行,容器内各物质的浓度变化如下:
计算:3min时(CO的浓度)c1 =_______ mol/L,H2O (g)的转化率=_______ 。
(4)表中5min~6min之间数值发生变化,可能的原因是_______(单选)。
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)上述反应正向进行时,反应为
(2)能判断该反应已经达到化学平衡状态的依据是
a.容器内压强不变 b.v正(H2) = v逆(CO) c.CO2的质量分数不变
(3)温度为850℃时,可逆反应CO (g) + H2O (g)⇌CO2 (g) + H2 (g) 在固定容积的密闭容器中进行,容器内各物质的浓度变化如下:
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
计算:3min时(CO的浓度)c1 =
(4)表中5min~6min之间数值发生变化,可能的原因是_______(单选)。
| A.增加水蒸气 | B.降低温度 | C.使用催化剂 | D.增加氢气浓度 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g) 2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是______ %(保留整数)。
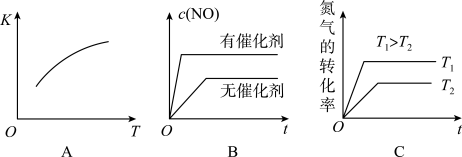
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应__________ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 _______ 。将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 ________ (填字母序号)。
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______ (填“变大、“变小”或“不变)
 2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:(1)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应

(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数
您最近一年使用:0次



