常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是______ (填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:_______________ 。
(3)向④中加入少量氯化铵固体,此时 的值
的值________ (填“增大”、“减小”、或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________ ④的体积(填“大于”、“小于”或“等于”)
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________ 。
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:
(3)向④中加入少量氯化铵固体,此时
 的值
的值(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=
更新时间:2019-12-15 14:12:30
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
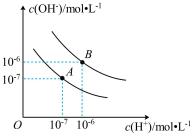
(1)则25 ℃时水的电离平衡曲线应为_______ (填“A”或“B”),请说明理由_____________________ 。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________ 。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______ (填“强”或“弱”)酸
(5)下列溶液pH随温度的变化如图所示的是______ (不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸

(6)下表室温下为几种弱电解质的电离平衡常数
少量CO2与NaHS反应的离子方程式为_________________________________________ 。室温下,CH3COONH4溶液的pH_________ 7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________ (用离子方程式表示)

(1)则25 ℃时水的电离平衡曲线应为
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为
(5)下列溶液pH随温度的变化如图所示的是
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸

(6)下表室温下为几种弱电解质的电离平衡常数
| CH3COOH | H2CO3 | H2S | NH3·H2O |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
(1)常温下,0.05mol/L硫酸溶液中,
___________ mol/L,pH值为___________ ,水电离的
___________ mol/L;25℃ 的盐酸中,由水电离产生的
的盐酸中,由水电离产生的 的物质的量浓度为
的物质的量浓度为___________ 。
(2)氨水和稀盐酸反应后的溶液呈中性,所得溶液中的离子浓度大小关系是___________ 。
(3)某温度(t℃)时,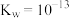 ,则该温度(填大于、等于或小于)
,则该温度(填大于、等于或小于)___________ 25℃,理由是___________ 。将此温度下pH=11的NaOH溶液a L与pH=l的 溶液b L混合,若所得混合溶液为中性,则a:b=
溶液b L混合,若所得混合溶液为中性,则a:b=___________ ;
(4)已知 的
的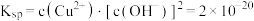 。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。则①某
。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。则①某 溶液里
溶液里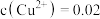 mol/L,如要生成
mol/L,如要生成 沉淀,应调整溶液的pH大于
沉淀,应调整溶液的pH大于___________ 。
②要使0.2
 溶液中
溶液中 沉淀较为完全(使
沉淀较为完全(使 浓度降至原来的千分之一),则应向溶液里加入
浓度降至原来的千分之一),则应向溶液里加入 溶液,使溶液的pH为
溶液,使溶液的pH为___________ 。
(1)常温下,0.05mol/L硫酸溶液中,


 的盐酸中,由水电离产生的
的盐酸中,由水电离产生的 的物质的量浓度为
的物质的量浓度为(2)氨水和稀盐酸反应后的溶液呈中性,所得溶液中的离子浓度大小关系是
(3)某温度(t℃)时,
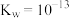 ,则该温度(填大于、等于或小于)
,则该温度(填大于、等于或小于) 溶液b L混合,若所得混合溶液为中性,则a:b=
溶液b L混合,若所得混合溶液为中性,则a:b=(4)已知
 的
的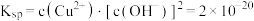 。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。则①某
。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。则①某 溶液里
溶液里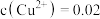 mol/L,如要生成
mol/L,如要生成 沉淀,应调整溶液的pH大于
沉淀,应调整溶液的pH大于②要使0.2

 溶液中
溶液中 沉淀较为完全(使
沉淀较为完全(使 浓度降至原来的千分之一),则应向溶液里加入
浓度降至原来的千分之一),则应向溶液里加入 溶液,使溶液的pH为
溶液,使溶液的pH为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】室温下,已知: CH3COOH的电离平衡常数Ka=1.8×10-5;H2SO3的电离平衡常数Kal=1.0×10-2、Ka2=1.0×10-7,回答下列问题:
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________ 倍。
(2)室温时,NaHSO3的水解平衡常数Kh=________ ,NaHSO3溶液中的各离子浓度由大到小的顺序为________________ 。若向NaHSO3溶液中加入少量I2,则溶液中c(H2SO3)/c(HSO3-)将________ (填“增大”、“减小”或“不变”)
(3)室温时,0.1 mol/L Na2SO3溶液的pH=________
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的
(2)室温时,NaHSO3的水解平衡常数Kh=
(3)室温时,0.1 mol/L Na2SO3溶液的pH=
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】I.现有以下几种物质①盐酸②醋酸③氢氧化钠④硝酸铵⑤醋酸钠⑥氨水⑦亚硫酸氢钠⑧水。请回答下列问题:
(1)以上物质属于弱电解质的是_______ (填数字序号)。
(2)常温下④的溶液pH<7的原因是_______ (用离子方程式表示)。
(3)常温下⑦的水溶液呈酸性,原因是_______ (用文字叙述)。
(4)常温下,将aLpH=l1的NaOH溶液与bLpH=1的HNO3溶液混合(忽略混合后溶液密度的变化),若所得混合溶液的pH=2,则b:a=_______ 。
(5)已知:
a.常温下:CH3COOH和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O;
则NH4HCO3溶液呈_______ 性(填“酸”、“碱”或“中”)。
II.25℃时,向盛有50mLpH=3的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。

(6)由图可以推出HA溶液的物质的量浓度为_______ ,25℃时,pH=3的HA溶液的电离度为_______ 。
(7)b点溶液存在质子守恒关系,其关系式是_______ 。
III.(8)已知:Ksp[Al(OH)3]=1×10-33,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为_______ 。
(1)以上物质属于弱电解质的是
(2)常温下④的溶液pH<7的原因是
(3)常温下⑦的水溶液呈酸性,原因是
(4)常温下,将aLpH=l1的NaOH溶液与bLpH=1的HNO3溶液混合(忽略混合后溶液密度的变化),若所得混合溶液的pH=2,则b:a=
(5)已知:
a.常温下:CH3COOH和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O;
则NH4HCO3溶液呈
II.25℃时,向盛有50mLpH=3的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。

(6)由图可以推出HA溶液的物质的量浓度为
(7)b点溶液存在质子守恒关系,其关系式是
III.(8)已知:Ksp[Al(OH)3]=1×10-33,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为
您最近一年使用:0次



