在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
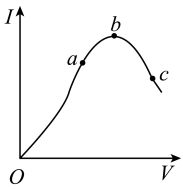
(1)“O”点处冰醋酸的导电能力为0的原因是_______________________ ;
(2)在a、b、c三点处,溶液中c(H+)由小到大的顺序为________ (用字母表示);
(3)在a、b、c三点处,电离程度最大的是________ (用字母表示);
(4)若使c点处的溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施有①_____________ ;②______________ ;③____________ 。

(1)“O”点处冰醋酸的导电能力为0的原因是
(2)在a、b、c三点处,溶液中c(H+)由小到大的顺序为
(3)在a、b、c三点处,电离程度最大的是
(4)若使c点处的溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施有①
更新时间:2019-12-15 13:02:56
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】常温下,0.1mol/L的下列五种溶液:
①CH3COOH②NaClO③NH4Cl④NaCl⑤CH3COONa,其pH由大到小的排列顺序是_______ 。
①CH3COOH②NaClO③NH4Cl④NaCl⑤CH3COONa,其pH由大到小的排列顺序是
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】化学平衡移动原理同样也适用于其他平衡。已知在氨水中存在下列平衡:NH3+H2O⇌NH3·H2O⇌_______
(1)补充完题干中的电离方程式:NH3·H2O⇌_______ ,加热滴有酚酞的氨水,其颜色会_______ 。(填“深”或“浅”)
(2)向氨水中加入MgCl2固体时,平衡向_______ 移动,OH-的浓度_______ , 的浓度
的浓度_______ (填“减小”“增大”或“不变”)。
(3)向氨水中加入浓盐酸,平衡向_______ 移动,此时溶液中浓度增大的离子_______ 。
(4)向浓氨水中加入少量NaOH固体,平衡向_______ 移动,此时发生的现象是_______ 。
(5)常温下,NH3·H2O 的电离常数为2×10-5,则NH4Cl水溶液水解常数Kh=_______ 。
(6)0.1mol/LHCl的pH=_______ ,水电离出的c(OH-)=_______ ,此溶液中的电荷守恒表达式为_______ 。
(1)补充完题干中的电离方程式:NH3·H2O⇌
(2)向氨水中加入MgCl2固体时,平衡向
 的浓度
的浓度(3)向氨水中加入浓盐酸,平衡向
(4)向浓氨水中加入少量NaOH固体,平衡向
(5)常温下,NH3·H2O 的电离常数为2×10-5,则NH4Cl水溶液水解常数Kh=
(6)0.1mol/LHCl的pH=
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】体积相同、pH相同的HCl溶液和CH3COOH溶液分别与NaOH溶液中和时,二者所消耗NaOH的物质的量的关系是___________ ,理由是___________ 。
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】25℃时,三种酸的电离平衡常数如表所示。
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH,HClO,H3PO3溶液中,c(H+)最小的是___ 。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是___ (填“酸式盐”“碱式盐”或“正盐”)。H3PO3的第二级电离方程式为___ 。此时的电离平衡常数表达式K=___ 。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是___ (填字母)。
A.c(H+) B. C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
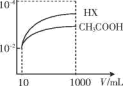
(4)体积均为10mL、c(H+)均为10-2mol/L的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示测HX的电离平衡常数___ (填“大于”、“小于”或“等于”)醋酸的电离平衡常数,理由是___ 。
| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ki=8.3×10-3 K2=5.6×10-6 |
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH,HClO,H3PO3溶液中,c(H+)最小的是
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是
A.c(H+) B.
 C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)(4)体积均为10mL、c(H+)均为10-2mol/L的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示测HX的电离平衡常数

您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】(1)写出醋酸的电离方程式:_____________________________________ ;
(2)写出醋酸电离平衡常数表达式:_______________ ;
(3)向0.1mol/L 醋酸溶液中加入水,电离平衡向_______ 移动 (填“左”或“右”) ;n(CH3COOH)_______ ; c(CH3COOH)/c(H+)_______ (填“增大”、“减小”或“不变”);
(4)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液b与足量Zn粉反应,初始速率a___ b;生成H2的量a____ b;完全中和这两种酸,消耗NaOH的量a___ b(填“<”、“>”或“=”)。
(2)写出醋酸电离平衡常数表达式:
(3)向0.1mol/L 醋酸溶液中加入水,电离平衡向
(4)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液b与足量Zn粉反应,初始速率a
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】(1)氨水中存在:NH3·H2O
 +OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
+OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
按照要求填空(答案选填物质对应的字母):
①电离平衡会向正向移动是_________ ,电离平衡会向逆向移动是__________ 。
②c( )、c(OH-)都增大的是
)、c(OH-)都增大的是___________ ,c( )、c(OH-)都变小的是
)、c(OH-)都变小的是___________ 。
③c( )增大,c(OH-)减小的是
)增大,c(OH-)减小的是___________ 。
④c( )减小,c(OH-)增大的是
)减小,c(OH-)增大的是___________ 。
(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为_________ ,若此温度下醋酸的电离常数K=1×10−5,pH为______ ,若升高温度, K将___________ (填“变大”、“变小”或“不变”)。
(3)Ⅰ、现有浓度均为0.1 mol∙L−1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①若三种溶液中c(H+)分别为a mol∙L−1、b mol∙L−1、c mol∙L−1,则它们的大小关系为__________ 。
②等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为A mol、B mol、C mol,则它们的大小关系为__________ 。
Ⅱ、现有pH=3的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为________________ 。
②分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为____________ 。

 +OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
+OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。按照要求填空(答案选填物质对应的字母):
①电离平衡会向正向移动是
②c(
 )、c(OH-)都增大的是
)、c(OH-)都增大的是 )、c(OH-)都变小的是
)、c(OH-)都变小的是③c(
 )增大,c(OH-)减小的是
)增大,c(OH-)减小的是④c(
 )减小,c(OH-)增大的是
)减小,c(OH-)增大的是(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为
(3)Ⅰ、现有浓度均为0.1 mol∙L−1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①若三种溶液中c(H+)分别为a mol∙L−1、b mol∙L−1、c mol∙L−1,则它们的大小关系为
②等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为A mol、B mol、C mol,则它们的大小关系为
Ⅱ、现有pH=3的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为
②分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】现有下列8种物质:①Na2CO3(aq)②NaHCO3(s)③液态氯化氢④Al(OH)3(s)⑤NaOH(s)⑥氯水⑦浓氨水⑧熔融的NaCl
(1)其中能导电且属于电解质的是___ (填序号),NaOH的电离方程式为___ 。
(2)Na2CO3溶液显碱性的原因____ (用离子方程式表示)。
(3)④加入⑤的水溶液中,反应的离子方程式为____ 。
(4)实验室可在⑦中加入⑤快速制取氨气,请用化学平衡移动原理简述原因____ 。
(5)分别采取下列措施后,氯水的漂白能力从强到弱的顺序为___ (用字母表示)。
A.加入少量CaCO3固体 B.不加任何物质 C.加入少量Na2SO3固体
(1)其中能导电且属于电解质的是
(2)Na2CO3溶液显碱性的原因
(3)④加入⑤的水溶液中,反应的离子方程式为
(4)实验室可在⑦中加入⑤快速制取氨气,请用化学平衡移动原理简述原因
(5)分别采取下列措施后,氯水的漂白能力从强到弱的顺序为
A.加入少量CaCO3固体 B.不加任何物质 C.加入少量Na2SO3固体
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】一水合氨(NH3·H2O)是一种常见的弱碱,回答下列问题:
在0.1mol·L﹣1氨水中加入下列物质,一水合氨的电离平衡及平衡时物质的浓度的变化:
(1)写出NH3·H2O的电离方程式____ 。
(2)向氨水中加入NH4Cl固体,电离平衡向___ 移动(填“正向”、“逆向”或“不移动”,下同);pH ___ (填“增大”、“减小”或“不变”,下同)
(3)向氨水中加入FeCl3固体,电离平衡向_____ 移动;c(NH3·H2O)______
(4)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0mol∙L-1,则溶液中OH-的浓度是___ mol∙L-1。
在0.1mol·L﹣1氨水中加入下列物质,一水合氨的电离平衡及平衡时物质的浓度的变化:
(1)写出NH3·H2O的电离方程式
(2)向氨水中加入NH4Cl固体,电离平衡向
(3)向氨水中加入FeCl3固体,电离平衡向
(4)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0mol∙L-1,则溶液中OH-的浓度是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】25℃ 时,硫氢化钾溶液里存在下列平衡:a. HS-+H2O OH-+H2S b.HS-
OH-+H2S b.HS- H++S2-
H++S2-
(1)平衡a 是__________ 平衡;平衡b是________ 平衡。(填“电 离”或“水 解”)
(2)向KHS溶液中加入氢氧化钠固体时,c(S2-)将________ (填“增 大”“ 减小”或“不 变”, 下同);向KHS溶液中通入HCl时,c(HS-)将______________ 。
(3)向KHS溶液中加入硫酸铜溶液时,有黑色沉淀(CuS)产生,则平衡a_________ (填“正向” “逆向”或“不”,下 同 )移动, 平 衡b___________ 移 动。
 OH-+H2S b.HS-
OH-+H2S b.HS- H++S2-
H++S2-(1)平衡a 是
(2)向KHS溶液中加入氢氧化钠固体时,c(S2-)将
(3)向KHS溶液中加入硫酸铜溶液时,有黑色沉淀(CuS)产生,则平衡a
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】回答下列问题:
(1)为了证明醋酸是弱电解质,某同学分别取pH=3醋酸和盐酸各1mL,分别用蒸馏水稀释到100mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是_______ 。
(2)已知室温时,0.1 mol∙L−1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中c(H+)=_______ mol∙L−1。
②HA的电离平衡常数K=_______ 。
③由HA电离出的c(H+)约为水电离出的c(H+)的_______ 倍。
(3)部分弱酸的电离平衡常数如下表:
①在相同浓度的HCOOH和HClO的溶液中,用“>”“<”或“=”填空。
溶液导电能力:HCOOH_______ HClO。
② 的电离平衡常数表达式为
的电离平衡常数表达式为_______
③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式_______ 。
(4)某浓度的氨水中存在平衡:NH3·H2O
 +OH-,如想增大
+OH-,如想增大 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是_______ (填字母)。
a.适当升高温度 b.加入NH4Cl固体 c.通入NH3 d.加入少量浓盐酸
(1)为了证明醋酸是弱电解质,某同学分别取pH=3醋酸和盐酸各1mL,分别用蒸馏水稀释到100mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是
(2)已知室温时,0.1 mol∙L−1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中c(H+)=
②HA的电离平衡常数K=
③由HA电离出的c(H+)约为水电离出的c(H+)的
(3)部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | H2CO3 | HClO |
电离平衡常数/25 ℃ | K=1.77×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
溶液导电能力:HCOOH
②
 的电离平衡常数表达式为
的电离平衡常数表达式为③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式
(4)某浓度的氨水中存在平衡:NH3·H2O

 +OH-,如想增大
+OH-,如想增大 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是a.适当升高温度 b.加入NH4Cl固体 c.通入NH3 d.加入少量浓盐酸
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】常温下,有c(H+)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
(1)加适量醋酸钠晶体后,醋酸溶液中c(H+)_______ (填“增大”“减小”或“不变”,下同),盐酸中c(H+)______ 。
(2)加水稀释10倍后,醋酸溶液中的c(H+)______ (填“>”“=”或“<”)盐酸中的c(H+)。
(3)加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸_______ (填“>”“=”或“<”)盐酸。
(4)使温度都升高20℃,溶液中c(H+):醋酸________ (填“>”“=”或“<”)盐酸。
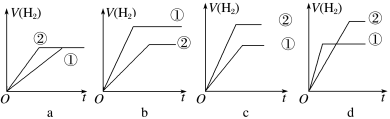
(5)分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______ (填字母)。(①表示盐酸,②表示醋酸)
(1)加适量醋酸钠晶体后,醋酸溶液中c(H+)
(2)加水稀释10倍后,醋酸溶液中的c(H+)
(3)加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸
(4)使温度都升高20℃,溶液中c(H+):醋酸
(5)分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

您最近一年使用:0次

 传感器测量
传感器测量 溶液的
溶液的

